Для определения фактора эквивалентности необходимо учитывать прежде всего тип химической реакции.
§ В кислотно-основной реакции надо определить, какая доля частицы (иона или молекулы) соответствует 1 иону Н+ (или 1 иону ОН-). Например, в реакции
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
f экв(H3PO4) =  , поскольку в 1 молекуле H3PO4 замещается 2 иона Н+, следовательно,
, поскольку в 1 молекуле H3PO4 замещается 2 иона Н+, следовательно,  часть молекулы H3PO4 отдает 1 ион Н+.
часть молекулы H3PO4 отдает 1 ион Н+.
§ В окислительно-восстановительной реакции надо определить, какая доля частицы (иона или молекулы) соответствует 1 электрону. Например, в реакции

f экв(I2) =  , а f экв(I-) = 1, поскольку 1 молекула I2 принимает 2 электрона, а каждый ион I- отдает 1 электрон.
, а f экв(I-) = 1, поскольку 1 молекула I2 принимает 2 электрона, а каждый ион I- отдает 1 электрон.
§ В реакциях комплексообразования и осаждения надо определить, какая доля частицы (иона или молекулы) соответствует 1 единице заряда. Например, в реакции

f экв(Ba2+) =  , поскольку на 1 ион Ba2+ приходится 2 единицы заряда, следовательно, на
, поскольку на 1 ион Ba2+ приходится 2 единицы заряда, следовательно, на  часть иона Ba2+ будет приходиться 1 единица заряда.
часть иона Ba2+ будет приходиться 1 единица заряда.
Особые случаи расчета фактора эквивалентности
в титриметрическом анализе
1. В комплексонометрии при использовании в качестве титранта раствора этилендиаминтетраацетата натрия (ЭДТА, комплексон III, трилон Б) факторы эквивалентности ионов металлов с зарядами +2, +3, +4 и самогó ЭДТА всегда равны  , поскольку в любой из этих реакций ион металла реагирует с ЭДТА в отношении 1: 1 и в результате протекания реакции выделяется 2 иона Н+:
, поскольку в любой из этих реакций ион металла реагирует с ЭДТА в отношении 1: 1 и в результате протекания реакции выделяется 2 иона Н+:
Me2+ + H2Y2- = MeY2- + 2Н+,
Me3+ + H2Y2- = MeY- + 2Н+,
Me4+ + H2Y2- = MeY + 2Н+.
2. В более сложных случаях (многостадийный анализ, реакции с участием органических веществ и некоторые др.), когда возникают сомнения в правильности определения фактора эквивалентности вещества, лучше всего составить пропорцию с учетом стехиометрии реакции. Например, реакция протекает в соответствии с уравнением:
K2Cr2O7 + 2BaCl2 + H2O = 2BaCrO4¯ + 2KCl + 2HCl.
В этой реакции f экв(Ba2+) =  , поскольку на 1 ион Ba2+ приходится 2 единицы заряда.
, поскольку на 1 ион Ba2+ приходится 2 единицы заряда.
Фактор эквивалентности K2Cr2O7 в данной реакции определить сложно, так как в реакцию осаждения вступает дихромат, а осаждается хромат. Поэтому составим пропорцию:
| 1 моль K2Cr2O7 – х моль K2Cr2O7 – | 2 моль BaCl2.
 моль BaCl2. моль BaCl2.
|
Решая ее, получаем х =  . Следовательно, в данной реакции f экв(K2Cr2O7) =
. Следовательно, в данной реакции f экв(K2Cr2O7) =  .
.
Способы титрования
Существует 3 способа титрования: прямое титрование, обратное титрование и титрование заместителя.
При прямом титровании определяемое вещество (Х) титруется раствором реагента (R) с точно известной концентрацией:
Х + R = Р.
Согласно закону эквивалентов,
 .
.
При обратном титровании (титровании по остатку) к определяемому веществу (Х) добавляют заведомо избыточный, но точно отмеренный объем первого рабочего раствора (R 1) и дают реакции пройти до конца. Затем титруют не вступивший в реакцию с Х остаток рабочего раствора R 1 вторым рабочим раствором (R 2):
Х + R 1 избыток = Р 1 (до титрования),
R 1 остаток + R 2 = Р 2 (титрование).
Согласно закону эквивалентов,
n (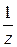 R 2) = n (
R 2) = n (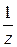 R 1 остаток),
R 1 остаток),
n (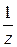 X) = n (
X) = n (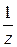 R 1 избыток) – n (
R 1 избыток) – n (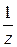 R 1 остаток) = n (
R 1 остаток) = n (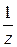 R 1 избыток) – n (
R 1 избыток) – n (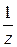 R 2).
R 2).
При титровании заместителя (титровании по замещению) к определяемому веществу (Х) добавляют неточно отмеренный избытоквспомогательного раствора (В) и дают реакции пройти до конца. Затем титруют продукт реакции Р 1 (заместитель) рабочим раствором R:
Х + В избыток = Р 1 (до титрования),
Р 1 + R = Р 2 (титрование).
Согласно закону эквивалентов,
n (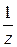 R) = n (
R) = n (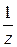 Р 1) и n (
Р 1) и n (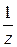 Р 1) = n (
Р 1) = n (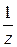 Х) Þ n (
Х) Þ n (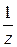 X) = n (
X) = n (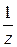 R).
R).






