Метод был впервые предложен Ф. Маргеритом в 1846 г. для определения Fe2+. Он основан на окислении восстановителей раствором KMnO4.
Основные реакции метода:
1. В кислой среде (рН < 4) перманганат-ион восстанавливается до бесцветного иона Mn2+:
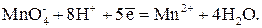 Е 0 = 1,51 В
Е 0 = 1,51 В
Поскольку 1 ион MnO4– принимает 5 электронов, то в этой полуреакции f экв(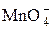 ) = 1/5. Реакция идет быстро и стехиометрично, поэтому используется наиболее часто.
) = 1/5. Реакция идет быстро и стехиометрично, поэтому используется наиболее часто.
2. В нейтральной и слабощелочной среде (рН 5–8) перманганат-ион восстанавливается до бурого осадка MnO2:
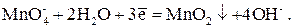 Е 0 = 0,60 В
Е 0 = 0,60 В
В этой полуреакции f экв(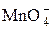 ) = 1/3. Реакцию используют редко, т. к. бурая окраска осадка MnO2 мешает фиксированию к. т. т.
) = 1/3. Реакцию используют редко, т. к. бурая окраска осадка MnO2 мешает фиксированию к. т. т.
3. В сильнощелочной среде (рН > 9) при взаимодействии с органическими соединениями перманганат-ион восстанавливается до манганата MnO42–, который имеет зеленую окраску:
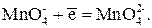 Е 0 = 0,558 В
Е 0 = 0,558 В
В этой полуреакции f экв(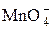 ) = 1. Реакцию используют только для анализа органических веществ.
) = 1. Реакцию используют только для анализа органических веществ.
Рабочими растворами метода являются:
§ KMnO4 – основной рабочий раствор;
§ H2C2O4 и оксалаты – для обратного титрования;
§ растворы других восстановителей (Fe2+ и т. п.) – для обратного титрования.
В качестве вспомогательных растворов метода используются:
§ H2SO4 – для создания сильнокислой среды;
§ растворы восстановителей (Sn2+ и т. п.) – для титрования заместителя.
Фиксирование к. т. т. осуществляется одним из двух способов:
§ безындикаторное титрование – для бесцветных растворов;
§ с применением окислительно-восстановительного индикатора ферроина – для окрашенных растворов.
При перманганатометрическом титровании необходимо создавать следующие условия проведения анализа:
§ чаще всего титрование ведут в сильнокислой среде, которую создают, добавляя большой избыток H2SO4;
§ нельзя использовать для подкисления растворы HCl и HNO3, т. к. в их присутствии протекают побочные реакции;
§ если необходимо провести анализ в присутствии хлоридов, то применяют защитную смесь Циммермана-Рейнгардта (смесь H2SO4, H3РO4 и MnSO4), которая предотвращает окисление хлоридов.
Достоинства метода:
§ большинство ОВР с участием KMnO4 идет стехиометрично и быстро;
§ KMnO4 – доступный реактив, им можно титровать в любой среде, без индикатора;
§ метод позволяет проводить определение многих веществ, в т. ч. тех, которые не реагируют с более слабыми окислителями.
Недостатки метода:
§ раствор KMnO4 всегда готовится как вторичный стандарт;
§ для титрования необходимо создавать строго определенные условия (рН, температура);
§ нельзя проводить анализ в присутствии хлоридов без применения защитной смеси.
Приготовление и стандартизация рабочего раствора KMnO4
Кристаллический KMnO4 всегда содержит MnO2 и другие продукты разложения, поэтому стандартный раствор нельзя приготовить по точной навеске. При приготовлении и хранении раствора надо учитывать особые химические свойства KMnO4, а именно: KMnO4 – сильный окислитель, он окисляет:
§ примеси из воды, воздуха (пыль, следы органических соединений) Þ после растворения KMnO4 в воде дают раствору постоять 7–10 дней. Для ускорения процессов окисления примесей раствор нагревают;
§ резину, корковые пробки, бумажные фильтры Þ используют только стеклянные пробки и стеклянные фильтры;
§ воду (особенно на свету) в соответствии с уравнением реакции:
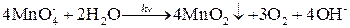 Þ
Þ
осадок MnO2 удаляют фильтрованием, раствор хранят в темной склянке.
Концентрация раствора KMnO4 со временем может меняться, поэтому ее надо проверять каждые 1–2 недели. Обычно готовят растворы KMnO4 с концентрацией 0,02–0,1 н., чаще всего 0,05 н.
В качестве установочных веществ при стандартизации раствора KMnO4 используют различные восстановители: H2C2O4 × 2H2O, оксалаты, металлическое железо, KI, соль Мора и т. д.






