| Требование к реакции, используемой для титрования | Выполнение требования для ОВР |
| Реакция должна быть селективной | ОВР сильно различаются по селективности. Они могут быть как селективными, например, реакция восстановления меди (II) иодидом:
2Cu2+ + 4I– ® 2CuI¯ + I2,
так и общими. Например, перманганат калия KMnO4 в кислой среде окисляет большинство восстановителей, для которых величина стандартного электродного потенциала
 . .
|
| Реакция должна быть стехиометричной | Многие ОВР идут нестехиометрично. Например, реакция
 протекает в соответствии с уравнением только в присутствии H2SO4. Если для создания необходимой среды использовать другие кислоты (HCl, HNO3), то будут протекать побочные реакции.
Известно, что реакция окисления тиосульфата натрия Na2S2O3 дихроматом калия K2Cr2O7 протекает нестехиометрично, поэтому прямое титрование в данном случае провести невозможно и приходится использовать другой способ титрования – титрование заместителя.
протекает в соответствии с уравнением только в присутствии H2SO4. Если для создания необходимой среды использовать другие кислоты (HCl, HNO3), то будут протекать побочные реакции.
Известно, что реакция окисления тиосульфата натрия Na2S2O3 дихроматом калия K2Cr2O7 протекает нестехиометрично, поэтому прямое титрование в данном случае провести невозможно и приходится использовать другой способ титрования – титрование заместителя.
|
| Реакция должна быть практически необратимой | При использовании ОВР для титрования выполнение этого требования можно оценить с помощью следующего критерия. Если проводить титрование с погрешностью £ 0,1%, то должно выполняться условие:
lg K ³ (n 1 + n 2) ∙ 3,
где n 1 и n 2 – число электронов, участвующих в полуреакциях; K – константа равновесия ОВР, рассчитывается по формуле:
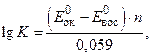 где Е 0ок и Е 0вос – стандартные электродные потенциалы двух окислительно-восстановительных пар; n – число электронов, участвующих в ОВР (равно наименьшему общему кратному числа электронов, участвующих в двух полуреакциях).
Пример. Оценить возможность использования реакции
где Е 0ок и Е 0вос – стандартные электродные потенциалы двух окислительно-восстановительных пар; n – число электронов, участвующих в ОВР (равно наименьшему общему кратному числа электронов, участвующих в двух полуреакциях).
Пример. Оценить возможность использования реакции
 для титриметрического определения железа (II) с погрешностью 0,1%.
Решение. Рассчитаем lg K данной ОВР по табличным значениям стандартных электродных потенциалов:
для титриметрического определения железа (II) с погрешностью 0,1%.
Решение. Рассчитаем lg K данной ОВР по табличным значениям стандартных электродных потенциалов:
 Рассчитаем величину
(n 1 + n 2) ∙ 3 = (5 + 1) ∙ 3 = 18.
Проверим выполнение условия lg K ³ (n 1 + n 2) ∙ 3:
62,7 > 18,
следовательно, реакцию можно использовать для титрования с погрешностью 0,1%.
Рассчитаем величину
(n 1 + n 2) ∙ 3 = (5 + 1) ∙ 3 = 18.
Проверим выполнение условия lg K ³ (n 1 + n 2) ∙ 3:
62,7 > 18,
следовательно, реакцию можно использовать для титрования с погрешностью 0,1%.
|
| Должна иметься возможность установить к. т. т. | В методах окислительно-восстановительного титрования существует 4 способа фиксирования к. т. т., тем не менее это требование не всегда удается выполнить. По этой причине некоторые ОВР, соответствующие всем остальным требованиям, нельзя использовать для проведения титрования. Например, невозможно провести прямое титрование окислителей раствором KI, поскольку с помощью специфического индикатора крахмала невозможно установить, когда завершится выделение иода I2: Ок-ль + I– ® Вос-ль + I2, а можно зафиксировать только появление I2 в титруемом растворе или его исчезновение. |
| Реакция должна идти быстро | Многие ОВР идут медленно, поэтому их нельзя использовать для титрования. Иногда для увеличения скорости нагревают раствор или вводят катализатор. |
Если ОВР соответствует всем требованиям и есть возможность зафиксировать к. т. т., то используют прямое титрование. Если реакция идёт нестехиометрично, медленно, то применяют обратное титрование и титрование заместителя.






