Перманганатометрія – метод окисно-відновного титрування, у якому як окисник використовується стандартний розчин KMnO4.
Титрування перманганатом проводять у кислому, нейтральному, лужному середовищі. Переважно титрування проводять у кислому середовищі. Схеми реакцій, які при цьому протікають, мають вигляд:
 + 5 ē + 8H+ D Mn2+ + 4H2O.
+ 5 ē + 8H+ D Mn2+ + 4H2O.
Окисно-відновний потенціал даної системи виражається рівнянням Нернста:
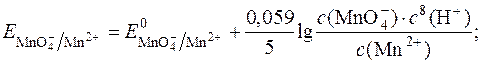
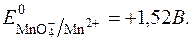
З рівняння видно, що  у значній мірі залежить від с (Н+).
у значній мірі залежить від с (Н+).
Інколи титрування розчином калій перманганату проводять у нейтральних чи лужних розчинах. Схеми реакцій, що при цьому відбуваються, мають вигляд:
 + 3 ē + 2НОН D MnО2$ + 4ОH–;
+ 3 ē + 2НОН D MnО2$ + 4ОH–;


Таким чином,  у значній мірі залежить від с (ОН–) або с(Н+).
у значній мірі залежить від с (ОН–) або с(Н+).
Процес титрування перманганатом різних неорганічних і органічних речовин дуже складний. Це пояснюється тим, що Манган у розчинах може бути в різних ступенях окиснення: 2+; 3+; 4+; 6+; 7+.
Низькозарядні йони Мангану, що утворюються у процесі відновлення MnO4–, самі здатні окиснюватись перманганатом у більш високі ступені окиснення. Щоб запобігти утворенню проміжних форм окиснення Мангану, титрування розчином перманганату слід проводити повільно, при певних значеннях p H і температури.
Перманганатом швидко окиснюються щавлева кислота, H2O2, HI, H2SO3, H2S, HNO2, Na2S2O3, роданіди, а також йони металів у нижчих ступенях окиснення (Fe2+, Mn2+, Cr2+ та ін.).
У перманганатометрії для визначення речовин, що повільно окиснюються, використовують титрування у кислому середовищі методом зворотного титрування. До розчину досліджуваної речовини додають точно відому кількість перманганату, взятого у надлишку, а потім надлишок, що не пішов на окиснення досліджуваної речовини, відтитровують стандартним розчином відновника (наприклад щавлевої кислоти).
При титруванні у лужному середовищі неорганічних і органічних речовин на першій стадії реакції окиснення-відновлення спочатку утворюється манганат:
 + ē D
+ ē D  .
.
Редокс-потенціал такої системи має вираження:


З рівняння реакції видно, що редокс-потенціал не залежить від p H.
На другій стадії окиснення-відновлення манганат відновлюється до MnO2:
 + 2 ē + 2HOH D MnO2$ + 4OH–.
+ 2 ē + 2HOH D MnO2$ + 4OH–.
Редокс-потенціал такої системи визначається:


З рівняння видно, що редокс-потенціал  залежить від p OH чи p H. Оскльки концентрація твердого осаду MnO2 постійна, то:
залежить від p OH чи p H. Оскльки концентрація твердого осаду MnO2 постійна, то:

Відносно легко окиснюються перманганатом у лужному середовищі форміати, йодиди, йодати, ціаніди, роданіди, багато органічних сполук. У лужному середовищі перманганат не окиснює оксалати.
Молярна маса еквівалента перманганату при титруванні у кислому середовищі дорівнює: M ( )=
)= 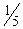 M, а в нейтральному і лужному М (
M, а в нейтральному і лужному М ( )=
)=  M.
M.






