Якщо титрувати хелатоутворюючим реагентом розчин, в якому знаходяться у рівновазі два йона якогось металу з різними ступенями окиснення, то в точці еквівалентності відбувається різка зміна редокс-потенціалу розчину, що обумовлено різною стійкістю комплексів йонів металу у різних ступенях окиснення. Стрибок редокс-потенціалу в точці еквівалентності може бути виявлений не тільки потенціометрично, але і за допомогою кольорового індикатора.
Прикладом цього може бути система Fe3+/Fe2+, де співвідношення констант стійкості комплексів Fe3+- та Fe2+-іонів з ЕДТА становить близько 1011. Йони Fe3+ можна титрувати навіть у сильнокислому розчині, у якому Fe2+-іони практично не утворюють комплексу. Тому редокс-потенціал розчину  при такому титруванні залежить від концентрації Fe3+-іонів, оскільки концентрація Fe2+-іонів залишається практично сталою. Отже, зміна Е пов’язана із зміною концентрації Fe3+-іонів, і стрибок редокс-потенціалу, що відповідає стрибку рFe, відбувається тоді, коли до розчину додано таку кількість ЕДТА, що еквівалентно вмісту у розчині Fe3+-іонів. Концентрація Fe2+-іонів при цьому не має суттєвого значення, так як вона впливає лише на абсолютне значення Е, а не на його зміну у процесі титрування.
при такому титруванні залежить від концентрації Fe3+-іонів, оскільки концентрація Fe2+-іонів залишається практично сталою. Отже, зміна Е пов’язана із зміною концентрації Fe3+-іонів, і стрибок редокс-потенціалу, що відповідає стрибку рFe, відбувається тоді, коли до розчину додано таку кількість ЕДТА, що еквівалентно вмісту у розчині Fe3+-іонів. Концентрація Fe2+-іонів при цьому не має суттєвого значення, так як вона впливає лише на абсолютне значення Е, а не на його зміну у процесі титрування.
Іншим прикладом може бути система Cu2+/Cu+. Лише Cu2+-іони утворюють стабільний комплекс з ЕДТА, тоді як Cu+-іони практично не беруть участі в комплексоутворенні. Тому редокс-потенціал системи Cu2+/Cu+ 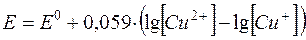 залежить від концентрації Cu2+-іонів.
залежить від концентрації Cu2+-іонів.
Однак, визначити кінцеву точку комплексонометричного титрування йонів таких металів за стрибком редокс-потенціалу не завжди буває можливо.
Із багаточисленних органічних барвників, які здатні оборотно відновлюватися і окиснюватися із зміною забарвлення лише небагато можна застосовувати як редокс-індикатори при комплексонометричних титруваннях.
До таких сполук відносяться похідні дифеніламіну, які в окисненій формі являють собою інтенсивно забарвлені індофенол (варіаміновий синій) та індамін (Біндшедлера зелений).

| Варіаміновий синій |

| Біндшедлера зелений |
Безбарвна лейкооснова варіамінового синього в слабкокислому розчині окиснюється вільними Fe3+-іонами в темнофіолетовий барвник:
 .
.
Нормальний потенціал редокс-системи барвник-лейкоформа при рН=2 становить 0,60В, тому індофенол знову відновлюється утвореними Fe2+-іонами як тільки всі Fe3+-іони зв’язуються в комплекс з ЕДТА; отже, в кінцевій точці комплексонометричного титрування фіолетовий розчин знебарвлюється. Такий метод титрування Fe3+-іонів особливо корисний для мікро- та ультрамікровизначень.
Варіаміновий синій можна використовувати і для визначення Cu2+-іонів в розчинах з рН = 5,0–6,0. У такому середовищі Cu2+-іони також окиснюють лейкооснову в індофенол, якщо до розчину додано невелику кількість SCN––іонів чи значну кількість Cl––іонів. Після того, як всі Cu2+-іони зв’язуються в комплекс, реакція йде в зворотному напрямку і відбувається знебарвлення розчину.
Стрибкоподібна зміна концентрації Zn2+-іонів у розчині, що містить редокс-систему [Fe(CN)6]3-/Fe(CN)6]4-, супроводжується стрибком редокс-потенціалу, обумовленого тим, що Zn2+-іони міцно зв’язують гексаціано(ІІ)ферат-іони з утворенням комплексу чи осаду. Тому у присутності у розчині Zn2+-іонів потенціал розчину стає дуже високим і в такому розчині можливе окиснення бензидину, внаслідок чого утворюються продукти, забарвлені у синій колір.

|
| Бензидин |
На основі цього явища засновано визначення значного числа йонів металів методом зворотного титрування: до досліджуваного розчину додають надлишок розчину ЕДТА, потім додають гексаціаноферати (ІІІ) і (ІІ) та бензидин і при значеннях рН ≈ 5,0 титрують надлишок ЕДТА розчином солі Цинку до появи синього чи фіолетового забарвлення.
Металохромні індикатори за своєю дією аналогічні кислотно-основним індикаторам. Якщо кислотно-основні індикатори реагують на рН, то металохромні на рМе:
 ;
;
 .
.
Вільна форма металоіндикатора і комплекс його з йонами металів означають концентрації не зв’язаного з йоном металу барвника і металокомплексу, які відрізняються забарвленням. Ця аналогія можлива лише тоді, коли молярні співвідношення між йоном металу і металоіндикатором становлять 1:1. Але часто комплекс йона металу з барвником складу 1:1 може приєднувати ще другу або навіть третю молекулу барвника, чого не буває у протонвмісних сполук. Константи утворення комплексів з молярним співвідношенням Ме:Іnd=1:1 майже завжди у багато разів більші констант утворення комплексів Ме:Іnd=1:2 чи Ме:Іnd=1:3, тому при низьких концентраціях барвника (~ 10-5 моль/дм3) та йонів металу, що не увійшли до комплексу і присутні у розчині в точці еквівалентності комплексонометричного титрування (< 10-5 моль/дм3), враховують лише продукти приєднання складу 1:1. Крім того існують і біметалічні комплекси з барвником Ме2Іnd.
Зміна забарвлення майже завжди є наслідком перетворення комплексу складу 1:1 у не зв’язаний з йоном металу барвник і навпаки. Імовірний також випадок, коли біметалічний комплекс Ме2Іnd безпосередньо перетворюється у не зв’язаний з йоном металу індикатор, минаючи стадію МеІnd.
Металохромні індикатори є одночасно і рН-індикаторами. Як вже зазначалося, наприклад, індикатор еріохром чорний Т в кислому розчині за відсутності багатозарядних йонів металів має червоне забарвлення; при рН=6,3 це забарвлення переходить в синє, а при рН=11,5 – в оранжеве. Аналогічне спостерігається практично у всіх металохромних індикаторів. Але буває, що не тільки металоіндикатор, не зв’язаний у металокомплекс, а також і його металокомплекс складу 1:1 являє собою рН-індикатор, і в залежності від кислотності середовища може існувати у різних протонованих формах, що мають різне забарвлення.






