Титрантом методу є розчин йодмонохлориду ICl, який є окисником. Йод зі ступенем окиснення 1+, окиснюючи різноманітні відновники, сам може відновлюватись до І2 або І–:
ICl + 2 ē = I– + Cl–; E º = +0,795 B;
2ICl + 2 ē = I2 + 2Cl–; E º = +1,19 B.
Редокс-потенціал системи залежить від концентрації хлоридної кислоти, яка є обов’язковим компонентом системи.
Йодхлориметричне титрування схоже на йодометрію, але має переваги:
§ розчини йодмонохлориду більш стійкі, ніж розчини йоду;
§ редокс-потенціал 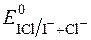 >
>  (0,795 і 0,545 В відповідно).
(0,795 і 0,545 В відповідно).
Цим методом можна визначати ціаніди, гексаціаноферати (ІІ), тіосечовину, сульфамідні препарати, барбітурати, похідні ароматичних амінів, фенолів та ін.
Титрант готується як вторинний стандартний розчин. Його отримують окисненням йодид-іонів йодат-іонами у середовищі концентрованої хлоридної кислоти:
2I– +  + 6H+ + 3Cl– " 3ICl + 3H2O.
+ 6H+ + 3Cl– " 3ICl + 3H2O.
Розчин йодмонохлориду стійкий у середовищі хлоридної кислоти (не менше 100 см 3 концентрованої НСl в 1000 см 3 приготованого розчину). Робочий розчин йодмонохлориду можна стандартизувати за стандартними речовинами: As2O3; K4[Fe(CN)6]; KI; Na2S2O3 та ін.
У йодхлориметрії застосовують пряме, зворотне титрування і титрування замісника.
Прямим титруванням визначають сильні відновники: Sn2+, SCN–,  , аскорбінову кислоту та ін.
, аскорбінову кислоту та ін.
Зворотне титрування застосовують для визначення Fe2+, Hg2Cl2 та ін. До розчину, що титрують, додають надлишок ICl. Йодмонохлорид, що залишився після окиснення даного відновника, визначають йодометрично:
ICl +I– " I2 + Cl–;
I2 + 2 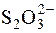 " 2I– +
" 2I– + 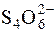 .
.
Кінцеву точку титрування визначають з індикатором – розчином крохмалю і фізико-хімічними методами: потенціометричним, амперометричним та ін.






