Церіметрією називають метод титриметричного аналізу, у якому як окисник використовують сполуки Церію зі ступенем окиснення Се4+.
Для приготування стандартних розчинів у церіметрії використовують переважно комплексні амонієві солі Церію (ІV): гексанітратоцерат (ІV) – (NH4)2[Ce(NO3)6]; трисульфатоцерат (ІV) – (NH4)2[Ce(SO4)3]; гексахлорцерат (ІV) – (NH4)2[CeCl6]; гексаперхлоратоцерат – (NH4)2[Ce(ClO4)6].
Редокс-потенціали системи Ce4+/Ce3+ залежать від характеру лігандів при Се4+:
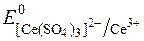 = +1,45 В;
= +1,45 В;
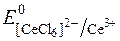 = +1,40 В;
= +1,40 В;
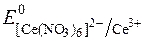 = +1,60 В;
= +1,60 В;
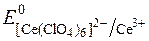 = +1,70 В.
= +1,70 В.
Високі редокс-потенціали системи Се4+/Се3+ дозволяють проводити майже всі визначення, які можливі у перманганатометрії, а також багато сполук, які не можна визначити іншими редокс-методами.
Церіметрія має ряд переваг перед іншими редокс-методами:
§ сполуки, що застосовуються для приготування стандартних розчинів, стійкі, не гігроскопічні, не взаємодіють з СО2 і О2 повітря, не вивітрюються, мають високі відносні молекулярні маси;
§ стандартні розчини довгий час зберігають постійність титру;
§ титрування розчинами солей Церію (ІV) можна проводити у присутності йонів Сl– (НСl), що неможливо у перманганатометрії;
§ при титруванні розчинами солей Церію (ІV), як правило, не утворюються проміжні і побічні продукти.
Недоліками методу є те, що за наявності у досліджуваному розчинні йонів F– утворюються стійкі комплексні йони [CeF6]2–, а при титруванні у присутності йонів PO43– при недостатній кислотності розчину утворюється нерозчинний церій (ІV) фосфат, внаслідок чого результати аналізу будуть невірними. Титрування у церіметрії часто необхідно проводити при нагріванні до 50-75ºС, що обмежує визначення летких органічних сполук.
Для стандартизації робочих розчинів у церіметрії використовують первинний стандарт – розчин щавлевої кислоти:
Се4+ + 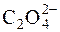 " 2СО2 + Се3+.
" 2СО2 + Се3+.
У церіметрії можливе пряме, зворотне титрування і титрування замісника.
Кінцеву точку титрування у церіметрії визначають безіндикаторним методом, який полягає у візуальному спостереженні забарвлення досліджуваного розчину від зайвої краплі титранту, який має жовте забарвлення (Се4+), тоді як сполуки Се3+ – безбарвні. Але цей метод не можна застосувати при дослідженні забарвлених, мутних розчинів, а також тоді, коли в результаті реакції з’являються забарвленні продукти реакції.
Індикаторні методи визначення кінцевої точки титрування ґрунтуються на застосуванні редокс-індикаторів – фероїну, 2,2′-дипіридилу, дифеніламіносульфокислоти та ін., а також необоротних кислотно-основних індикаторів – метилового оранжевого, метилового червоного та ін.
Для визначення кінцевої точки титрування у цьому методі застосовують фізико-хімічні засоби: потенціометрію, фотометрію, амперометрію та ін.






