Комплексометричним називається титрування розчинів, що містять йони металів, розчинами реагентів, які виступають у ролі лігандів. Внаслідок взаємодії досліджуваного йона з лігандами титранту утворюються комплексні йони, властивості яких суттєво відрізняються від властивостей вихідних речовин.
Але у більшості випадків при утворенні простих комплексів реакції відбуваються не завжди стехіометрично, часто реакції відбуваються повільно, комплекси, що швидко утворюються, зазвичай, являють собою нестабільні продукти приєднання. Як виняток можуть бути комплекси Нg2+, Ag+, Ni2+ з CN– - іонами, які відзначаються високою стабільністю.
Заміна молекул води з гідратних оболонок йонів металів, що знаходяться у водному розчині, на інші ліганди, наприклад, NH3 чи CN–, відбувається, як правило, ступінчасто. При поступовому додаванні розчину ліганду до розчину, що містить йони металу, утворюється ряд різних комплексів. Комплексоутворення закінчується повністю лише після додавання комплексоутворюючого реагенту у значному надлишку. Внаслідок цього кінцева точка титрування не може бути визначена ні за різким зменшенням концентрації йона металу, який досліджується, ні за швидким збільшенням концентрації вільного ліганду.
Кращі результати можна отримати, якщо, наприклад, замість кількох окремих молекул амоніаку застосувати у якості ліганду органічний поліамін, атоми Нітрогену якого розташовані в молекулі таким чином, що при комплексоутворенні можуть виникнути п’ятичленні чи шестичленні цикли.
Як приклад можна навести β, β′, β′′ - триамінотриетиламін:
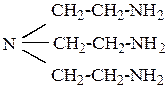
| рК1 = 10,29; рК2 = 9,69; рК3 = 8,56. |
та N, N, N′, N′ -тетра-(β-аміноетил)-етилендиамін:
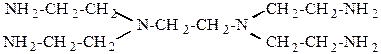
| рК1 = 10,2; рК2 = 9,7; рК3 = 9,14; рК4 = 8,56. |
При застосуванні таких лігандів виключається ступінчастість процесу комплексоутворення, так як для утворення комплексу потрібно замість чотирьох чи шести молекул амоніаку лише одна молекула поліаміну. При цьому також підвищується стійкість хелатного комплексу у порівнянні з відповідним комплексом з простими лігандами.
Органічні поліаміни можна успішно застосовувати в комплексонометрії в якості титрантів. Але їх застосування обмежується титруванням лише тих йонів металів, які легко приєднують атоми амінного Нітрогену у якості лігандів, зокрема Cu2+, Ni2+, Co2+, Zn2+, Cd2+, Hg2+. Крім того, поліамінні комплекси чутливі до кислот, здатні приєднувати декілька протонів за амінними групами, а при комплексоутворенні йон металу витісняє ці протони.






