Комплексонометрія – методи аналізу, які базуються на реакціях, що супроводжуються утворенням комплексних сполук катіонів з органічними реактивами – комплексонами. Сполуки, що утворюються, називають внутрішньокомплексними (клешньовидними, хелатними).
У сучасній комплексонометрії застосовують комплекси, які є найчастіше похідними амінополікарбонових кислот. Серед комплексонів найбільше значення має етилендиамінтетраоцтова кислота (ЕДТА):

Їх аніони можуть утворювати п’ятичленні хелатні цикли з йонами металів.
Крім ЕДТА, як комплексони застосовують:
нітрилотриоцтову кислоту (НТА)
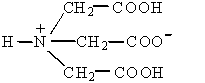
транс-1,2,-диаміноциклогексантетраоцтову кислоту (ДЦТА)

диетилентриамінпентаоцтову кислоту (ДТПА)

та інші.
Карбоксильні групи теж здатні бути лігандами для йонів металів. Аніони амінополікарбонових кислот є сильними комплексоутворювачами, які мають меншу, у порівнянні з поліамінами, вибірковість до йонів і реагують майже з будь-якими йонами металу. У той час, як амоніак і поліаміни утворюють продукти приєднання лише з катіонами елементів 1 б; 2 б;3 б і т.д. груп Періодичної системи, амінополікарбонові кислоти утворюють комплекси також з катіонами металів 1 а; 2 а; 3 а і т. д груп, наприклад з Al3+, Ba2+, Ca2+, Sr2+ і навіть, хоча і в меншій мірі, з Li+ та Na+.
У 95% випадків комплексонометричних титрувань застосовують ЕДТА (комплексон ІІ), а ще краще – динатрієву сіль ЕДТА (комплексон ІІІ), яка має технічну назву «трилон Б».

Рис. 2. Структура ЕДТА-Ме – комплексу
Комплексон ДЦТА утворює з йонами металів більш стійкі комплекси, ніж трилон Б. Комплексон ДТПА утворює комплекси з йонами металів з координаційним числом 8, причому ці комплекси більш стійкі, ніж комплекси ЕДТА, тому ДТПА має переваги при титруванні великих катіонів.
 |
Сх/Сме š
Сх/Сме š
Крива комплексонометричного титрування розчину, що містить йони металу (с = 0,1 моль/дм3) (Кс = 1016)
СХ – концентрація комплексону в розчині, що титрується, моль/дм3
СМе – концентрація йона металу в розчині, що титрується, моль/дм3
КС – константа стійкості хелатного комплексу






