Металохромні індикатори являють собою органічні барвники, які здатні змінювати своє забарвлення при утворенні комплексів з йонами металів. У порівнянні з металоіндикаторами, які були описані вище, вони мають перевагу в тому, що інтенсивність забарвлення їх комплексів з йонами металів в 10-100 разів більша. Тому чітку зміну забарвлення можна спостерігати при концентрації металохромного індикатора порядку 10–6–10–5 моль/дм3. Вільний індикатор майже завжди забарвлений, і кінець титрування визначається не за зникненням чи появою, а за зміною забарвлення індикатора.
Металохромні індикатори, так само як і титранти-комплексони, повинні бути здатними утворювати внутрішньокомплексні сполуки з йонами, які визначаються, оскільки тільки такі комплекси мають задовільну стабільність. Отже, молекула металохромного індикатора повинна мати принаймні два атома (О або N), які як ліганди можуть координуватися з йонами металу і брати участь в утворенні п’яти- чи шестичленних хелатних циклів. Якщо хоча б один атом-ліганд, зв’язаний з йоном металу, в той же час входить до складу хромофорної чи ауксохромної групи молекули індикатора-барвника, то при комплексоутворенні відбувається зміна забарвлення.
Як індикатори в комплексонометрії застосовуються трифенілметанові барвники. Типовим представником цього класу барвників є бензаурин:

Цей барвник є рН-індикатором, так як у кислому середовищі до атома Оксигену приєднується протон і забарвлення індикатора змінюється від червоного до жовтого. Якщо в положенні 2′′ міститься сульфогрупа, то такі барвники називаються сульфофталеїнами, у фталеїнів положення 2′′ зайнято карбоксильною групою.
Фталеїнові та сульфофталеїнові індикатори практично не утворюють комплекси з йонами металів. Але якщо в молекулу такого індикатора по сусідству з фенольною оксигрупою в положення 3, 3′ чи 5, 5′ ввести замісник, який так, як і атом Оксигену, здатен координуватися з йоном металу з утворенням п’яти- чи шестичленного хелатного циклу, то утворена сполука є металоіндикатором. Так як електрони ауксохромних атомів Оксигену належать до тієї електронної системи, яка обумовлює поглинання світла, то координування йона металу з цими атомами має вплив на забарвлення сполуки. У більшості металоіндикаторів такого типу замісники, здатні утворювати комплекс з йонами металу, є в обох кільцях (А та В), хоча в принципі достатньо, щоб молекула металоіндикатора мала єдину здатну до хелатоутворення структурну групу.
Серед замісників, які, знаходячись в положеннях 3,3′ та 5,5′, здатні надавати трифенілметановому барвнику властивості хелатоутворювача та металоіндикатора, перш за все є окси-, карбокси- та метиленімінодиацетатні групи. Як приклади таких комплексонометричних індикаторів можна назвати:
 пірокатехіновий фіолетовий
пірокатехіновий фіолетовий
|  еріохромціанін
еріохромціанін
|
 ксиленоловий оранжевий
ксиленоловий оранжевий
|
Надзвичайно важливими в комплексонометрії є металохромні індикатори, що являють собою азобарвники.
В азобарвниках ароматичні ядра зв’язані між собою через азогрупи –N=N–. В орто- чи параположенні до хромофорної азогрупи розташовані ауксохромні замісники, найчастіше окси- чи аміногрупи як первинні, так і вторинні та третинні. Всі азобарвники є кислотно-основними індикаторами. При пониженні рН відбувається приєднання Н+-іонів до ауксохромних окси- чи аміногруп або до атома Нітрогену азогрупи:
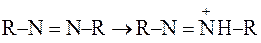 ,
,
а при підвищенні рН відбувається зворотний процес.
Але якщо в молекулу азобарвника ввести групи атомів, які можуть відігравати роль лігандів, то азобарвник набуває здатність утворювати комплекси з йонами металів. Причому ці групи атомів потрібно ввести так, щоб при комплексоутворенні могли утворюватись п’яти- чи шестичленні хелатні цикли. Якщо до числа лігандів входять ауксохромні групи, комплексоутворення впливає на забарвлення сполуки, яка утворюється. При цьому, якщо йон металу зв’язаний також і з азогрупою, перехід забарвлення буде дуже чітким. Зв'язок азогрупи з йоном металу забезпечується введенням замісників, що виконують роль лігандів, в орто-положення до азогрупи. У багатьох металохромних азоіндикаторів орто-положення зайняті оксигрупами (о,о ′- диоксиазобарвники), причому ці групи є одночасно і ауксохромами, і лігандами. Інколи як ліганди в орто-положенні виступають карбоксильні групи.
Металохромним індикатором, який найбільш часто застосовується в комплексонометричному титруванні, є еріохром чорний Т:

рН<6 – червоне забарвлення
Від’ємний заряд сульфогрупи забезпечує здатність розчинятися у воді. При підвищенні рН розчину відщеплюються гідроген-іони від оксигруп і при рН-6,3 червона форма переходить в синю, яка при рН=11,5 переходить в жовто-оранжеву повністю депротоновану форму. Металокомплекси забарвлені в червоний чи фіолетовий колір, і перехід забарвлення при їх утворенні надзвичайно різкий, якщо реакція відбувається в інтервалі рН=7–11. Для аналітичної практики мають значення лише комплекси з молярним співвідношенням 1:1,

Металокомплекс еріохрому чорного Т
так як при тих малих концентраціях індикатора і йонів металу, які відповідають кінцевим точкам комплексонометричних титрувань, комплекси з молярним співвідношенням 1:2 (на один моль йонів металу 2 моля індикатора) є в дуже незначній кількості і їх можна не враховувати.
Дотепер відомо близько 100 різних металохромних індикаторів, що є азобарвниками. Більшість з них є моноазобарвниками – похідними бензену чи нафталіну, причому у похідних нафталіну азогрупи можуть бути як в α-, так і в β-положенні. Близько чверті індикаторів є о,о ′-диоксиазобарвниками, які утворюють зв’язки з металом аналогічно еріохрому чорному Т, інші індикатори є о -окси- о ′-карбоксиазобарвниками, в яких йон металу координується з атомом Оксигену карбоксильної групи, атомом Нітрогену та атомом Оксигену оксигрупи. Ряд індикаторів є похідними піридину, в яких азогрупа розташована поряд з атомом Нітрогену піридину, і, крім того, в орто-положенні до оксигрупи, зв’язаної з ароматичним ядром.
Особливо стійкі комплекси піридинових азоіндикаторів з Со2+, Nі2+, Сu2+, Zn2+, Сd2+.
Особливим видом азобарвників є формазани. Серед дифенілформазанів важливе значення мають дітізон і цинкон. Дітізон
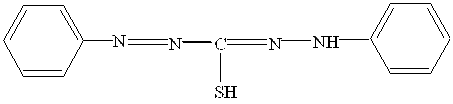
застосовується для визначення Na+, Al3+, Ni2+, Zn2+, Cd2+, Pb2+, Bi3+. Особливістю таких індикаторів є те, що при утворенні комплексів з йонами металів відбувається відщеплення Н+-іонів не тільки від замісників кислотного характеру, а також і від гідразогрупи.
Дітізон має зелене забарвлення, а його комплекси з йонами металів забарвлені у жовтий, червоний чи фіолетовий колір. Йон металу у комплексах координується з атомом Сульфуру і атомом Нітрогену азо- чи гідразогрупи. Внаслідок поганої розчинності у воді цього індикатора і його комплексів з йонами металів, титрування проводять у водно-ацетоновому чи водно-спиртовому середовищі.
Інший представник дифенілформазанів – цинкон

застосовується для визначення Zn2+, Ca2+. Цинкон у сильнокислому середовищі має червоно-фіолетове забарвлення, при рН=4,5 забарвлення переходить у жовте, а при рН=8,3 – у червоно-оранжеве. Комплекс індикатора з Zn2+ забарвлений у синій колір; в цьому комплексі йон металу координується з обома атомами Нітрогену, безпосередньо сполученими з бензеновими ядрами, та з атомом Оксигену одного із замісників, що знаходиться в орто-положенні до азо- чи гідразогрупи. Титрування йонів Zn2+ у присутності цинкону проводять при рН близько 10 бо в таких умовах перехід забарвлення є найбільш чітким. Цинкон використовують також і для визначення Ca2+-іонів у присутності Mg2+-йонів титруванням розчином β,β′-диамінодиетилгліколевого етеру N,N,N′,N′-тетраоцтової кислоти (ГЕДТА).
Здатність утворювати сполуки з йонами металів мають оксихінони. Утворювати комплекси з йонами металів здатні прості оксибензохінони, але особливо оксинафтохінони та оксиантрахінони. Серед металоіндикаторів, що відносяться до класу оксихінонів, важливими є родизонова кислота, хлоранілова кислота, нафтоловий пурпуровий, алізарин S, кармінова кислота. Особливо часто застосовують металоіндикатор алізарин, у який введена сульфогрупа для підвищення розчинності барвника.
 Родизонова
кислота
Родизонова
кислота
|  Хлоранілова
кислота
Хлоранілова
кислота
|
 Нафтоловий пурпуровий
Нафтоловий пурпуровий
|  Алізарин S
Алізарин S
|
В усіх комплексах оксихінонів з йонами металів йон металу координується з атомом Оксигену карбонільної групи і атомом Оксигену сусідньої депротонованої оксигрупи. Таким чином, в оксихінонах атомами-донорами електронів є тільки атоми Оксигену і тому оксихінони мають велику спорідненість до багатозарядних катіонів з незаповненими d-орбіталями.
Утворювати комплекси з йонами металів може відомий природний барвник мурексид, що являє собою амонійну сіль пурпурової кислоти. Червоно-фіолетовий аніон мурексиду має будову:
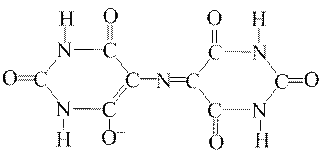 .
.
У такому стані від’ємний заряд аніона рівномірно розподіляється між чотирма атомами Оксигену в центральній частині молекули. Вільна забарвлена у жовтий колір пурпурова кислота утворюється тільки при додаванні сильних мінеральних кислот. Вона дуже нестійка і при рН<3 її фіолетове забарвлення швидко зникає.
При підвищенні рН розчину від аніона мурексиду відщеплюється ще два Н+-іона від аміногрупи. Це супроводжується зміною червоно-фіолетового забарвлення на синьо-фіолетове.
Здатність мурексиду утворювати металокомплекси обумовлена будовою його молекули, яка дає можливість утворювати два п’ятичленних хелатних цикли при його взаємодії з йоном металу внаслідок одночасного координування йона металу з центральним атомом Нітрогену і двома атомами Оксигену:

Мурексид, зазвичай, застосовують як металоіндикатор при титруванні йонів Са2+.






