Меркурометричний метод аналізу заснований на реакціях осадження галогенід–іонів йонами  . Утворювані меркурій(І) галогеніди є практично нерозчинні:
. Утворювані меркурій(І) галогеніди є практично нерозчинні:
ДР (Hg2Cl2)=1,3·10–18; ДР (Hg2I2)=4,5·10–29; ДР (Hg2Br2)=5,8·10–23.
Титрантом у цьому методі є розчин Hg2(NO3)2 в розведеній нітратній кислоті. Цей стандартний розчин є вторинним стандартом, оскільки приготувати титрований робочий розчин Hg2(NO3)2 з наважки неможливо, так як меркурій(І) нітрат є нестійкий і містить домішки Hg2+-іонів. У зв’язку з цим, перед стандартизацією титрант витримують над металевою ртуттю не менш доби, що сприяє відновленню йонів Hg2+:
Hg2+ + Hg "  .
.
У меркурометрії використовують індикатори – ферум (ІІІ) тіоціанат, дифенілкарбазон.
Застосування індикатора Fe(SCN)3 засноване на тому, що після осадження галогенід-іонів у розчині з’являється надлишок йонів  , які реагують з роданід-іонами, внаслідок чого червоне забарвлення розчину зникає.
, які реагують з роданід-іонами, внаслідок чого червоне забарвлення розчину зникає.
3  +2 Fe(SCN)3 " 3Hg2(SCN)2 + 2Fe3+.
+2 Fe(SCN)3 " 3Hg2(SCN)2 + 2Fe3+.
Дія індикатора дифенілкарбазону заснована на тому, що після повного осадження галогенід–іонів надлишкова крапля титранту утворює з дифенілкарбазоном або осад синього кольору в нейтральному чи слабкокислому середовищі, або розчин синього кольору в середовищі нітратної кислоти з с (HNO3)=6,0 моль/дм 3:

Дифенілкарбазон має переваги над ферум(ІІІ) роданідом, бо створюється можливість титрування в сильнокислому середовищі, а також у забарвлених чи каламутних розчинах. З іншого боку, з дифенілкарбазоном можливе зворотне титрування.
Оскільки меркурій(І) галогеніди менш розчинні, ніж аргентум галогеніди, тому при титруванні розчинів галогенідів розчином меркурій (І) нітрату спостерігається різкий стрибок титрування поблизу точки еквівалентності, що значно підвищує точність визначення.
Меркурометричному визначенню хлорид–іонів не заважають деякі окисники чи відновники ( ;
; 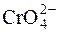 ; H2O2;
; H2O2;  ;
;  ;
;  ).
).






