| Материал порошка | Способы производства |
| Железо | Восстановление оксидов, распыление расплава водой или газом, электролиз, диссоциация карбонилов |
| Легированные стали | Распыление расплава водой, газом, центробежными силами; механическое измельчение |
| Медь | Электролиз, распыление расплава водой или газом, восстановление оксидов |
| Медные сплавы | Распыление расплава водой или газом |
| Алюминий | Распыление расплава газом, механическое измельчение |
| Никель | Диссоциация карбонилов, электролиз, распыление расплава водой |
| Никелевые сплавы | Распыление расплава газом, водой, центробежными силами, механическое легирование |
| Кобальт | Восстановление оксидов, химическое осаждение |
| Бериллий | Распыление расплава газом, механическое измельчение |
| Композиты (Al-Si и др.) | Механическое легирование, плазменное распыление |
| Интерметаллиды (Ni-Al и др.) | Распыление расплава газом или центробежными силами, реакционный синтез |
| Золото, серебро | Электролиз, распыление расплава газом, химическое осаждение |
| Титан, и др. реакционные металлы | Восстановление хлоридов, центробежное распыление расплава, гидрирование-дегидрирование |
| Тугоплавкие металлы (W и др.) | Восстановление оксидов, центробежное или плазменное распыление, химическое осаждение |
| Уран | Восстановление оксидов, гидрирование-дегидрирование |
| Нанопорошки металлов и их оксидов | Процессы осаждения из растворов, в том числе золь-гель процесс, испарение и конденсация, механическое измельчение |
На рис. 1.2 представлена диаграмма относительной стоимости металлических порошков, причем стоимость порошка железа принята за единицу.
 Рис. 1.2. Относительная стоимость металлических порошков
Рис. 1.2. Относительная стоимость металлических порошков
Контрольные вопросы
1. Перечислите основные способы производства металлических порошков.
2. В чем принципиальное различие между механическими и физико-химическими способами получения порошков?
3. Каков мировой объем годового производства металлических порошков?
1.3. МЕХАНИЧЕСКОЕ ИЗМЕЛЬЧЕНИЕ ТВЕРДЫХ
МАТЕРИАЛОВ
Работа измельчения
Механическое измельчение представляет собой разрушение материала путем раздавливания, резания, истирания, удара, или при комбинации этих действий. Наиболее целесообразно применять механическое измельчение при производстве порошков из хрупких металлов и сплавов, таких как кремний, хром, марганец, бериллий, ферросплавы, чугуны, сплавы алюминия с магнием и др. В принципе, механическим способом можно измельчить и пластичные материалы, склонные к наклепу (цинк, алюминий, медь, железо и др.), но размол пластичных и вязких металлов затруднен, поскольку они деформируются без разрушения.
По теории, предложенной П. А. Ребиндером, работа, затрачиваемая на измельчение, может быть выражена следующим образом:
ΔА = γΔS + кΔV, (1.1)
Слагаемое γΔS представляет собой энергию, расходуемую на образование новых поверхностей раздела; γ – удельная поверхностная энергия; ΔS – приращение поверхности, происходящее при измельчении. Слагаемое кΔV это объемная энергия деформации: к – работа упругой и пластической деформации на единицу объема, разрушаемого тела; ΔV – часть объема твердого тела, подвергнутого деформации. При грубом дроблении приращение новой поверхности мало, поскольку при дроблении образуются крупные частицы. Соответственно, γΔS << кΔV. Это означает, что затрачиваемая энергия примерно пропорциональна объему разрушаемого тела. При тонком измельчении вновь образующаяся поверхность велика, в этом случае γΔS >> кΔV, поэтому расход энергии пропорционален вновь образующейся поверхности. Полезная энергия измельчения очень мала, поскольку основная часть энергии тратится на деформацию и нагрев разрушаемого тела.
Измельчение в дробилках
Первичное измельчение кускового твердого материала обычно производят в щековых, валковых и конусных дробилках. В щековых дробилках, измельчают спеки порошков, осадки с электродов, ферросплавы и другие твердые материалы с пределом прочности на сжатие до 300 МПа. Дробление материала происходит за счет раздавливания кусков между неподвижной и подвижной щеками дробилки. При сближении щек происходит дробление материала, а при расхождении щек дробленый материал высыпается через разгрузочную щель. Дробящие щеки работают в наиболее тяжелых условиях, поэтому их делают из износостойких материалов, например из деформационно-упрочняемой стали Г13, или упрочняют износостойкими наплавками. Минимальный размер частиц на выходе дробилки 1 – 4 мм.
Валковые дробилки из двух валков, оси которых расположены в горизонтальной плоскости, позволяют получать молотый продукт с размером частиц 0,5 – 1мм. Валки вращаются навстречу друг другу с окружной скоростью 2 – 4 м/c. Один или оба валка имеют возможность совершать возвратно-поступательное движение по направляющим на тот случай, если в раствор между валками попадет недробимый кусок. Валки могут быть гладкими или зубчатыми. Эффективность дробления во многом зависит от условий подачи материала в дробилку. Наиболее эффективна непрерывная подача материала с равномерным его распределением по длине валка.
В последние годы для получения крупки и порошков применяются конусно-инерционные дробилки (рис. 1.3). В дробилках этого типа измельчение материала происходит в зоне дробления между неподвижным 1 и подвижным конусами 2. Отличительной особенностью таких дробилок является наличие дебалансного вибратора 5, закрепленного на валу дробилки. При вращении вибратора возникает центробежная сила, возбуждающая перемещения подвижного (дробящего) конуса. Этот конус вибрирует с частотой, соответствующей скорости вращения вибратора и одновременно вращается с небольшой скоростью, раздавливая материал, поступающий в зону дробления.
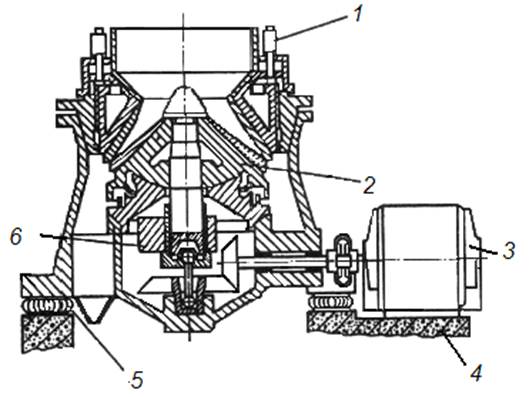
Рис. 1.3. Дробление отходов в конусно-инерционной дробилке:
1 – неподвижный конус; 2 – подвижный конус; 3 – электродвигатель;
4 – основание; 5 – дебаланс; 6 – корпус
Между дробящим конусом и валом дробилки нет жесткой кинематической связи, что предотвращает поломку дробилки при попадании в зону дробления недробимых тел. Наиболее часто в ПМ применяется конусно-инерционная дробилка КИД-300 с диаметром дробящего конуса 300 мм. Максимальный размер куска на входе в эту дробилку 15 мм. Типичный средний размер частиц после дробления около 1 мм. Повторное дробление позволяет дополнительно измельчить порошок, однако с каждым последующим проходом эффективность измельчения падает, а износ мелющих тел растет.
Измельчение в шаровых мельницах
Простейший аппарат для измельчения твердых материалов представляет собой цилиндрический барабан, внутри которого находятся размольные тела в форме шаров или близких к шарам цилиндров округлой полиэдрической формы. При вращении такого барабана (шаровой мельницы) размольные шары поднимаются на некоторую высоту, после чего скатываются или падают вниз, дробя или истирая измельчаемый материал. Отношение диаметра барабана D к его длине L изменяет соотношение между дробящим и истирающим действием шаров. При D/L > 3 превалирует дробящее действие шаров, что эффективно измельчает хрупкие материалы. При D/L < 3 преобладает истирающее действие, более эффективное при измельчении пластичных материалов.
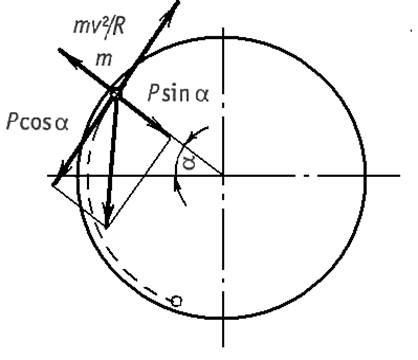
Рис. 1.4. Схема к расчету критической скорости барабана
шаровой мельницы
Рассмотрим поведение единичного шара при работе мельницы, в соответствии со схемой, показанной на рис. 1.4. Одиночный шар с массой Р на поверхности вращающегося барабана имеет окружную скорость v (м/с). В точке m на шар действует центробежная сила Рv2/gR, где g - ускорение силы тяжести, (м2/с); R – внутренний радиус барабана, м. При некотором угле подъема α силу собственного веса шара можно разложить на силы, одна из которых направлена по радиусу Рsinα, а другая направлена по касательной Рсos α. Если пренебречь силой трения, то можно утверждать, что одиночный шар будет удерживаться на поверхности барабана, не падая, до тех пор пока Рv2/gR ≥ Рsin α или v2/gR ≥ sin α. Если скорость вращения барабана такова, что в момент прохождения шара через зенит (α = 90о), шар не упадет, то v2/gR = sin α = 1. Следовательно, v2 = gR. Это условие будет соответствовать критической скорости вращения барабана nкр (мин-1). Отсюда v = πDnкр/60.
Соответственно v2 = gR можно представить как π2D2nкр2 = gD/2. Окончательно получаем формулу для определения критической скорости вращения барабана:
nкр = (g/2π2)1/2 60/D1/2 = 42,4/ D1/2. (1.2)
В действительности для массы шаров не существует единой критической скорости вращения из-за проскальзывания одного ряда шаров по отношению к другим, а также из-за переменного расстояния центра шаров от оси вращения. На практике расчетную величину критической скорости вращения понимают как некую условную величину, в долях которой удобно выражать частоту вращения барабана мельницы.
При небольшой скорости вращения барабана n < 0,2 nкр имеет место режим перекатывания шаров. В этом случае шары поднимаются вместе со стенкой барабана, а затем скатываются по стенке. В центре образуется застойная зона, где шары практически не двигаются. Повышение скорости вращения до n = 0,4-0,6 nкр интенсифицирует движение шаров и сужают до минимума застойную зону. Этот интервал скорости вращения барабана обеспечивает наибольший эффект истирания материала. Он применяется обычно при получении тонких порошков с микронным размером частиц. Дальнейшее повышение скорости вращения барабана изменяет режим движения шаров. При n = 0,75-0,85 nкр наступает «водопадный» режим, когда шары не скатываются, а падают. Такой режим целесообразно применять при получении крупных порошков из хрупких материалов. При n > nкр шары прижимаются к поверхности барабана и перемещаются с небольшой скоростью. Этот режим редко применяется на практике.
Большое влияние на процесс измельчения материала в шаровых мельницах оказывает размер шаров, их масса и отношение этой массы к массе измельчаемого материала. По приближенным оценкам диаметр шара не должен превышать 5 – 6 % от внутреннего диаметра барабана мельницы. Эмпирически определены параметры загрузки барабана шарами и исходным материалом. Обычно в барабан загружают 1,7 – 1,9 кг стальных шаров на 1 л его объема. При этом коэффициент заполнения барабана шарами (φ) не должен превышать 0,4 – 5. При φ > 0,5 шары чаще сталкиваются друг с другом, что снижает эффективность измельчения. При φ < 0,4 снижается производительность мельницы. Объем загружаемого в мельницу материала не должен превышать объема пустот между шарами. Если материала будет больше, то его часть, не вмещающаяся в зазоры, измельчается не эффективно и мешает свободному падению шаров. Обычно соотношении между массами шаров и измельчаемого материала β = 2,5 – 3,5. Если плотность шаров близка к плотности материала, например при измельчении чугунной стружки стальными шарами, то β = 5 – 6. При интенсивном измельчении это соотношение увеличивают до β = 6 – 12. Длительность размола колеблется от нескольких часов до нескольких суток. По мере увеличения времени размола средний размер частиц уменьшается сначала по крутой, а затем по пологой кривой. Чем дольше длится размол, тем меньше отклонение размера частиц от среднего, поэтому иногда приходится увеличивать время размола для выравнивания частиц по размеру.
В США при измельчении материала в шаровых мельницах применяют следующие рекомендации:
‑ размер шара должен быть примерно в 30 раз больше диаметра частиц измельчаемого порошка;
‑ объем шаров должен составлять примерно 1/2 объема барабана;
‑ объем измельчаемого материала должен быть около ¼ объема барабана.
Для расчета времени измельчения за рубежом применяют формулу:
Е = с (1/d22 – 1/d12), (1.3)
где Е – энергия (работа разрушения); с – константа, зависящая от разрушаемого материала, конструкции мельницы и условий измельчения; d1 и d2 – начальный и конечный средний диаметр порошковых частиц. Рассмотрим пример конкретного расчета по формуле (1.3). Чугунную стружку с исходным средним размером частиц 300 мкм надо измельчить до среднего размера 75 мкм. Требуется определить время, необходимое для размола стружки. Для решения задачи сначала проводят экспериментальное измельчение стружки при заведомо малом времени размола с определением среднего размера частиц. Например, чугунную стружку с размером 300 мкм мелят 8 ч. После размола получили порошок со средним размером частиц 110 мкм. Поскольку мощность мельницы величина постоянная, то можно решить задачу по соотношению энергий, затраченных на двух, сопоставляемых этапах работы. Пусть Е1 – энергия, затраченная на измельчение стружки с размера 300 до размера 110 мкм, а Е2 – энергия, затраченная на дробление стружки с размера 110 до размера 75 мкм. Тогда отношение этих энергий составит: Е2 / E1 = (1/752 – 1/1102) / (1 /1102 – ‑ 1/3002) = 1,33. Следовательно, для доизмельчения стружки от 110 до 75 мкм потребуется: 8·1,33 ≈ 10,6 ч. Общее время измельчения стружки с 300 до 75 мкм составит: 8 + 10,6 = 18,6 ч. Из сопоставления энергий Е1 и Е2 видно, что по мере измельчения материала требуется все больше энергии на приращение поверхности. При измельчении частиц от 300 до 110 мкм удельная поверхность порошка возросла в 7,4 раза и на это затрачена энергия Е1. При доизмельчении порошка от 110 до 75 мкм понадобилось энергии в 1,33 раза больше, но удельная поверхность порошка возросла при этом только в 2,15 раза.
Длительность размола на практике колеблется от нескольких часов до нескольких суток. Для интенсификации размола его часто проводят в жидкой среде, которая вызывает адсорбционное понижение прочности измельчаемого материала (эффект Ребиндера). Молекулы жидкости адсорбируются на поверхности измельчаемого материала, что уменьшает поверхностную энергию и снижает прочность. Кроме того, жидкость, проникая в микропоры и трещины частиц, создает в них капиллярное давление, способствующее разрушению частиц. Жидкость уменьшает коэффициент трения между шарами и частицами, что облегчает их перемещение относительно друг друга. Жидкая среда исключает пыление материала, препятствует агломерации дисперсных частиц и их окислению. Предельно мелкий размер частиц, получаемый при тонком механическом измельчении менее 100 нм. В литературе имеются сведения о получении порошков железа с размером частиц 10 – 20 нм и порошков оксидов вольфрама и молибдена размером 5 нм.
Наиболее интенсивное измельчение исходного материала достигается в планетарных центробежных мельницах (ПЦМ). В ПЦМ, схема которой показана на рис. 1.5, электродвигатель через клиноременную передачу вращает корпус-шкив, на периферии которого в обоймах закреплены барабаны, способные вращаться вокруг своей оси. Центры этих барабанов при вращении шкива получают ускорение 20-35g. При вращении барабана вокруг оси шкива шары располагаются в виде сегмента, форма и положение которого во времени не меняется. Массив шаров движется с барабаном, а каждый шар движется по окружности, центром которой является ось барабана.

Рис. 1.5. Планетарная центробежная мельница: 1 – корпус – шкив с
обоймами; 2 – основание; 3 – электродвигатель; 4 – кожух; 5 – подставка
По достижении «зоны отрыва» шары начинают перекатываться в сегменте и вращаться вокруг собственных центров тяжести, что обеспечивает интенсивное истирание материала. «Отрыв» шаров в ПМЦ наблюдается при выполнении следующего неравенства:
RΩ2 > rω2 + g, (1.4)
где R – расстояние от оси корпуса-шкива до оси рабочего барабана; r – радиус рабочего барабана; Ω – угловая скорость вращения корпуса – шкива;
ω – угловая скорость вращения рабочего барабана; g – ускорение силы тяжести.
Наиболее интенсивное измельчение достигается при противоположном вращении корпуса-шкива и рабочих барабанов. В этом случае
R/ r = (1 – k2), (1.5)
где k – передаточное отношение.
С теоретических позиций в ПМЦ можно неограниченно ускорять процесс размола, подбирая соответствующие значения R, r и k. Однако на практике, для определенной конструкции мельницы, параметры R и r остаются постоянными величинами, и процесс измельчения обрабатываемого материала регулируется выбором оптимального значения передаточного отношения (k). Следует иметь в виду, что измельчение в ПМЦ сопровождается значительным намолом примесей в обрабатываемый материал. Это вызвано интенсивным износом размольных тел и стенок барабанов, что является существенным недостатком процесса.
Для быстрого и тонкого измельчения твердых сплавов, карбидов и других, преимущественно, тугоплавких соединений широко применяются вибрационные шаровые мельницы. Принципиальная схема вибрационной мельницы показана на рис. 1.6.
Электродвигатель 1 через эластичную муфту 2 приводит во вращение дебалансный вал 5, что вызывает круговые колебания корпуса 3. Амплитуда колебаний 2 – 4 мм, частота 1000 – 3000 1/мин. Корпус мельницы опирается на пружины 6, амортизирующие действие инерционных сил. Загрузка мельницы, состоящая из измельчаемого материала и шаров, получает частые импульсы от стенок корпуса мельницы. Шары подбрасываются, соударяются, вращаются и скользят по стенкам корпуса. Во всех зонах корпуса на измельчаемые частицы действуют в разных направлениях ударные, сжимающие и срезывающие усилия переменной величины. В отличие от падающих шаров вращающейся мельницы в вибромельнице импульс единичного шара невелик, но большое число шаров и высокая частота вибрации корпуса обеспечивают интенсивное измельчение материала.

Рис. 1.6. Вибрационная мельница: 1 – электродвигатель; 2 – упругая
соединительная муфта; 3 – стальной корпус; 4 – загрузочный люк;
5 – вал с дебалансами; 6 – спиральные пружины; 7 – неподвижная рама
Суммарное число импульсов I сообщаемых шарам в единицу времени составляет:
I = Vkφnzb, (1.6)
где V – объем корпуса мельницы; k ‑ количество размольных шаров в единице объема; φ – коэффициент заполнения корпуса шарами; n – частота вращения дебалансного вала; z – число импульсов, сообщаемых каждому шару со стороны корпуса мельницы за один оборот вала; b – коэффициент, учитывающий дополнительное число импульсов, сообщаемых шару его соседями. Если принять k = 1250 шт/дм3; φ = 0,8; n = 1500 об/мин; z = 1, b = 1, то число импульсов в корпусе мельницы объемом 200 дм3 составит:
I = 200 · 1250 · 0,8· 1500 = 3 · 108 1/мин.
Для порошка, полученного в вибромельнице, характерна округлая форма частиц, что свидетельствует о ведущей роли истирающего воздействия шаров.
Конструкции вибромельниц различаются по технологическим и конструктивным признакам. По технологическим признакам различают мельницы сухого и мокрого помола. По конструктивным признакам мельницы различаются формой корпуса, конструкцией опор, системой загрузки и выгрузки материала и др. Технологические параметры виброразмола обычно устанавливают эмпирическим путем с учетом свойств измельчаемого материала и требуемой дисперсности порошка.
Механическое легирование
За рубежом разработаны высокоскоростные шаровые вращающиеся мельницы с лопастями внутри барабана. При вращении барабана со скоростью n > nкр шары прижаты к внутренней поверхности барабана, а лопасти перемешивают их и возвращают в рабочую зону. Такая мельница применяется, в частности, для получения композитных порошков методом механического легирования. В этом методе совмещается размол двух металлов. При механическом легировании отношение массы шаров к массе смеси порошков составляет более 6/1. Процесс измельчения условно делится на пять стадий:
‑ расплющивание и размол отдельных частиц (10 – 12 мин);
‑ холодное соединение разнородных материалов с образованием «склепанных частиц» с характерной, слоистой структурой (12 – 30 мин);
‑ разрушение «склепанных» частиц и превращение их в более мелкие композитные частицы (30-60 мин);
‑ нарушение параллельности в строении композитных частиц (60 – 100 мин);
‑ повышение внутренней гомогенности частиц, истончение разнородных компонентов и увеличение их числа (более 100 мин).
Механическое легирование – перспективный метод получения порошков дисперсно-упрочняемых материалов, или композиций, компоненты которых обладают малой взаимной растворимостью или сильно различаются по температуре плавления.

Рис. 1.7. Схема вертикального аттритора: 1 – корпус; 2 – рубашка
водяного охлаждения; 3 – вал мешалки; 4 – измельчаемый материал;
5 – размольные шары; 6 – лопасти мешалки

Рис. 1.8. Схема движения шаров в аттриторе
Для интенсивного измельчения материалов и механического легирования применяются также аттриторы, которые представляют собой современную разновидность шаровых мельниц. Схематичное изображение аттритора показано на рис. 1.7. Этот аппарат состоит из неподвижного вертикального барабана, внутри которого со скоростью ≥ 100 1/мин вращается лопастная мешалка. На лопастях мешалки закреплены дополнительные гребки-направляющие с наклоном по отношению к горизонту. Вращение мешалки приводит в движение шары, которые эстафетно передают один другому импульс движения. Шары перемещаются в аттриторе по сложной траектории (рис. 1.8) с разными скоростями.
Произвольное турбулентное движение каждого шара и конвективное движение массы шаров повышает интенсивность измельчения и обеспечивает получение порошков с более равномерным распределением по размерам. В несколько раз сокращается время размола по сравнению с обычной шаровой мельницей.
При механическом легировании чаще всего применяют стальные шары диметром 4 – 10 мм с отношением массы шаров аттритора к массе порошков от 12/1 до 40/1. Продолжительность процесса 10 ч и более. В последние годы за рубежом появились аттриторы с горизонтальной осью вращения, которые называют симолойерами.
Измельчение в вихревых и струйных мельницах
Схема вихревой мельницы приведена на рис. 1.9.
В рабочей камере мельницы вращаются пропеллеры-била в противоположных направлениях со скоростью около 3000 1/мин, создавая вихревой поток. Измельчаемый материал в виде обрезков проволоки или крупного порошка поступает из бункера в вихревой поток, где частицы материала сталкиваются друг с другом и самоизмельчаются. В камеру мельницы насосом нагнетается газ (воздух, азот), поток которого направляет измельченные частицы в приемную камеру.

| Рис. 1.9. Вихревая мельница: 1 – рабочая камера; 2 – пропеллеры; 3 – бункер; 4 – насос; 5 – приемная камера; 6 – отсадочная камера | Рис. 1.10. Струйная мельница: 1 – впускной вентиль; 2 – бункер; 3 – дозатор; 4 – псевдосжиженный слой материала; 5 – форсунки; 6 – ввод газа; 7 – камера измельчения; 8 – сепаратор; 9 – патрубок для вывода измельченного материала и газа |
Скорость газового потока регулируют таким образом, чтобы захватить частицы требуемого размера. Обычно это частицы от 50 до 350 мкм. Более крупные частицы оседают на дне камеры и вновь направляются для повторного измельчения. Форма частиц может быть осколочной, чешуйчатой или округлой. Часто на поверхности расплющенных частиц образуются характерные углубления, напоминающие по форме тарелку. Такие частицы называют тарельчатыми. При вихревом измельчении могут формироваться и дисперсные порошки с пирофорными свойствами, склонные к самовозгоранию. Для предотвращения самовозгорания в рабочую камеру вводят инертный, или нейтральный газ, содержащий до 5 % кислорода. Это обеспечивает создание на поверхности частиц порошка тонкой оксидной пленки, которая устраняет пирофорность.
Часовая производительность вихревых мельниц мощностью 30 кВт составляет 7-15 кг/ч.
Более производительны близкие по принципу работы струйные мельницы, обеспечивающие сверхтонкое измельчение материала. Схема струйной мельницы показана на рис. 1.10.
В рабочую камеру мельницы из трех-четырех форсунок вводят сжатый газ (азот, воздух, перегретый пар) со звуковой и даже сверхзвуковой скоростью. Измельчаемый материал, обрабатываемый газовыми струями, находится в псевдосжиженном состоянии (в кипящем слое). Вихревое движение и многократное соударение частиц приводит к их интенсивному истиранию и самоизмельчению до размера 1-5 мкм. Измельчаемые частицы практически не контактируют со стенками камеры, что предотвращает как износ стенок, так и загрязнение порошка. Из зоны размола дисперсные частицы выводятся направленным вверх газовым потоком и попадают на диск сепаратора. Более крупные частицы (крупнее заданных) сбрасываются сепараторным диском обратно в зону измельчения.
Измельчение металлов резанием
Измельчение металлов резанием это слишком дорогой метод, поэтому он применяется в ограниченном масштабе для получения порошков из металлов с повышенным химическим сродством к кислороду. Например, порошки магния получают с помощью кратц-машины, которая снабжена специальной лентой со стальными щетками. Пластину магния подают в машину, где она прижимается к щеткам ленты. Пластине придается возвратно-поступательное движение. Щетки ленты царапают металл, в результате чего образуются сравнительно крупные частицы магния. Крупность порошка можно регулировать числом и толщиной зубьев щетки, а также скоростью подачи ленты. Минимальный размер частиц – 220 мкм. При необходимости получить более дисперсный порошок, его доизмельчают в шаровой мельнице, в среде углекислого газа.
Более производительным является способ получения порошка магния фрезерованием. Литые заготовки фрезеруют при больших скоростях резания (30 – 40 м/с) и получают частицы размером 90 мкм и более. Образующийся порошок отсасывается в циклон и через шлюзовый затвор поступает на вибрационный грохот для разделения на фракции. Мелкие порошки, не осевшие в циклоне, улавливаются фильтром, брикетируются и переплавляются.
Измельчение ультразвуком
Ультразвуком называют упругие колебания и волны, частота которых превышает 15 – 20 кГц. Низкочастотные УЗК 15 – 100 кГц; средние частоты 100 кГц – 10 МГц; высокие частоты – 10 МГц – 1ГГц и гиперзвук > 1ГГц. Упругие колебания при распространении в газе, жидкости или твердом теле создают звуковую волну, которая образует сгущения и разряжения, соответствующие частоте колебаний. Движение частиц с ускорением приводит к возникновению избыточного, по отношению к атмосферному, давления звуковой волны. В жидкой среде УЗК определенной мощности нарушают сплошность среды и в ней появляются разрывы в виде полостей (коверн), которые в фазе разряжения растягиваются, а в фазе сжатия сжимаются. Подобный процесс пульсации полостей, заполненных газом или паром, называют кавитацией. Реальные жидкости разрываются даже при небольших давлениях, близких к давлению упругости их паров. Это вызвано наличием в жидкостях газовых пузырьков и твердых частиц размером от десятых долей до нескольких микрон. Такие пузырьки и частицы являются зародышами кавитации.
Механизм ультразвукового измельчения материала включает в себя:
‑ кавитационное разрушение частиц за счет энергии, освобождающейся в фазе сжатия, при захлопывании кавитционных пузырьков;
‑ гидроабразивное разрушение, возникающее вследствие взаимодействия частиц в кавитационных потоках.
Кавитационное разрушение объясняется образованием на поверхности частицы в местах концентрации напряжений (микротрещины, неровности поверхности и т. п.) кавитационных пузырьков, пульсация которых приводит к заполнению концентраторов напряжений жидкостью и захлопыванию самих пузырьков. В момент захлопывания пузырька возникает ударная волна, если пузырек больше частицы, или микроструя, если пузырек меньше частицы. Ударные волны и микроструи создают на поверхности частицы растягивающие напряжения порядка 102 – 103 МПа. Таких напряжений вполне достаточно для разрушения твердых частиц, прочность которых понижена из-за наличия разного рода дефектов.
Гидроабразивное разрушение твердых частиц вызвано их соударением при движении в жидкости под воздействием кавитационных потоков. Средняя скорость акустических макропотоков в жидкости невелика и составляет 1 – 1,5 м/с. В то же время скорость микропотоков, возникающих при вторичном расширении кавитационной полости достигает 1500 – 2000 м/с. Возможны даже сверхзвуковые скорости порядка 104 м/с.
Эффективность ультразвукового измельчения зависит от структурно-морфологического состояния частиц материала, прочностных характеристик, параметров ультразвука, длительности процесса и свойств жидкой среды. Наиболее эффективной жидкой средой является вода, поскольку у органических растворителей (спирт, ацетон, бензин, четыреххлористый углерод и др.) упругость паров выше, чем у воды. С повышением упругости пара резко снижается микроударное действие кавитации. Повышение поверхностного натяжения жидкости также снижает эффективность кавитации из-за ухудшения смачиваемости. Соответственно поверхностно-активные вещества (ПАВ), снижающие коэффициент поверхностного натяжения, усиливают процесс кавитации. Повышение температуры жидкости оказывает двоякое воздействие на процесс кавитации. С одной стороны повышение температуры снижает растворимость газов и увеличивает число зародышей кавитации, с другой стороны повышение температуры повышает упругость пара в кавитационной полости и этим снижает кинетическую энергию при захлопывании кавитационного пузырька. Поэтому существует оптимальная область температур для разных жидкостей. Для воды и водных растворов 35 – 50 ºC (средняя упругость пара); для органических жидкостей (спирт, ацетон, бензин) 15 – 25оС (высокая упругость пара); глицерин 80 – 85 ºC (низкая упругость пара).
Объемная концентрация твердых частиц в жидкости (т/ж) обычно выбирается в пределах соотношений от 1/8 до 1/20. Чем концентрированнее суспензия, тем крупнее порошок. Длительность измельчения обычно составляет от 5 до 60 минут. Увеличение времени обработки приводит к образованию агрегатов из частиц.
Ультразвуковые установки для измельчения обычно имеют вертикальное расположение рабочей ванны в форме цилиндра или конуса. Дно и стенки ванны снабжены магнитострикционными преобразователями энергии. Наиболее распространены установки с ванной цилиндрической формы УЗВД-6. Корпус установки выполнен из нержавеющей стали, ее дно является излучателем УЗК. Порошки, получаемые с помощью ультразвука, отличаются повышенной чистотой и дисперсностью. Частицы порошка имеют округлую форму.
Контрольные вопросы
1. Для каких металлов и сплавов целесообразно механическое измельчение в твердом состоянии?
2. Каков принцип работы шаровой вращающейся мельницы?
3. Что такое критическая скорость вращения барабана и как влияет скорость его вращения на процесс измельчения материала?
4. Каковы принципиальные особенности измельчения в аттриторах и планетарных мельницах?
5. В чем преимущество шаровой вибрационной мельницы перед вращающейся?
6. Что представляет собой механическое легирование?
7. Каков механизм ультразвукового измельчения твердых веществ в жидкости?
1.4. Восстановление химических соединений металлов
Практически все металлические порошки могут быть получены методами восстановления химических соединений. Эти методы по своей природе являются физико-химическими, поскольку связаны с изменением химического состава исходного сырья в результате глубоких физико-химических превращений. В качестве исходного сырья при восстановлении используются обогащенные рудные концентраты и отходы производства, например прокатная окалина. Наибольшее распространение в промышленной практике получили методы восстановления оксидов и галогенидов с применением в качестве восстановителей водорода, углерода и химически активных металлов.
Физико-химические основы восстановления
В общем виде реакция восстановления металла Ме из его соединения МеХ с применением восстановителя А может быть представлена следующим образом:
МеХ + А → Ме + АХ. (1.7)
Реакция (1.7) идет в сторону получения металла Метолько в том случае, если при данной температуре и давлении изменение изобарно-изотермического потенциала данной реакции имеет отрицательную величину. Восстановителем может быть только то вещество, которое при температуре реакции обладает более высоким химическим сродством к кислороду, или другим неметаллическим элементам (хлор, фтор), входящим в состав восстанавливаемого соединения. Химическое сродство элементов в данном соединении определяется изменением изобарно-изотермического потенциала ΔGоТ, которым сопровождается образование химического соединения из элементов.
ΔGоТ = ΔGоХА - ΔGоМеА = - RT lnKp, (1.8)
где ΔGоХА, ΔGоМеА – стандартные свободные энергии образования соединений ХА и МеА при абсолютной температуре восстановления Т; Кр – константа равновесия реакции; R – газовая постоянная.
Например, при восстановлении оксидов сопоставляются изобарно-изотермические потенциалы образования двух реакций: 2Ме + О2 = 2МеО и 2Х + О2 = 2ХО. Реакция восстановления (1.7) пойдет в сторону образования металла, если ΔGоТ для образования оксида ХО меньше (по модулю больше) чем ΔGоТ для оксида МеО. На рис. 1.11 приведена зависимость энергии образования оксидов от температуры.
Одним из наиболее распространенных и эффективных восстановителей, в том числе для термодинамически прочных оксидов, является углерод, поскольку с повышением температуры его сродство к кислороду (при образовании СО) возрастает, тогда, как сродство металлов к кислороду с повышением температуры уменьшается. Соответственно можно подобрать достаточно высокую температуру, при которой сродство углерода к кислороду в монооксиде углерода буде выше сродства к кислороду восстанавливаемого металла.

Рис. 1.11. Свободная энергия образования оксидов
Оксиды меди, железа, никеля, кобальта, молибдена, вольфрама обладают сравнительно небольшой термодинамической прочностью и, вполне приемлемым восстановителем для этих оксидов является водород. Когда в реакции участвуют газы, например при восстановлении твердых оксидов водородом (МеО + Н2 = Ме + Н2О), развитие и направление реакции определяется не только температурой, но и отношением парциальных давлений газообразных реагентов. В том случае, когда число участвующих в реакции молекул газа-восстановителя и газа-продукта реакции неравно, равновесие изменяется не только с температурой, но и с изменением общего давления в системе. Уменьшение давления сдвигает равновесие в сторону увеличения общего объема газообразных продуктов. Зависимость константы равновесия от температуры описывается уравнением In KР = - ΔНо/RT + C, где ΔНо – изменение теплосодержания реагирующих веществ при стандартных условиях; С – константа.
Термодинамические свойства веществ, участвующих в реакции и температурная зависимость константы равновесия определяют только возможность протекания реакции в нужном направлении. Реальные условия осуществления процесса восстановления металлов определяются кинетическими факторами. Большое влияние на кинетику процесса восстановления оказывают поверхностные явления, такие как адсорбция, хемосорбция, химические взаимодействия в адсорбированных слоях, каталитическое действие развитых контактных поверхностей, десорбция газообразных продуктов реакции, диффузионные процессы и др.
Адсорбционно-автокалитическая теория восстановления оксидов металлов газообразными восстановителями (водород, монооксид углерода и др.) содержит следующую последовательность актов гетерогенной реакции:
‑ адсорбция газа-восстановителя на поверхности оксида;
‑ отдача электронов атомов адсорбированного восстановителя в решетку оксида с образованием положительных ионов восстановителя (Н2 – 2е = 2Н+);
‑ отрыв от поверхности оксида анионов кислорода;
‑ образование и десорбция молекул Н2О или СО2.
Суммарный процесс восстановления обычно лимитируется диффузией газов, как восстановителя, так и продуктов реакции через слой образовавшегося металла и исходного оксида. В свою очередь скорость диффузии зависит от температуры и газопроницаемости среды. На скорость процесса восстановления оксидов газообразными восстановителями сильно влияет концентрация в зоне реакции паров воды и углекислого газа, которые адсорбируются на поверхности оксидов и замедляют развитие реакции.
Для выявления или уточнения механизма реакции восстановления исследуют влияние температуры на изменение скорости реакции, которое выражается уравнением Аррениуса In k = - E/RT + In c, где k – константа скорости реакции; Е – энергия активации. На графике уравнение Аррениуса представляет собой прямую. Отклонение от прямолинейной зависимости указывает на изменение механизма процесса. Величина энергии активации позволяет судить о преобладании той, или иной составляющей этого механизма (химической, диффузионной и др.).

Порошки железа из оксидного сырья
Железный порошок является одним из основных материалов для производства порошковых изделий, однако до настоящего времени стоимость этого порошка превышает цену стального проката. Это обстоятельство ограничивает широкое применение порошковых изделий в промышленности и стимулирует разработку технологий многотоннажного производства дешевого железного порошка различных марок, отличающихся по фракционному составу, содержанию примесей, технологическим свойствам в зависимости от назначения порошка для различных областей применения.
Наиболее дешевым сырьем для производства железного порошка является прокатная окалина, образующаяся на металлургических заводах при нагреве и охлаждении стальных и чугунных слитков, отливок и других полуфабрикатов. Окалина состоит из смеси Fe3O4 и небольшого количества Fe2O3 при общем содержании железа около 72 %. Другим крупным и дешевым источником сырья для производства железного порошка являются природные железные руды в виде обогащенного концентрата, содержащего более 70 % железа.
В промышленных масштабах железный порошок из оксидного сырья получают с применением разных восстановителей: углерода, водорода, конвертированного природного газа (3Н2 + СО) и др.
Восстановление оксидов железа углеродом
На практике восстановление оксидов проводят при температурах выше 1000 ºC. Непосредственное взаимодействие твердых оксидов с твердым углеродом развивается слабо в связи малой поверхностью соприкосновения твердых веществ. Поэтому термин «восстановление углеродом» не вполне соответствует сущности процесса. При наличии твердого углерода в реакционном пространстве одновременно протекают следующие реакции:
МеО + СО = Ме + СО2 , (1.9)
С + СО2 = 2СО, (1.10)
МеО + С = Ме + СО. (1.11)
Существуют три оксида железа. Наиболее богат железом гематит (Fe2O3), за ним следует магнетит (Fe3O4) и вюстит (FeO). Вюстит представляет собой оксид, содержащий больше кислорода, чем это должно быть по формуле FeO, поэтому он фактически является твердым раствором FeO-Fe3O4 и часто обозначается как FexO при х < 1. Фактически оксиды железа восстанавливается монооксидом углерода. Соответствующие реакции имеют вид:
3Fe2O3(ТВ) + CO(Г) = 2Fe3O4(ТВ) + СО2(Г) + 48,3 кДж, (1.12)
2Fe3O4(ТВ) + СО(Г) = 3FeO(ТВ) + СО2(Г) – 21,84 кДж, (1.13)
FeO(ТВ) + 4СО(Г) = Fe + CO2(Г) + 10,92 кДж, (1.14)
Fe3O4(ТВ) + 4СО(Г) = 3Fe(ТВ) + 4СО2(Г) + 17,22 кДж. (1.15)
Рассмотрим в качестве примера практику восстановления прокатной окалины твердым углеродом на Сулинском металлургическом заводе. Сырьем служит чистая окалина проката низкоуглеродистых сталей, восстановителем термоштыб (отход производства антрацита). Для связывания серы, содержащейся в термоштыбе, в шихту также вводят известняк (СаСО3). Оксидное сырье и восстановительную смесь термоштыба с известняком засыпают несмешивающимися вертикальными концентрическими слоями в тигли из карбида кремния диаметром 350 и высотой 1500 мм. Примерный состав шихты в тигле: оксидное сырье 60 – 70 %: термоштыб 25 – 33 %; известняк 6 –7 %. Масса шихты в тигле примерно 320 кг.
Тигли закрывают крышками и по 16 шт. загружают на вагонетки, которые продвигают толкателями вдоль горизонтальной туннельной печи, обогреваемой природным газом. Расход газа 300-480 м3/ч. Общая длина туннеля составляет около 140 м, размер в поперечном сечении ~ 3,3 м. Протяженность зоны нагрева 30 м, зоны выдержки 66 м и зоны охлаждения 36 м. В горячей зоне печи температура 1180 – 1200 ºC (внутри тигля температура на 100 – 150 ºC ниже). В этой зоне вагонетки с тиглями находятся 40-50 ч. Общая продолжительность пребывания тиглей в печи около 130 ч. После охлаждения тигли без крышек подвергают обезуглероживающему отжигу, который проводят в туннельной печи при 770-800 ºC в течение 44 ч. При этом основная часть избыточного углерода, содержащегося в восстановленном железе, взаимодействует с кислородом атмосферы и удаляется в виде газовой смеси СО + СО2. Из остывших тиглей извлекают восстановленное железо в виде губчатых пористых труб. Трубы механическим способом очищают от термоштыба, разрезают на куски, дробят и измельчают в несколько стадий с классификацией на фракции требуемой крупности. Каждая из фракций порошка проходит магнитную сепарацию для удаления неметаллических включений. С целью рафинирования порошков по углероду и кислороду и снятию наклепа (для повышения качества) применяют восстановительный водородный отжиг в конвейерных печах при 800-900оС. После отжига спеки дробят, измельчают, рассеивают и усредняют по химическому и гранулометрическому составу в соответствии с требованиями ГОСТ 9849 – 86. Готовые порошки упаковывают в мешки из полиэтиленовой пленки (25 кг в мешок).
Восстановление оксидов железа водородом
Процесс восстановления Fe2O3 до Fe происходит по трехступенчатой схеме Fe2O3 → Fe3O4 → FeO → Fe (при температуре выше 572 ºC), или по двух- ступенчатой схеме Fe2O3 → Fe3O4 → Fe (при температуре ниже 572 ºC), что соответствует принципу последовательности восстановления А.А. Байкова.
Ниже приводятся соответствующие реакции восстановления:
2 Fe2O3(ТВ) + Н2(Г) = 2 Fe3O4(ТВ) + Н2О(г) + 7,14 кДж, (1.16)
Fe3O4(ТВ) + Н2(Г) = 3FeO(ТВ) + Н2О(г) – 63 кДж, (1.17)
FeO(ТВ) + Н2(Г) = Fe(ТВ) + Н2О(г) – 30,24 кДж, (1.18)
Fe3O4(ТВ) +4Н2(Г) = 3Fe(ТВ) + 4Н2О(г) – 224,14 кДж. (1.19)
Реакция (1.16) – экзотермична, остальные реакции – эндотермичны. Восстановление оксидов железа водородом сравнительно дорогой процесс, поэтому его используют преимущественно при получении железного порошка высокой чистоты. Чистый водород получают в промышленных масштабах электролизом воды. Менее чистый, но более дешевый водород можно получить конверсией природного газа, или (в смеси с азотом) диссоциацией аммиака. В промышленной практике водород используют не только для первичного восстановления прокатной окалины или рудного концентрата, но и для восстановительного отжига (довосстановления) железного порошка, полученного более дешевыми способами – восстановлением углеродом, или распылением расплава.
Наиболее распространен способ восстановления оксидов водородом в муфельных или трубчатых печах с внешним обогревом. Оксиды загружаются в поддоны или лодочки, которые непрерывно продвигаются через горячую зону печи. Водород подается со стороны холодной зоны по принципу противотока, чем достигается наиболее полное восстановление. Температура восстановления 700-1000 ºC, время восстановления от 30 мин до нескольких часов, в зависимости от размера частиц и толщины слоя оксида, температуры, давления и влажности водорода и др. Существенным недостатком восстановления оксидов железа водородом в муфельных и трубчатых печах является низкая производительность печей, поскольку для равномерного восстановления требуется небольшой по толщине слой шихты. Процесс нельзя ускорить повышением температуры сверх 1000 ºC, из-за спекания порошка в прочные брикеты, которые трудно измельчать.
В промышленном масштабе оксиды железа или окалину обычно восстанавливают генераторным или другим газом, содержащим помимо водорода монооксид углерода.
При работе с водородом необходимо соблюдать меры, предотвращающие возможность образования взрывчатой (гремучей) смеси водорода с воздухом. Холодная печь должна быть предварительно продута водородом до полного вытеснения из нее воздуха. Для проверки отсутствия в печи гремучей смеси набирают в пробирку пробу газа, выходящего из печи. Пробирка вносится в печь в вертикальном положении вверх дном. Затем пробирку, в стороне от печи, подносят к пламени горелки или спички. Хлопок указывает на наличие гремучей смеси в пробирке, а постепенное, спокойное сгорание водорода в пробирке указывает на отсутствие в печи горючей смеси. Трубопроводы, муфты, переходники, краны, подводящие водород, необходимо периодически проверять на отсутствие течи (например, смачиванием мыльной водой). Над местами возможного выделения водорода (загрузочные и разгрузочные дверцы и люки печей и др.) следует располагать вытяжные зонты. В самых верхних точках производственных помещений (под потолком) необходимо располагать выходные вентиляционные каналы.
Кроме рассмотренных выше способов восстановления оксидов, на практике применяются некоторые усовершенствованные модификации этих способов. В частности, достаточно широко применяется комбинированный способ восстановления оксидов железа природным конвертированным газом. Так как метан, содержащийся в природном газе, не является активным восстановителем, природный газ конвертируют, обрабатывая его водяным паром. В результате получают газовую смесь, состоящую из водорода (75 %) и СО (25 %), стоимость которой в несколько раз ниже стоимости водорода.
С целью повышения производительности печей разработан способ восстановления оксидов сажистым железом. Сажистое железо, содержащее 20-40 % углерода, можно получить либо разложением природного газа на поверхности и в порах железной губки, либо обработкой окалины или магнетитового концентрата неконвертированным природным газом. В сажистом железе дисперсные, разветвленные частицы сажи прочно сцеплены с поверхностью частиц железа. Лабораторные исследования и производственные опыты показали, что использование сажистого железа ускоряет процесс восстановления, повышает производительность печи и позволяет на 100 – 200 ºC снизить температуру процесса. Вероятно, эти эффекты объясняются весьма высокой активностью частиц сажи, ускоряющей процесс регенерации монооксида углерода и водорода, если последний входит в состав восстановительного газа.
Для повышения чистоты железных порошков разработан и опробован содовый способ восстановления окалины или суперконцентрата. При этом способе в шихту добавляют 10-20 % соды (Na2CO3). Сода взаимодействует с содержащимися в шихте примесями SiO2, Al2O3 и др. В результате образуются растворимые силикаты, алюминаты и др., которые можно отмыть при обработке водой восстановленного и измельченного железа. Кроме того, сода ускоряет процесс газификации углерода и процесс восстановления за счет взаимодействия ионов натрия с поверхностью оксида. По технологии разработчика (Ереванский политехнический институт) мокрое измельчение восстановленного в присутствии соды продукта, сочетается с мокрой магнитной сепарацией, что позволяет отделить не только растворимые, но и другие нерастворимые неметаллические примеси. Восстановленный и измельченный продукт содержит 99,8-99,9 % железа.
Хлоридный способ получения порошков железа
Сущность способа в растворении исходного железосодержащего материала (обрезь проката, листовые отходы и т. п.) в соляной кислоте и последующем восстановлении хлорида железа водородом. В основе процесса лежит реакция: Fe + 2HCl = FeCl2 + H2 - 87,6 кДж. В первой фазе эта реакция протекает слева направо (растворение железа), а во второй фазе справа налево (восстановление хлорида железа).
В герметичный реактор с кислотостойкой футеровкой загружают стальной или чугунный скрап и заливают 15-20 % раствор соляной кислоты. Выделяющийся при растворении железа водород пропускают через очистители, в которых улавливают кислотные примеси (НСl и Н2S). После сушки водород поступает в восстановительную печь. Раствор хлорида железа сливают в отстойник и через фильтр направляют в упариватель. Затем насыщеннай горячий раствор сливают в кристаллизатор, где при охлаждении выпадают кристаллы FeCl2 ·4Н2О. Примеси, содержащиеся в исходном сырье, остаются в отвальном кеке после фильтрования раствора. Кристаллы хлорида обезвоживают на центрифуге и в сушильной камере, брикетируют на прессе и направляют в восстановительную печь. Восстановление хлорида ведут подогретым водородом при 600-650 ºC в шахтной печи периодического действия. Пористую, слабо спеченную массу кристаллического железа, являющуюся продуктом восстановления, измельчают в молотковой или вихревой мельнице в мелкозернистый порошок. Содержание кислорода в порошке около 0,1 %; углерода – не более 0,015 %; хлора – не более 0,005 %; кремния – не более 0,006 %. Поскольку восстановление протекает при низкой температуре, порошок получается мелкозернистым и отличается хорошей прессуемостью, что позволяет его прокатывать в беспористые листы.
Металлотермическое восстановление
При металлотермическом восстановлении металлов из химических соединений в качестве восстановителя используется металл с более высоким химическим сродством к неметаллическому элементу химического соединения, чем восстанавливаемый металл. Метод металлотермического восстановления широко применяется для производства редких металлов (титан, цирконий, ниобий, тантал, бериллий и др.), легких металлов (рубидий, цезий, магний, барий), ферросплавов, сплавов на основе алюминия и др. Впервые метод металлотермии был реализован Н.Н. Бекетовым при вытеснении магнием алюминия из криолита.
В общем виде металлотермическое восстановление описывается реакцией:
МеХ + Ме* = Ме + Ме*Х ± Q, (1.20)
где МеХ – восстанавливаемое соединение; Ме*- металл восстановитель; Q – тепловой эффект реакции.
Анализ зависимостей свободной энергии образования оксидов и галоидных солей от температуры показывает, что наибольшей убылью свободной энергии сопровождается образование соединений кальция, магния, алюминия, натрия. Эти элементы обычно используют для металлотермических реакций взаимодействия. При выборе конкретного восстановителя руководствуются следующими требованиями:
‑ восстановитель должен обеспечивать наиболее полное восстановление при возможно меньшим подводе тепла извне;
‑ образующийся шлак, а также избыток восстановителя должны легко отделяться от получаемого металла;
‑ восстановитель должен быть высокой чистоты, чтобы не загрязнять восстанавливаемый металл примесями;
‑ восстановитель не должен растворяться в восстанавливаемом металле и образовывать с ним устойчивых химических соединений;
‑ восстановитель должен быть относительно дешевым и не дефицитным.
Рассмотрим в качестве примера процесс металлотермического восстановления оксидов и хлоридов титана. Титан отличается высоким химическим сродством к кислороду, поэтому для полного восстановления диоксида титана приходится применять кальций. Более дешевый металл-восстановитель ‑ магний способен восстанавливать титан лишь частично (до ТiО). Восстановление диоксида титана кальцием проходит по суммарной реакции: TiO2 + 2Ca = Ti + + 2CaO =360 кДж. Для более полного восстановления в шихту вводят избыток кальция (25 – 10 %) по сравнению со стехиометрическим составом. Тепловой эффект реакции невелик, поэтому необходим внешний подогрев. Процесс проводят при 1000-1100оС. При этих температурах жидкий кальций обеспечивает хороший контакт с частицами диоксида. Оксид кальция, образующийся во время реакции вместе с кристаллами титана, препятствует их росту, поэтому полученный титановый порошок отличается высокой дисперсностью (размер зерен 2 – 3 мкм). Такой дисперсный порошок окисляется при отмывке водой. Для предотвращения окисления в исходную шихту обычно добавляют хлористый кальций с температурой плавления 782 ºC. Хлористый кальций расплавляется и растворяет оксид кальция, переводя его в расплав. Этим достигается укрупнение титанового порошка до размера зерен 10 – 15 мкм, что, в конечном счете, значительно уменьшает степень его окисления. Титан, полученный кальциетермическим методом, имеет следующий химический состав, (% масс.): Ti 98,5 – 99,0; N2 0,03 – 15; О2 0,2 – 0,3; Н2 0,01 – 0,03; Si 0,1 – 0,2; С 0,01 – 0,05; Fe 0,10 – 0,25; Аl 0,05 – 0,15; Са 0,1 – 0,3; Сu 0,01 – 0,1; Mg < 0,03.
Шихту в реторту загружают в виде предварительно спрессованных брикетов, что увеличивает вместимость реторты. Для нагрева обычно используют тигельные печи с силитовыми нагревателями. После выдержки при температуре 1000 – 1100 ºC в течение 1ч реторту выгружают из печи, охлаждают и вынимают из нее застывший сплав с вкраплениями металла. Затем сплав измельчают и обрабатывают холодной водой (с избытком воды) для предотвращения сильного разогрева при гашении оксида кальция. Полученный порошок промывают разбавленной уксусной (соляной, азотной) кислотой до полного растворения избытка металлического и хлористого кальция. После отмывки порошок титана сушат в вакуумном шкафу при 40 – 50 ºC. Существует также двухстадийный комбинированный процесс производства титанового порошка: на первой стадии диоксид титана восстанавливается магнием до ТiО, а на второй стадии ТiО восстанавливается кальцием. При этом снижается расход более дорогого кальция.
Среди различных способов металлотермического производства титанового порошка наиболее экономичным является восстановление тетрахлорида титана магнием (метод Кролля). Реакция восстановления интенсивно протекает при 800 – 900 ºC:
ТiCl4(Г) + 2Mg(Ж) = 2МgСl2(Ж) + Тi(ТВ) + 514,3 кДж. (1.21)
Восстановление тетрахлорида титана магнием осуществляют в герметичных стальных аппаратах, заполненных аргоном или гелием. После тщательной очистки аппарата в него загружают слитки магния, откачивают воздух и заполняют инертным газом. Затем медленно разогревают тигель до полного расплавления магния, после чего через впускную трубку в крышке вводят тетрахлорид титана при строгом контроле скорости его подачи. Контроль необходим из-за большого выделения тепла при взаимодействии тетрахлорида титана с магнием. Накапливающийся в тигле хлористый магний периодически выпускается через летку в нижней части тигля. Полученный продукт реакции удаляют из тигля и направляют на обработку в разбавленной соляной кислоте для удаления остатков магния, а затем на отмывку в воде для растворения хлористого магния. Обработанный продукт подвергают мокрому измельчению в шаровых мельницах, после чего его опять обрабатывают раствором соляной кислоты от железа, натертого при размоле. Полученный описанным методом порошок содержит, %: Мg 0,4 – 0,5; Cl 0,01 – 0,15; Fe ~ 0,1; H2 ~ 0,1; O2 0,05 – 0,10; титан – остальное.
Восстановление химических соединений металлов из растворов
Автоклавный способ
Этим способом получают порошки меди, никеля и кобальта. Сущность способа заключается в вытеснении металла из его соединения водородом под давлением. Исходным сырьем обычно являются рудные концентраты, или скрап, например медно-цинковый. Такой материал обрабатывают серной кислотой, или подвергают окислительному аммиачно-карбонатному выщелачиванию. Полученный раствор сульфата, или аммиачной соли меди очищают от примесей и в автоклаве под давлением восстанавливают водородом. Реакция восстановления катиона металла Меz+ + (z/2)H2 → Meo + zH+ возможна только в том случае, если в ряду электроотрицательности потенциал водорода меньше потенциала восстанавливаемого металла. Имеется возможность снижать потенциал водорода, повышая давление или рН раствора, причем повышение рН значительно эффективнее.
При получении медного порошка в качестве исходных растворов используют раствор сульфата меди или медно-аммиачной комплексной соли:
СuSO4 + H2 = Cu + H2SO4, (1.22)
[Cu(NH3)4] SO4 + H2 + H2O = Cu + (NH4)2 SO4 + 2 NH4OH. (1.23)
Согласно термодинамическим расчетам медь, никель, кобальт и некоторые другие металлы можно восстановить водородом из растворов при температуре 25 ºC и давлении водорода 0,1 МПа. Однако скорость осаждения металлов при этих параметрах очень мала, поэтому на практике применяют более высокие значения температуры и давления. Например, восстановление меди проводят при суммарном давлении газа в автоклаве 2,5 – 3,5 МПа (парциальное давление водорода 1,5-2,5 МПа) и температуре от 140 до 200 ºC. Извлечение меди в осадок составляет около 99 %. Получаемые порошки меди имеют размер частиц от 2-3 до 15-20 мкм, размер частиц в указанных пределах регулируют, вводя в раствор мелкие порошки меди, или частицы полиакриламида (0,1-0,5 г на 1 л раствора). Форма частиц самая разнообразная: дендритная, губчатая, округлая. Соответственно насыпная плотность порошков колеблется в значительных пределах от 0,5 до 3,8 г/см3. Химическая чистота автоклавных порошков высокая (99,7-99,9 % Сu, ≤ % 0,1O2, ≤ 0,01 % Fe). Следует отметить, что себестоимость медных порошков, полученных автоклавным способом, примерно в 2 раза меньше себестоимости электролитических порошков.
Получение порошков цементацией
Процесс, основанный на реакции вытеснения из раствора одного металла другим, называют цементацией. Если расположить нормальные электродные потенциалы металлов в порядке их возрастания, будет получен так называемый ряд напряжений. Каждый металл, расположенный выше в этом ряду (более благородный), способен вытеснить из раствора соли все нижестоящие металлы (менее благородные), при этом сам вытесняющий металл переходит в раствор. Например, если в раствор сернокислой меди погрузить цинковую пластинку, то на ней начнет выделяться медь, а цинк будет переходить в раствор: CuSO4 + Zn = ZnSO4 + Cu.
Растворение и осаждение металлов из растворов солей регулируется противоположно действующими силами – электролитической упругостью растворения и осмотическим давлением ионов раствора. Так, растворение цинка и осаждение меди в системе «цинк-раствор его ионов» и «медь-раствор ее ионов» протекает под действием разности величин осмотического давления и электролитической упругости растворения. Эта разность создает электроотрицательный или электроположительный потенциал. У цинка электролитическая упругость значительно больше величины осмотического давления и значение разницы будет отрицательным, следовательно, цинк имеет электроотрицательный потенциал. У меди, наоборот, величина упругости растворения меньше величины осмотического давления, разность положительная и медь имеет электроположительный потенциал. По мере развития реакции замещения меди цинком концентрация ионов цинка в растворе будет возрастать, а концентрация ионов меди уменьшаться. Соответственно электроотрицательный потенциал цинка будет уменьшаться (из-за увеличения осмотического давления ионов), а электроположительный потенциал меди также будет уменьшаться. Когда оба электродных потенциала сравняются по величине и знаку, реакция прекратится.
Скорость реакции замещения определяется разностью потенциалов электродов. Чем меньше эта разность, тем меньше скорость реакции. Поэтому на практике для цементации подбирают такие пары, у которых разность потенциалов была бы возможно большей. На ход реакции цементации оказывают влияние и другие факторы. В частности, цементирующий металл должен образовывать растворимое соединение с анионом замещаемого металла. В противном случае процесс не пойдет. Например, железо не может замещать медь в аммиачных растворах, поскольку оно не образует растворимых комплексных соединений с аммиаком. В результате железо не переходит в раствор, а образует Fe(OH)2 или Fe(OH)3. Для ускорения реакции цементирующий металл должен быть в избытке. При цементации может происходить






