’имические свойства жиров обусловлены наличием:
1. —ложных эфирных св€зей,
2. ƒвойных св€зей в углеводородных радикалах жирных кислот,
3. Ќаличием глицерина в составе жира.
1. ќбусловленные наличием сложных эфирных св€зей
∆иры легко подвергаютс€ гидролитическому расщеплению при участии ферментов, образуетс€ глицерин и жирные кислоты.
‘ерментативный гидролиз происходит ступенчато. ‘ермент - липаза содержитс€ во всех жирномасличных растени€х. √идролизу способствует влага и повышенна€ температура. ѕроисходит гидролитическое прогоркание жира.
”казанное свойство учитываетс€ при хранении жиров.
∆иры расщепл€ютс€ под действием щелочей с образованием глицерина и солей жирных кислот. ќбразующиес€ соли называют мылами: калиевые мыла Ц жидкие, натриевые - твердые.
ѕроцесс называют омылением
 C3H5(COOR)3 + 3 NaOH C3H5 (OH)3 + 3 R`COONa
C3H5(COOR)3 + 3 NaOH C3H5 (OH)3 + 3 R`COONa
—войство учитывают в анализе жира. –еакци€ омылени€ широко используетс€ дл€ приготовлени€ бытовых и медицинских мыл, а также дл€ вы€снени€ состава жиров и их доброкачественности.
„ем больше число омылени€, тем меньше молекул€рна€ масса глицеридов.
2. ќбусловленные наличием двойных св€зей в углеводородных радикалах жирных кислот
ѕо двойньм св€з€м жирных кислот может присоедин€тьс€ водород, галогены, кислород.
1). ѕрисоединение водорода - гидрирование жиров (гидрогенизаци€ жиров) идет при повышенной температуре в присутствии катализатора (трубчатый никель).
Ќепредельные жирные кислоты переход€т в предельные, жидкие масла превращаютс€ в твердые. ѕолучают саломассы, их используют в медицинской практике как мазевые и суппозиторные основы (бутирол) и в пищевой промышленности - производство маргарина.
–еакци€ гидрогенизации широко используетс€ дл€ получени€ плотных жиров из растительных масел.
2). ѕрисоединение галогенов Ц это свойство используют в анализе жиров. ѕри определении химической константы - йодного числа.
Ќадежным способом вы€влени€ высыхаемости масел служит определение йодного числа. »звестно, что все непредельные кислоты, в том числе и жирные, способны присоедин€ть по месту двойной св€зи галогены.
„ем больше в жирных кислотах будет двойных св€зей, тем больше присоединитс€ галогенов.
ѕо величине йодного числа можно легко установить, к какой группе по степени высыхаемости относитс€ то или иное масло.
…одное число некоторых масел
| Ќевысыхающие масла (тип олеиновой кислоты) | |
| ќливковое | 80-85 |
| јрахисовое | 83-105 |
| ћиндальное | 93-102 |
| ѕерсиковое | 96-103 |
| асторовое | 81-90 |
| ѕолувысыхающие масла (тип линолевой кислоты) | |
| √орчичное | 93-107 |
| унжутное | 103-112 |
| ’лопковое | 100-120 |
| ѕодсолнечное | 119-144 |
| укурузное | 111-131 |
| ¬ысыхающие масла (тип линоленовой кислоты) | |
| ћаковое | 131-143 |
| онопл€ное | 140-175 |
| Ћьн€ное | 169-192 |
—пособность некоторых масел к высыханию широко используетс€ в народном хоз€йстве (лакокрасочна€ промышленность).
|
|
|
ƒл€ медицины, наоборот, представл€ют интерес масла невысыхающие, поскольку они используютс€ дл€ парентерального введени€ лекарственных средств.
ќлеинова€ кислота обладает способностью под вли€нием азотистой кислоты переходить в свои стереоизомер - элаидиновую кислоту, котора€ при комнатной температуре имеет твердую консистенцию.
Ётой реакцией, известной под названием элаидинова€ проба, широко пользуютс€ дл€ определени€ типа масла: если проба положительна€, то, следовательно, исследуемое масло невысыхающее (содержит триглицериды олеиновой кислоты).
3). ѕрисоединение кислорода воздуха приводит к окислению и прогорканию жиров. ћожет быть химическое окисление (альдегидное) и биохимическое при участии микроорганизмов (кетонное). ∆иры приобретают специфический вкус и запах и к употреблению непригодны. »змен€етс€ цвет жира - чаще обесцвечиваютс€; измен€ютс€ физические и химические свойства жира: увеличиваетс€ плотность и кислотное число, уменьшаетс€ йодное число и в€зкость.
–азличают 3 вида окислительного прогоркани€:
1 - неферментативное - кислород присоедин€етс€ по месту двойных св€зей, образу€ пероксиды; при разложении пероксидов жирных кислот получаютс€ альдегиды.
+O2



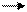






 R1 Ц CH = CH Ц R2 R1 Ц CH Ц CH Ц R2 R1 Ц C = O + R2 Ц C = O
R1 Ц CH = CH Ц R2 R1 Ц CH Ц CH Ц R2 R1 Ц C = O + R2 Ц C = O
 O O H H
O O H H
2. - ферментативное с участием липоксидаз и липоксигеназ, образуютс€ гидропероксиды.
+O2

 R1 Ц CH2 Ц CH = CH2 Ц R2 R1 ЦCH2 Ц CH = CH Ц CH Ц R2
R1 Ц CH2 Ц CH = CH2 Ц R2 R1 ЦCH2 Ц CH = CH Ц CH Ц R2
O - OH
√идропероксиды способны окисл€ть Ѕј¬, содержащиес€ в масле, например, каротиноиды. √идроперикиси подвергаютс€ разложению с образованием альдегидов и кетонов.
—войство учитывают при хранении жиров и при анализе.
3. - ферментативное (кетонное) - происходит при участии микроорганизмов, образуетс€ кетокислота и кетон
Ётот вид порчи жира легко контролируетс€ по величине кислотного числа ( „).
√лииерин, вход€щий в состав жира, подвергаетс€ окислению и дегидратации при нагревании жира с конц. серной кислотой. ќщущаетс€ непри€тный запах акролеина. Ёто Ђакролеинова€ пробаї, позвол€юща€ отличить жиры от жироподобных веществ.

акролеин






