Решив его относительно p, получим
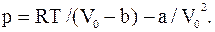
Здесь Vo – молярный объем, но не объем всей массы пара. Поэтому на основании определения плотности можно записать
Vo=m/r,
где m – молярная масса пара.
Подставив это значение Vo в вышенаписанную формулу, найдем

Взяв из таблиц значения постоянных a и b для воды, выразив все величины, входящие в формулу, в единицах СИ, выполнив вычисления, найдем
p=5,1×108 Па=5,2×103 ат.
Ответ: p=5,2×103 ат.
68. Определить давление m=280 г азота, находящегося при температуре 27 oС в сосуде, объем которого равен: 1) V=1,00 м3;
2) V=0,50 л.
Решение. Чтобы решить вопрос о том, каким следует считать данный газ – идеальным или реальным, найдем молярный объем газа Vo. Пусть в сосуде содержится n=m/m молей газа. Тогда
Vo=V/n=Vm/m.
Учитывая, что молярная масса азота m=0,028 кг/моль, получим:
1) Vo=1,00×0,28/0,28=0,10 м3/моль;
2) Vo=0,5×10-3×0,028/0,28=5,0×10-5 м3/моль.
Сравнивая вычисленные значения Vo с молярным объемом газа при нормальных условиях Vo(норм)=22,4×10-3 м3/моль, видим, что в первом случае газ достаточно разряжен и его можно считать идеальным. Уравнение состояния идеального газа для одного моля запишем так:
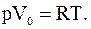
Отсюда
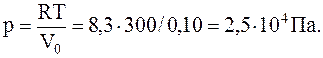
Во втором случае Vo<Vo(норм), и газ следует считать реальным. Его давление найдем из уравнения Ван дер Ваальса для реального газа
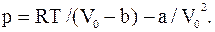
Взяв из таблиц значения постоянных Ван дер Ваальса для азота: a=0,13 м4×Н/моль2, b=3,7×10-5 м3/моль, произведем вычисление:
p=1,4×108 Па.
Заметим, что, вычисляя давление по формуле, характерной для состояния идеального газа, получили бы в этом случае неверный результат:
p=0,5×108 Па.
Ответ: p=0,5×108 Па.
69. Определить массу кислорода в баллоне, объем которого V=10,0 л при температуре 27 oС и давлениях:1) p1=1,00 ат;
2) p2=410 ат.
Решение. В первом случае (p=1,00 ат) кислород в баллоне находится при условиях, близких к нормальным. То обстоятельство, что температура газа несколько выше нормальной, означает лишь, что его плотность при этом давлении меньше, чем при нормальных условиях. Поэтому без большой погрешности можно считать газ идеальным. На основании уравнения состояния идеального газа, учитывая, что для кислорода m=0,032 кг/моль, получим:
 кг.
кг.
Во втором случае (p=410 ат), учитывая большое по сравнению с нормальным давление газа, следует считать его реальным и вести расчеты на основании уравнения Ван дер Ваальса.
Масса газа определяется соотношением:
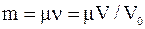 ,
,
где m – молярная масса;
n – число молей;
V – объем газа;
Vo – его молярный объем.
Таким образом, необходимо из уравнения Ван дер Ваальса
 ,
,
найти величину Vo, а затем массу газа.
Уравнение Ван дер Ваальса является уравнением третьей степени относительно V0 и поэтому имеет, вообще говоря, три корня. Однако учитывая, что кислород в баллоне находится при температуре выше критической (tкр=-119 oС), можно утверждать, что при определенном давлении газ будет иметь лишь один определенный объем. Следовательно, кубическое относительно Vo уравнение Ван дер Ваальса имеет в данном случае лишь один действительный корень. Его можно найти методом последовательных приближений, поскольку расчеты, связанные с решением кубического уравнения по общей формуле Кардано, весьма громоздки.
В качестве первого приближения вычислим молярный объем Vo1 газа, рассматривая его как идеальный. Тогда из уравнения состояния идеального газа получим
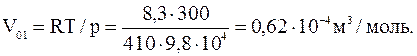
Теперь, обозначив в уравнении Ван дер Ваальса поправку на давление через po1=a/Vo2, найдем величину Vo
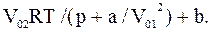
Взяв из таблиц значения постоянных a и b для кислорода, выразим в единицах СИ входящие в формулу величины: p=410×9,8×104 Па, Vo1=0,62×10-4 м3/моль, R=8,3 Дж/(моль×К), Т=300 К, a=0,13 м4Н/моль2, b=3,1×10-5 м3/моль. Выполнив вычисление, найдем
Vo2=0,65×10-4 м3/моль.
Еще раз, вычислив по формуле, полученной из уравнения Ван дер Ваальса, считая при этом p1=a/Vo22, получим третье приближение:
Vo3=0,66×10-4 м3/моль.
Повторяя таким образом вычисления, будем получать все более точные значения Vo:
Vo4=0,67×10-4 м3/моль;
Vo5=0,67×10-4 м3/моль;
Видим, что при дальнейших вычислениях, если ограничиться точностью до второго знака, результат не будет изменяться. Если же взять значение Vo5=0,68×10-4 м3/моль, то получим прежнее значение
Vo6=0,67×10-4 м3/моль.
Поэтому, действительным корнем кубического уравнения Ван дер Ваальса, вычисленным с точностью до второго знака, будет
Vo=0,67×10-4 м3/моль.
Теперь вычислим искомую массу газа
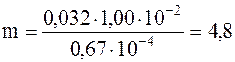 кг.
кг.
Легко убедиться в том, что вычисление по уравнению Менделеева-Клапейрона дало бы в этом случае неверный результат
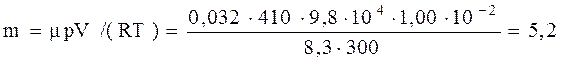 кг.
кг.
Ответ: 1). m=0,013 кг; 2). m=4,8 кг.
70. Какую часть объема стеклянной ампулы должен занимать жидкий эфир при t=20 oС, чтобы при его нагревании можно было наблюдать переход вещества через критическое состояние? Для эфира m=0,074 кг/моль, r=714 кг/м3 при 20 oС, t=194 oС, p=35,6 ат.
Решение. Переход вещества через критическое состояние характерен тем, что при этом исчезает различие между жидкой и газообразной фазами вещества. Критическое состояние характеризуется определенными для каждого вещества параметрами: критическими значениями температуры Тк, давления pк и молярного объема V0к. При этом критический объем всей массы вещества, содержащей n=m/m молей, равен:
Vк=n V0к=(m/m) V0к.
Если вещество, нагретое до критической температуры Tк, окажется в объеме V, не равном Vк,то оно не будет при этом находиться в критическом состоянии. В этом случае при достижении температуры Tк не будет исчезать различие между двумя фазами, так как еще до достижения Tк все вещество при нагревании постепенно перейдет в одну фазу (при V>Vк вся жидкость в сосуде испарится, при V<Vк весь пар сконденсируется). Таким образом, для того чтобы наблюдать переход вещества, находящегося в ампуле, через критическое состояние, необходимо, чтобы при достижении критической температуры занимаемый им объем V был равен критическому объему Vк.
Так как в этот момент вещество будет равномерно заполнять всю ампулу, то V является одновременно и объемом ампулы.
Искомое отношение объема Vж жидкого эфира к объему V ампулы найдем из ранее написанных уравнений, с учетом того, что m/Vж=r – плотность жидкого эфира:
Vж/V=Vж/Vк=mVж/mV0к=m/rVoк.
Выразив величину V0к через известные pк и Tк получим
Tк/pк=8a×27b2/27bRa=8b/R;
V0к=3b=3RTк/8pк.
Окончательно для искомого отношения имеем:
Vж/V=8mpк/(3RrTк).
Выразим в единицах СИ данные величины: m=0,074 кг/моль, p=35,6×9,8×104 Па, r=714 кг/м3, Тк=467 К. Подставив эти значения в формулу и выполнив вычисление, найдем
Vж/V=0,25.
Ответ: Vж/V=0,25.
71. Какой толщины следовало бы сделать деревянную стену здания, чтобы она давала такую же потерю теплоты, как и кирпичная стена толщиной d=40 см при одинаковой температуре внутри и снаружи здания? Коэффициенты теплопроводности кирпича и дерева равны соответственно: Кк=0,70 Вт/(м×К), Кд=0,175 ВТ/(м×К).
Решение. Количество теплоты, переданное через площадь S за время t, если расстояние между плоскостями d, а разность температур между ними DT, равно
Q=KDTtS/d,
где K – коэффициент теплопроводности.
Запишем уравнение теплопроводности через стену для обеих материалов:
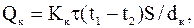

Так как потеря теплоты должна быть одинаковое, т.е. Qк=Qд, имеем
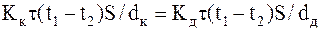 .
.
Откуда толщина деревянной стены
dд=dкKд/Kк.
Подставим в полученное соотношение числовые значения в единицах СИ, после вычислений, будем иметь
dд=0,4×0,175/0,70=0,1 м.
Ответ: dд=0,1 м.
72. Стена нагревательной печи толщиной d=0,75 м выполнена целиком из огнеупорного шамотного кирпича с коэффициентом теплопроводности K1=1 Вт/(м×К). Какова будет толщина стены, если ее выполнить двухслойной, сохранив первый слой из того же материала толщиной d1=0,25 м, а второй слой из неогнеупорного, но малотеплопроводного, материала, у которого коэффициент теплопроводности K2=0,1 Вт/(м К)? Тепловой поток и температуры наружных поверхностей у двухслойной стены те же, что и у однослойной.
Решение. Тепловой поток – количество теплоты, переданное единичной площади в единицу времени, можно определить по формуле

где K – коэффициент теплопроводности;
DT – разность температур;
d – расстояние между двумя плоскостями.
Запишем уравнение теплового потока через однослойную стену и через каждый из слоев двухслойной:
q1=K1(t1-t3)/d,
q2=K1(t1-t2)/d1,
q3=K2(t2-t3)/d2.
Из каждого соотношения выразим изменение температур
(t1-t3)=qd/K1,
(t1–t2)=qd1/K1,
(t2-t3)=qd2/K2.
Складывая левые и правые части вышенаписанных формул, получим
2(t1-t3)=q(d/K1+d1/K1+d2/K2).
Подставим в последнее выражение значение q для однослойной стены и, преобразовав, имеем
d2=K2(d-d1)/K1.
Тогда общая толщина двухслойной стены будет равна:
d3=d1+d2=d1+K2(d-d1)/K1.
Подставив значения величин в единицах СИ, произведем вычисление
d3=0,3 м.
 Ответ: d3=0,3 м.
Ответ: d3=0,3 м.
73. Определить время подъема движущихся с постоянной скоростью пузырьков воздуха со дна водоема глубиной ℓ=1 м (рис. 3.15), если диаметры пузырьков соответственно равны 2 мм и 1 мм.
Решение. В рассматриваемом случае уравнение движения пузырьков имеет вид
ma=F+FA+Fс,
где m – масса пузырька;
a – его ускорение;
F=mg – сила тяжести;
FA – подъемная сила (сила Архимеда);
Fc – сила сопротивления (внутреннего трения).
Так как движение пузырька равномерное, то, очевидно, сила сопротивления движению уравновешивается подъемной силой; силой тяжести можно пренебречь, так как плотность воздуха во много раз меньше плотности воды. Предполагая, что пузырек имеет небольшой радиус и сферическую форму, то согласно закону Стокса, силу сопротивления движению можно определить по формуле:
Fс=6phr,
где h – коэффициент вязкости;
r – радиус пузырька;
v – его скорость.
Подъемая сила
FA=rogV=4pr3rog/3,
где ro – плотность воды;
g – ускорение силы тяжести.
Таким образом:
6phrv=4prrog/3,
или
6phrℓ/t=4prror3g/3,
где ℓ – путь, проходимый пузырьком;
t – время его движения.
Из последнего соотношения находим время движения пузырька
t=9hℓ/(2r2rog).
Подставив значения величин в единицах СИ, получим
t1=0,505 с; t2=2,02 с.
Ответ: t1=0,505 с; t2=2,02 с.
74. Чему равны при нормальных условиях коэффициенты диффузии и внутреннего трения азота, если эффективный диаметр молекулы азота d=3,1×10-10 м?
Решение. Из молекулярно кинетических представлений можно показать, что коэффициенты внутреннего трения и диффузии определяется соотношениями
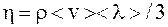 ;
;
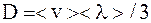 ,
,
где <v> – средняя арифметическая скорость молекул;
<λ> – их средняя длина свободного пробега;
ρ – плотность газа.
Средняя арифметическая скорость
 ,
,
где R – универсальная газовая постоянная;
Т – его абсолютная температура;
μ – молярная масса газа.
Средняя длина свободного пробега
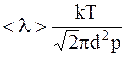 ,
,
где k – постоянная Больцмана;
d – эффективный диаметр молекулы;
p – давление газа.
Плотность газа можно определить воспользовавшись уравнением Менделеева-Клапейрона
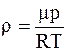 .
.
Подставив величины, входящие в вышенаписанные формулы в единицах СИ <v>=457 м/с; <λ>=8,72×10-8 м, ρ=1,25 кг/м3, получим
η=16,6×10-6 кг/(м×с); D=1,36×10-5 м2/с.
Ответ: η=16,6×10-6 кг/(м×с); D=1,36×10-5 м2/с.






