Wк=N<Wвр>=NkТ.
Число молекул определяется соотношением:

где m– молекулярная масса кислорода;
m – его масса;
NА – число Авогадро.
Таким образом:

Подставив численные значения, предварительно выразив их в системе СИ, будем иметь:
<Wвр>=1,38×10–23×350=4,83×10–21 Дж.
 Дж.
Дж.
Ответ: Wк=364 Дж.
16. Масса 10 г кислорода находится при давлении 304 кПа и температуре 10 oС. После расширения вследствие нагревания при постоянном давлении кислород занял объем 10 л. Найти объем газа до расширения, температуру газа после расширения, плотности газа до и после расширения.
Решение. Согласно условию задачи, расширение газа вследствие нагревания происходило при постоянном давлении. В этом случае оказывается справедливым соотношение
 .
.
Для определения температуры газа после расширения воспользуемся уравнением Менделеева-Клапейрона для конечного состояния газа
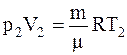 ,
,
где p2 – давление газа после расширения;
V2 – его объем после расширения;
m – масса газа;
m – молекулярная масса кислорода;
R – универсальная газовая постоянная;
T2 – абсолютная температура газа.
Следовательно, для конечной температуры имеем

Для определения объема газа до расширения можно вновь воспользоваться уравнением Менделеева-Клапейрона, записанным для первоначального состояния газа:

где p1, V1, T1 – его давление, объем и температура до расширения.
Из данного уравнения имеем
 .
.
Учитывая то, что плотность газа r1=m/V1, подставляя значения V1 и V2 из уравнений Менделеева-Клапейрона, записанные для соответствующих состояний, для плотности кислорода до и после расширения будем иметь
 и
и 
Подставляя численные значения в системе СИ, окончательно имеем
 ;
;
 л;
л;
r1= 4,14 кг/м3;
r2=1кг/м3.
Ответ:  ;
;  л; r1= 4,14 кг/м3; r2=1кг/м3.
л; r1= 4,14 кг/м3; r2=1кг/м3.
17. Масса газа 12 г занимает объем 4 л при температуре 7 oC После нагревания газа при постоянном давлении его плотность стала равной 0,6 кг/м3. До какой температуры нагрели газ?
Решение. Воспользовавшись уравнением Менделеева-Клапей-рона

можно показать, что между плотностью газа r=m/V и давлением существует связь

Следовательно, в начальном состоянии давление газа

В конечном

Так как нагревание газа производилось при постоянном давлении, то p1=p2

отсюда

Подставляя численные значения в системе СИ для конечной температуры, будем иметь:

Ответ: T2=1400 K.
18. В баллоне находилась масса m1=10 кг газа при давлении p1=10 МПа. Какую массу газа взяли из баллона, если давление стало равным p2=2,5 МПа? Температуру газа считать постоянной.
Решение. Запишем уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) для двух состояний: начального и конечного
 и
и 
Из второго соотношения определяем объем сосуда и подставляем его значение в первое уравнение, имеем:
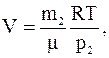 а
а 
Из последнего соотношения получаем связь между давлением газа в сосуде и его массой для данного случая:

Отсюда масса газа оставшегося в баллоне:
 .
.
Так как масса израсходованного газа Dm=m1–m2, то окончательно, после соответствующих преобразований, имеем

Подставляя численные значения (в системе СИ) определяем массу взятого из баллона газа:
 кг.
кг.
Ответ: Δm=7,5 кг.
19. В сосуде находится масса m1=14 г азота и масса m2=9 г водорода при температуре 10 oС и давлении 1 МПа. Найти молярную массу смеси и объем сосуда.
Решение. По закону Дальтона давление смеси газов равно сумме парциальных давлений компонентов входящих в смесь
p=p1+p2,
где p – давление смеси;
p1 – парциальное давление азота;
p2 – парциальное давление водорода.
Из уравнения Менделеева-Клапейрона:

Для каждого из давлений (смеси и парциальных) можно записать:
 ;
;
 ;
;
 .
.
Следовательно, так как p=p1+p2, имеем:
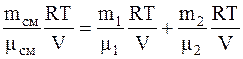 .
.
Откуда
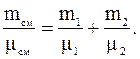
Из последнего соотношения для молекулярной массы смеси будем иметь:

Из уравнения Менделеева-Клапейрона, для смеси газов, объем сосуда равен:

Подставляя численные значения в системе СИ, находим молекулярную массу смеси:
 кг/кмоль.
кг/кмоль.
и объем сосуда
 м3.
м3.
Ответ: μсм=4,6 кг/кмоль; V=11,7×10-3 м3.
20. Для получения хорошего вакуума в стеклянном сосуде, для удаления адсорбированного газа, необходимо прогревать стенки сосуда при откачке. На сколько может повыситься давление в сферическом сосуде радиусом 10 см, если адсорбированные молекулы перейдут со стенок в сосуд? Площадь поперечного сечения молекул So=10–19 м2. Температура газа в сосуде 300 oС. Слой молекул на стенках считать мономолекулярным.
Решение. Для определения давления воспользуемся основным уравнением молекулярно–кинетической теории в виде
p=nokT,
где no – число молекул в единице объема;
k – постоянная Больцмана;
Т – абсолютная температура газа.
С учетом того, что
no=N/V,
где N – число молекул в объеме V, для давления имеем

По условию задачи слой молекул в сосуде мономолекулярный, следовательно, число молекул в нем можно определить исходя из соображений:
 ,
,
где S=4pr2 – площадь поверхности сосуда;
So – площадь поперечного сечения молекул газа.
Так как сосуд сферический, то его объем V=4/3pr3.
Таким образом, окончательно для давления газа в сосуде будем иметь соотношение:

Подставляя численные значения в полученное соотношение (в системе СИ) определяем давление газа в сосуде
 Па.
Па.
Ответ: p=2,4 Па.
21. В воздухе содержится 23,6% кислорода и 76,4% азота (по массе) при давлении 100 кПа и температуре 13 oС. Найти плотность воздуха и парциальные давления кислорода и азота.
Решение. Для определения плотности воздуха воспользуемся уравнениемМенделеева-Клапейрона

откуда
 а
а 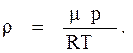
Для определения парциальных давлений так же воспользуемся уравнением Менделеева-Клапейрона, записанным для каждого из компонентов, входящих в смесь воздуха:


где V – объем воздуха.
Откуда


Так как r=m/V, то V=m/r, следовательно


Подставляя численные значения в системе СИ, для плотности воздуха и парциальных давлений кислорода и азота будем иметь:
 кг/м3;
кг/м3;
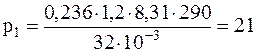 кПа;
кПа;
 кПа.
кПа.
Ответ: ρ=1,2 кг/м3; p1=21 кПа; p2=79 кПа.
22. В сосуде находится количество n=10–7 моль кислорода и масса m2=10–6 г азота. Температура смеси 100 oС, давление в сосуде p=133 мПа. Найти объем сосуда, парциальные давления кислорода и азота и число молекул в единице объема.
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, записанным для смеси газов в виде
 ,
,
где nсм=n1+n1=(n1+m2/m2) – число молей или киломолей газов составляющих смесь.
Имеем
pV=(n1+m2/m2)RT.
Отсюда
V=(n1+m2/m2)(RT/p).
Парциальные давления компонентов образующих смесь определяем так же из уравнения Менделеева-Клапейрона, записанным для каждого из газов
p1V=n1RT и p2V=(m2/m2)RT.
Откуда для парциальных давлений кислорода и азота соответственно имеем
p1=n1RT/V и p2=m2RT/m2V.
Для определения числа молекул в единице объема необходимо воспользоваться основным уравнением молекулярно – кинетической теории для давления
p=nokT.
Из него
no=p/kT.
Подставляя в ранее полученные формулы ы системе СИ для объема, парциальных давлений кислорода и азота и числа молекул в единице объема, имеем:
 м3;
м3;
 мПа;
мПа;
 мПа;
мПа;
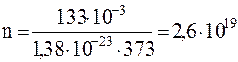 м-3.
м-3.
Ответ: V=3,2·10-3 м3; p1=98 мПа; p2=35 мПа; n=2,6·1019 м-3.
23. Один моль идеального 2–х атомного газа, занимает объем 12,3 л под давлением 2 ат. нагревается при постоянном объеме до давления 3 ат. Далее газ расширяется при постоянном давлении до объема 24,6 литра, после чего охлаждается при постоянном объеме до начального давления, и наконец, сжимается при постоянном давлении до начального объема. Определить температуру газа для характерных точек цикла (рис. 3.8).
Решение. Пусть V' – наименьший объем газа;
 V" – наибольший объем газа;
V" – наибольший объем газа;
p'– наименьшее давление газа;
p" – наибольшее давление газа;
T1, T2, T3, T4 – температуры газа в характерных точках.
Температуру T1 можно определить используя уравнение Менделеева-Клапейрона, записанном в виде:
 .
.
Откуда

Переход газа из состояния 1 в состояние 2 – изохорный, для которого справедливо соотношение:
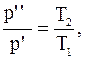
Следовательно,

Переход газа из состояния 2 в состояние 3 – изобарный, для которого справедливо соотношение:
 .
.
Откуда

Переход газа из состояния 3 в состояние 4 – изохорный, для которого справедливо соотношение

следовательно,

Подставляя численные значения из условия задачи, будем иметь:
 К;
К;
 К;
К;
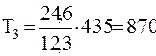 К;
К;
 К.
К.
Ответ: T1=290 К; T2=435 К; T3=870 К; T4=580 К.
24. Плотность смеси азота и водорода при температуре 47 oС и давлении p=2,00 ат равна=0,30 г/л. Найти концентрации молекул азота (n1) и водорода (n2) в смеси.
Решение. Концентрацию однородного по составу газа можно найти из формулы
p=nokT.
В условии задачи дана смесь двух газов, молекулы которых различаются по массе. Приведенная формула является следствием основного уравнения кинетической теории газов
p=(2/3)no<Wк>,
где no – число молекул в единице объема (концентрация молекул);
<Wк>=<mv2>/2 – средняя кинетическая энергия поступательного движения одной молекулы газа. Для однородных по составу частиц газа <Wк>=mv2/2.
Из основного уравнения кинетической теории газов вытекает, что оно справедливо для совокупности любых частиц, в том числе различных по массе. Следовательно, формулу p=nokT можно применять для смеси газов. В этом случае no – полное число частиц в единице объема. Таким образом, имеем
no=p/kT.
Для определения концентрации азота и водорода кроме очевидного соотношения
n1+n2=no=p/kT
необходимо иметь еще одно уравнение, связывающее величины n1 и n2.
Используя данные задачи, можно найти молярную массу смеси рассматриваемых газов (mсм), пользуясь уравнением Менделеева-Клапейрона
pV=mRT/mсм или p=rRT/mсм.
Откуда
mсм=rRT/p.
С другой стороны, можно выразить mсм через молярные массы азота (m1) и водорода (m2), а также их концентрации n1 и n2, записав уравнение газового состояния для каждого из газов входящих в смесь
pV=m×RT/mсм,
p1V=m1RT/m1,
p2V=m2RT/m2.
Откуда
p=m×RT/(mcмV),
p1=m1RT/(m1V),
p2=m2RT/(m2V).
На основании закона Дальтона, давление смеси газов равно сумме парциальных давлений
p=p1+p2.
Имеем
p=m1RT/ m1V+m2RT/m2V=(m1/m1+m2/m2)RT/V,
где (m1/m1+m2/m2)=(m1+m2)/mсм.
Для молярной массы смеси азота и водорода получаем
mсм=m1m2(m1+m2)/(m1m2+m2m1).
Заметим также, что между массой m газа и его концентрацией n существует связь:
m=nVm'=nVm/NА,
где V – объем газа;
m – его молярная масса;
m' – масса одной молекулы;
NА – число Авогадро.
С учетом последнего соотношения, для молярной массы смеси имеем:
mсм=(m1n1+m2n2)/(n1+n2).
Решив систему уравнений, найдем неизвестные n1 и n2:
n1=(rRT-pm2)/(kT(m1-m2)),
n2=(rRT-pm1)/(kT(m2-m1)).
Выражая входящие в формулы величины в единицах СИ, подставив их значения, выполнив вычисления, получим
n1=3,57×1024 м-3; n2=4,1×1025 м-3.
Ответ: n1=3,57×1024 м-3; n2=4,1×1025 м-3.
25. Средняя квадратичная скорость молекул некоторого газа 450 м/с. Давление газа 50 кПа. Найти плотность газа при этих условиях.
Решение. Средняя квадратичная скорость молекул газа связана с его температурой соотношением
 ,
,
где R – универсальная газовая постоянная;
μ – молекулярная масса газа;
T – абсолютная температура газа.
Для определения температуры газа воспользуемся уравнением Менделеева-Клапейрона

 ,
,
где r=m/V – плотность газа.
Следовательно,
 .
.
Откуда

Подставляя численные значения, имеем:
 кг/м3.
кг/м3.
Ответ: ρ=0,74 кг/м3.
26. Найти среднюю длину свободного пробега молекул воздуха при нормальных условиях. Эффективный диаметр молекул воздуха s=0,3 нм.
Решение. Средняя длина свободного пробега молекул газа
 ,
,
где <v> – средняя арифметическая скорость молекул;
<z> – среднее число столкновений каждой молекулы с остальными молекулами в единицу времени;
σ – эффективный диаметр молекулы;
n – число молекул в единице объема (концентрация молекул). Для определения числа молекул в единице объема воспользуемся основным уравнением молекулярно–кинетической теории для давления
p=nkT,
 ,
,
где k – постоянная Больцмана;
Т – температура газа.
Тогда для средней длины свободного пробега имеем
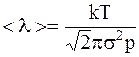 .
.
Подставляя численные значения, окончательно получаем:
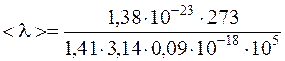 =93×10-9 м=93 нм.
=93×10-9 м=93 нм.
Ответ: <λ>=93 нм.
27. Найти среднее число столкновений в единицу времени молекул углекислого газа при температуре 100 oС, если средняя длина свободного пробега <l>=870 мкм.
Решение. Число столкновений молекул газа в единицу времени связано со средней длиной свободного пробега соотношением
 ,
,
где  – средняя арифметическая скорость.
– средняя арифметическая скорость.
Следовательно,
 .
.
Подставляя численные значения, имеем
 с-1.
с-1.
Ответ: <z>=4,9×105 с-1.
28. При некотором давлении и температуре 0 oС средняя длина свободного пробега молекул кислорода 95 нм. Найти среднее число столкновений в единицу времени молекул кислорода, если давление кислорода уменьшить в 100 раз.
Решение. Среднее число столкновений в единицу времени

где  – средняя арифметическая скорость молекул газа;
– средняя арифметическая скорость молекул газа;
<l> – средняя длина свободного пробега молекул.
При изменении давления газа длины свободного пробега обратно пропорциональны давлению:

где l1, l2 – длина свободного пробега молекул газа при соответствующих давлениях p1 и p2.
В нашем случае:
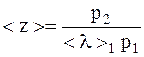
 .
.
Подставляя численные значения для <z>, имеем
 .
.
Ответ: <z>=4,5×107 с-1.
29. Какая часть молекул кислорода при t= 0 oС обладает скоростями от 100 до 110 м/с?
Решение. Согласно распределению молекул по скоростям (закону Максвелла)
 ,
,
где u=v/vв – относительная скорость;
v – данная скорость;
 – наиболее вероятная скорость молекул;
– наиболее вероятная скорость молекул;
Du – интервал относительных скоростей, малый по сравнению со скоростью u.
Тогда искомая часть молекул, которую необходимо определить
 .
.
В нашем случае v=100 м/с; Δv=10 м/с; наиболее вероятная скорость v=(2RT/pm)1/2=376 м/с. Следовательно, u=v/vв=100/376, u2=0,071; Du=10/376; exp(–u2)=0,93.
Тогда

Ответ:ΔN/N=0,4%.
30. Сосуд, содержащий газ, движется со скоростью vo, затем быстро останавливается. На сколько увеличится при этом средний квадрат скорости теплового движения молекул газа в случаях: одноатомного газа, двухатомного газа? Газ считать идеальным.
Решение. Воспользуемся законом сохранения энергии. Пусть M масса газа в сосуде. Двигаясь со скоростью v газ, как целое, обладает кинетической энергией
 .
.
Эта формула определяет кинетическую энергию направленного движения молекул, в котором они участвуют вместе с сосудом. После остановки сосуда направленное движение молекул в результате их соударений со стенками сосуда очень скоро превратится в хаотическое.
Пренебрегая теплообменом между газом и стенками сосуда за рассматриваемый промежуток времени, можно газ считать изолированной системой. Тогда из закона сохранения энергии следует, что «исчезнувшая» кинетическая энергия направленного движения молекул W должна быть равна приросту энергии хаотического движений молекул (приросту внутренней энергии DU):
Wк=DU.
Определим внутреннюю энергию газа. Для идеального одноатомного газа это есть энергия поступательного хаотического движения молекул:
 ,
,
где m – масса молекулы;
N – число молекул в сосуде.
Имеем

Отсюда следует, что изменение внутренней энергии одноатомного газа при торможении
DU=U2-U1= 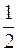 M[v2кв2-v2кв1],
M[v2кв2-v2кв1],
где vкв1,vкв2 – средние квадратичные скорости молекул газа соответственно в начале и конце торможения.
Подставив в уравнение Wк=DU значения Wк и DU, получим первый ответ
v2кв2–v2кв1=v02.
Внутренняя энергия идеального двухатомного газа складывается из энергий поступательного и вращательного движения молекул. При этом три степени свободы приходятся на поступательное движение и две – на вращательное. В соответствии с законом о равномерном распределении энергии по степеням свободы, три пятых кинетической энергии W пойдет на увеличение энергии поступательного движения молекул и две пятых – на увеличение энергии их вращательного движения. Таким образом, имеем:
 .
.
Из последнего соотношения получим второй ответ:
 .
.
Ответ: 1)  ;
;  .
.






