Краткая теория
Под теплоемкостью С понимают то количество тепла, которое надо сообщить телу, чтобы повысить его температуру на один градус Кельвина:
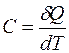 . (7.1)
. (7.1)
Если речь идет о передаче теплоты не всему телу, а одному килограмму, то говорят об удельной теплоемкости с=С/m (измеряется в Дж/(кг∙К)). Если речь идет о передаче теплоты одному молю вещества, то говорят о молярной теплоемкости Cµ = С/ν, измеряемой в Дж/(моль∙К).Связь между молярной (Cµ) и удельной (с) теплоемкостями газа:
 (7.2)
(7.2)
где M – молярная масса газа.
Молярные теплоемкости газа при постоянном объеме и постоянном давлении соответственно равны (здесь и далее в целях упрощения записи в индексах обозначений молярной теплоемкости при постоянном давлении и постоянном объеме букву «µ» будем опускать):
CV  , Cp
, Cp 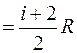 , (7.3)
, (7.3)
где i - число степеней свободы молекул газа; R= 8,31 Дж/(моль∙К) – универсальная газовая постоянная.
Уравнение Р. Майера
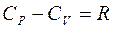 . (7.4)
. (7.4)
Показатель адиабаты
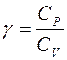 , или
, или  . (7.5)
. (7.5)
Внутренняя энергия идеального газа:
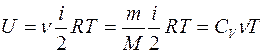 , (7.6)
, (7.6)
где Т – температура газа.
Политропическими называются процессы, при которых теплоемкость тела остается постоянной (С=const). Теплоемкость идеального газа при политропическом процессе:
 , (7.7)
, (7.7)
где n- показатель политропы. Изобарному процессу соответствует n=0, изотермическому n=1, изохорному n=  , адиабатному n=g.
, адиабатному n=g.
Внутренняя энергия реального газа
 . (7.8)
. (7.8)
где а – постоянная Ван-дер-Ваальса, Vm - молярный объем газа.
Работа, связанная с изменением объема газа, в общем случае вычисляется по формуле:
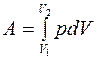 , (7.9)
, (7.9)
где V1 – начальный объем газа; V2 – его конечный объем, δA=pdV – элементарнаяработа газа при малом изменении объема dV.
Работа газа при изобарном процессе (p = const)
 , или
, или 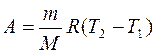 ; (7.10)
; (7.10)
при изотермическом процессе (Т = const)
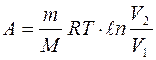 , или
, или  ; (7.11)
; (7.11)
при адиабатном процессе (адиабатным называется процесс, происходящий без обмена теплотой с окружающей средой)
 , или
, или 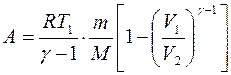 , (7.12)
, (7.12)
где Т1 – начальная температура газа; Т2 – его конечная температура.
Уравнение Пуассона (уравнение газового состояния при адиабатном процессе):
 ,
,  ,
,  . (7.13)
. (7.13)
Первое начало термодинамики:
 , (7.14)
, (7.14)
где Q – количество теплоты, сообщенное системе или отданное ею; 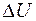 - изменение ее внутренней энергии; A – работа системы против внешних сил.
- изменение ее внутренней энергии; A – работа системы против внешних сил.
Первое начало термодинамики для малого изменения системы:
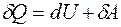 . (7.15)
. (7.15)
Первое начало термодинамики при изобарном процессе

 , (7.16)
, (7.16)
при изохорном процессе (А=0)
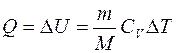
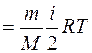 , (7.17)
, (7.17)
при изотермическом процессе ( )
)
 , (7.18)
, (7.18)
при адиабатном процессе (Q=0)
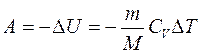
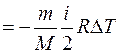 . (7.19)
. (7.19)
Вопросы для самоподготовки
1. Дайте определение теплоемкости тела, удельной и молярной теплоемкости вещества.
2. Как связаны между собой молярные теплоемкости при постоянном объеме и при постоянном давлении?
3. На рисунке схематически представлена температурная зависимость молярной теплоемкости при постоянном объеме CV от температуры T для двухатомного газа. Назовите, какими степенями свободы обладают молекулы газа на участках 1-1/, 2-2/, 3-3/. Почему на участках 1/-2, 2/-3 молярная теплоемкость газа изменяется?
|

4. Дайте определение внутренней энергии.
5. Получите формулу (7.6) для внутренней энергии идеального газа.
6. Какой процесс называется адиабатным? Приведите примеры такого процесса.
7. Из уравнения Пуассона, связывающего давление и объем  , и уравнения Клапейрона pV/T=const получите другие уравнения связи параметров состояния газа при адиабатном процессе
, и уравнения Клапейрона pV/T=const получите другие уравнения связи параметров состояния газа при адиабатном процессе  и
и  .
.
8. Сформулируйте первое начало термодинамики.
9. Примените первое начало термодинамики к изотермическому, изобарному, изохорному и адиабатному процессам.
10. Получите формулы для работы газа при изотермическом, изобарном и адиабатном процессах.
Примеры решения задач
7.1. Двухатомный идеальный газ, занимавший при давлении  объем V1= 4л, расширяют до объема V2= 6л, при этом давление падает до значения р2= 105 Па. Процесс происходит сначала по адиабате, затем по изохоре. Определить работу газа, количество поглощенной теплоты и изменение внутренней энергии газа при этом переходе.
объем V1= 4л, расширяют до объема V2= 6л, при этом давление падает до значения р2= 105 Па. Процесс происходит сначала по адиабате, затем по изохоре. Определить работу газа, количество поглощенной теплоты и изменение внутренней энергии газа при этом переходе.
Дано: Найти:
 , 1. А 12,
, 1. А 12,
V1= 4л = 4∙10-3 м3, 2. Q 12,
V2= 6л=6∙10-3 м3, 3.Δ U 12.
р2= 105 Па.
Решение:
Газ участвует в двух процессах: а) адиабатное расширение из состояния 1 в некоторое состояние B, в котором объем VB=V2, давление pB неизвестно; б) изохорный переход из состояния B в состояние 2. Чтобы определить характер изохорного процесса – нагревание или охлаждение, - надо найти промежуточное значение давления pB. Согласно уравнению Пуассона для адиабатного процесса (7.13)
 . (1)
. (1)
Газ двухатомный (число степеней свободы его молекулы i=5), следовательно, показатель адиабаты 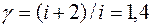 . С учетом этого уравнение (1) примет вид:
. С учетом этого уравнение (1) примет вид:
 . (2)
. (2)
 |
Неравенство (2) показывает, что при изохорном переходе из состояния B в состояние 2 давление газа уменьшается (рисунок 7.2) и, следовательно, процесс B-2 есть процесс изохорного охлаждения (p/T=const при V=const). Чтобы найти работу А12 и количество поглощенной теплоты Q12 при переходе из состояния 1 в 2, надо рассмотреть каждый из указанных процессов отдельно:
A12=A1B+AB2, Q12=Q1B+QB2. (3)
Работа газа при адиабатном процессе:
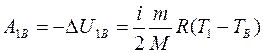 . (4)
. (4)
Уравнение Клапейрона - Менделеева для состояний 1 и В соответственно имеет вид:
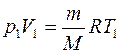 ,
,  . (5)
. (5)
Подставим уравнения (5) в (4) и найдем работу газа на участке 1В:
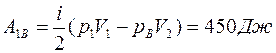 . (6)
. (6)
Учитывая, что 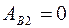 , можно получить
, можно получить 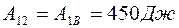 .
.
На участке 1-В количество поглощенной теплоты Q1B=0. На участке В-2 количество поглощенной теплоты можно найти из первого начала термодинамики для изохорного процесса:
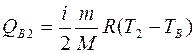 . (7)
. (7)
Подставляя уравнение Клапейрона - Менделеева для состояний В и 2 соответственно
 ,
, 
в выражение (7), можно получить:
 . (8)
. (8)
Поскольку 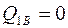 , общее количество теплоты
, общее количество теплоты 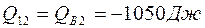 . Знак минус показывает, что газ отдавал теплоту окружающим телам.
. Знак минус показывает, что газ отдавал теплоту окружающим телам.
Изменение внутренней энергии не зависит от процесса и может быть определено по формуле (7.6), с использованием уравнения Клапейрона-Менделеева для состояний 1 и 2:
 .
.
Ответ: 1.  ,
,
2. 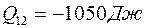 ,
,
3. 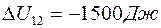 .
.
7.2. Один моль идеального одноатомного газа нагревают от температуры Т1= 150 К до Т2= 400 К так, что в процессе нагрева р/V=const. Определить молярную теплоемкость и рассчитать количество теплоты, поглощенное газом при нагревании.
Дано: Найти:
 , 1. C,
, 1. C,
Т1= 150 К, 2. Q.
Т2= 400 К,
р/V=const.
Решение:
Запишем первое начало термодинамики в дифференциальной форме (7.15) для количества теплоты, поглощенного газом при нагревании:
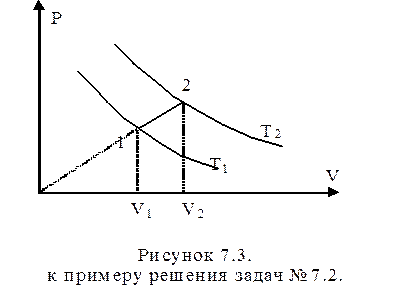
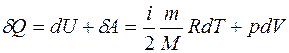 . (1)
. (1)
С другой стороны, по формуле для количества теплоты, переданного системе (7.1):
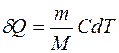 , (2)
, (2)
где С – молярная теплоемкость газа.
Приравнивая правые части выражений (1) и (2), получим выражение для молярной теплоемкости газа:
 . (3)
. (3)
Подставив выражение для давления, полученное из уравнения Клапейрона-Менделеева p=mRT/MV, поочередно в (3) и в уравнение процесса p/V=const, можно получить соответственно:
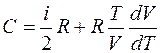 , (4)
, (4)
 . (5)
. (5)
Чтобы найти dV/dT, продифференцируем выражение (5) по переменной T:
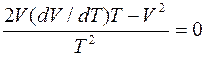 ,
,
откуда
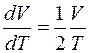 . (6)
. (6)
Подставив выражение (6) в (4), получим:
 . (7)
. (7)
Рассматриваемый газ – одноатомный (i=3). Тогда  . Из формулы (7.1) найдем количество теплоты, поглощенное газом при нагревании:
. Из формулы (7.1) найдем количество теплоты, поглощенное газом при нагревании:
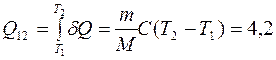 кДж.
кДж.
Ответ: 1.  ,
,
2. Q12= 4,2 кДж.
7.3. Найти работу, совершаемую одним молем ван-дер-ваальсовского газа при изотермическом расширении его от объема V1 до V2 при температуре T.
Дано: Найти:
 ,
,  .
.
V1,
V2,
T=const.
Решение:
Давление реального газа можно выразить из уравнения Ван-дер-Ваальса для одного моля газа:
 . (1)
. (1)
Подставив в формулу (7.9) выражение (1), можно найти работу, совершаемую одним молем ван-дер-ваальсовского газа при изотермическом расширении:
 . (2)
. (2)
После интегрирования получаем:
 .
.
Ответ:  .
.






