—ульф≥дна система анал≥зу кат≥он≥в Ї класичною. ¬она базуЇтьс€ на розд≥ленн≥ найб≥льш поширених кат≥он≥в шл€хом переведенн€ њх в осади у вигл€д≥ сульф≥д≥в, хлорид≥в та карбонат≥в. «а ц≥Їю системою кат≥они под≥л€ють на пТ€ть анал≥тичних груп.
јнал≥тичною групою називаЇтьс€ така група йон≥в, €ка може бути в≥докремлена в≥д ≥нших д≥Їю певного реагенту, з €ким ц€ група йон≥в реагуЇ однотипно. ј такий реагент, сп≥льний дл€ даноњ групи йон≥в, називаЇтьс€ груповим реагентом.
«а ц≥Їю системою до першоњ анал≥тичноњ групи кат≥он≥в в≥днос€ть кат≥они Na+, K+, NH4+, Mg2+. ÷€ група не маЇ групового реагенту. ожен кат≥он ц≥Їњ групи ви€вл€Їтьс€ своњми характерними реакц≥€ми, €к≥ виконуютьс€ в певн≥й посл≥довност≥.
ƒо другоњ анал≥тичноњ групи в≥днос€ть кат≥они Ba2+, Sr2+, Ca2+. √руповим реагентом ц≥Їњ групи кат≥он≥в Ї амон≥й карбонат (NH4)2CO3 в амон≥ачному буферному розчин≥ (NH3ЈH2ќ+NH4Cl). ѕри д≥њ групового реагенту кат≥они другоњ анал≥тичноњ групи осаджуютьс€ у вигл€д≥ малорозчинних у вод≥ карбонат≥в.
ƒ–(BaCO3)=4,0Ј10Ц10; ƒ–(SrCO3)=1,1Ј10Ц10; ƒ–(CaCO3)=3,8Ј10Ц9.
ат≥они ц≥Їњ анал≥тичноњ групи не осаджуютьс€ амон≥й сульф≥дом чи сульф≥дною кислотою, оск≥льки сульф≥ди цих елемент≥в у водному розчин≥ повн≥стю г≥дрол≥зуютьс€. √≥дрол≥з в≥дбуваЇтьс€ €к за кат≥оном, так ≥ за ан≥оном:
MeS + 2HOH 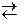 Me(OH)2 + H2S.
Me(OH)2 + H2S.
√≥дроксиди цих метал≥в досить добре розчинн≥ у вод≥, особливо г≥дроксид Ba(OH)2, розчин €кого Ї лугом.
ƒо третьоњ анал≥тичноњ групи в≥днос€ть кат≥они Al3+, Cr3+, Fe3+, Fe2+, Ni2+, Co2+, Mn2+, Zn2+ та ≥н.
√руповим реагентом ц≥Їњ анал≥тичноњ групи Ї розчин (NH4)2S. ¬ нейтральному чи лужному середовищ≥ (рЌ=7-9) при д≥њ групового реагенту випадають в осад малорозчинн≥ у вод≥ сульф≥ди чи г≥дроксиди цих метал≥в:
| ƒ–(Al(OH)3)=3,2Ј10Ц34 | ƒ–(Fe2S3)≈1Ј10Ц88 |
| ƒ–(Cr(OH)3)=6,3Ј10Ц31 | ƒ–(FeS)=5,0Ј10Ц18 |
| ƒ–(Fe(OH)3)=6,3Ј10Ц38 | ƒ–(NiS)=3,2Ј10Ц19 |
| ƒ–(Fe(OH)2)=7,2Ј10Ц16 | ƒ–(β-CoS)=1,9Ј10Ц27 |
| ƒ–(Ni(OH)2)=2,0Ј10Ц15 | ƒ–(MnS)=2,5Ј10Ц10 |
| ƒ–(Co(OH)2)=4,0Ј10Ц45 | ƒ–(ZnS)=1,6Ј10Ц24 |
| ƒ–(Mn(OH)2)=1,9Ј10Ц13 | |
| ƒ–(Zn(OH)2)=1,4Ј10Ц17 |
√≥дроксиди Fe(OH)3, Fe(OH)2, Ni(OH)2, Co(OH)2, Mn(OH)2, Zn(OH)2 за даних умов практично не утворюютьс€, оск≥льки сульф≥ди цих метал≥в мають меншу розчинн≥сть, н≥ж г≥дроксиди, ≥ реакц≥€ йде з утворенн€м сульф≥д≥в ‘еруму, Ќ≥колу, обальту, ћангану, ÷инку.
ат≥они третьоњ анал≥тичноњ групи не осаджуютьс€ г≥дроген сульф≥дом з кислих розчин≥в у вигл€д≥ сульф≥д≥в.
ƒо четвертоњ анал≥тичноњ групи в≥днос€ть йони Cu2+, Cd2+, Hg2+, Bi3+, As3+, AsV, SbV, Sb3+, Sn2+, SnIV та ≥нш≥. √руповим реагентом кат≥он≥в ц≥Їњ анал≥тичноњ групи Ї розчин H2S у присутност≥ хлоридноњ кислоти. ” кислому середовищ≥ при рЌ=0,5 кат≥они четвертоњ анал≥тичноњ групи осаджуютьс€ при д≥њ групового реагенту у вигл€д≥ практично нерозчинних у вод≥ ≥ м≥неральних кислотах сульф≥д≥в:
ƒ–(CuS)=6,3Ј10Ц36; ƒ–(CdS)=1,6Ј10Ц28; ƒ–(HgS)=1,6Ј10Ц52; ƒ–(Bi2S3)=1,0Ј10Ц9; ƒ–(SnS)=2,5Ј10Ц27.
—ульф≥ди CuS, CdS, Bi2S3, HgS не розчин€ютьс€ у розчин≥ натр≥й сульф≥ду та в розчин≥ амон≥й пол≥сульф≥ду (NH4)2Sx. —ульф≥ди As2S3, Sb2S3, SnS та де€к≥ ≥нш≥ добре розчин€ютьс€ у розчин≥ натр≥й сульф≥ду з утворенн€м т≥осолей.
|
|
|
“≥осол≥ €вл€ють собою сол≥ в≥дпов≥дних т≥окислот, €к≥ утворюютьс€ при зам≥щенн≥ атом≥в ќксигену в оксигенвм≥сних кислотах на атоми —ульфуру.
Ќаприклад:
SnS2 + Na2S 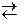 Na2SnS3;
Na2SnS3;
натр≥й т≥останат
Sb2S3 + 3Na2S 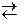 2Na3SbS3.
2Na3SbS3.
натр≥й т≥остиб≥т
“≥осол≥ добре розчинн≥ у вод≥, тому легко в≥дд≥л€ютьс€ в≥д осаду сульф≥д≥в упруму, адм≥ю, ћеркур≥ю, Ѕ≥смуту.
ƒо пТ€тоњ анал≥тичноњ групи в≥днос€ть кат≥они Ag+, Hg22+, Pb2+ та ≥нш≥. √руповим реагентом на кат≥они ц≥Їњ групи Ї розчин хлоридноњ кислоти мол€рноњ концентрац≥њ екв≥валента 2моль/дм3. ѕри д≥њ групового реагенту на кат≥они пТ€тоњ анал≥тичноњ групи утворюютьс€ малорозчинн≥ у вод≥ ≥ в розведених кислотах в≥дпов≥дн≥ хлориди:
ƒ–(AgCl)=1,78Ј10Ц10; ƒ–(Hg2Cl2)=1,33Ј10Ц18; ƒ–(PbCl2)=1,6Ј10Ц5.
—истематичний х≥д анал≥зу кат≥он≥в за сульф≥дною системою починаЇтьс€ з осадженн€ кат≥он≥в пТ€тоњ анал≥тичноњ групи розчином хлоридноњ кислоти (с( )=2моль/дм3) з наступним в≥дд≥ленн€м осаду хлорид≥в цих елемент≥в.
)=2моль/дм3) з наступним в≥дд≥ленн€м осаду хлорид≥в цих елемент≥в.
ѕот≥м осаджуЇтьс€ четверта анал≥тична група кат≥он≥в д≥Їю розчином сульф≥дноњ кислоти у присутност≥ хлоридноњ кислоти. ќсад сульф≥д≥в в≥дд≥л€ють в≥д розчину ≥ анал≥зують.
ѕ≥сл€ в≥дд≥ленн€ кат≥он≥в пТ€тоњ та четвертоњ анал≥тичних груп, д≥ють розчином амон≥й сульф≥ду в амон≥ачному буферному розчин≥ при рЌ=7-9. ќсад г≥дроксид≥в та сульф≥д≥в кат≥он≥в третьоњ анал≥тичноњ групи в≥дд≥л€ють в≥д розчину, а пот≥м анал≥зують.
–озчин солей кат≥он≥в першоњ та другоњ анал≥тичних груп випарюють при додаванн≥ оцтовоњ кислоти. ѕри цьому амон≥й сульф≥д ((NH4)2S) розкладаЇтьс€, а надлишок солей амон≥ю видал€ють. ѕот≥м кат≥они другоњ анал≥тичноњ групи осаджують д≥ючи розчином амон≥й карбонату у присутност≥ амон≥ачного буфера. ќсад карбонат≥в кат≥он≥в другоњ анал≥тичноњ групи в≥дд≥л€ють в≥д розчину та анал≥зують, а в розчин≥ ви€вл€ють кат≥они першоњ анал≥тичноњ групи.
—ульф≥дна система анал≥зу кат≥он≥в застосовуЇтьс€ вже дуже давно. ¬она маЇ багато переваг над ≥ншими системами анал≥зу кат≥он≥в, проте Ї ≥ суттЇв≥ недол≥ки. —еред них сл≥д в≥дм≥тити наступн≥:
Ц розчинн≥сть сульф≥д≥в де€ких кат≥он≥в третьоњ та четвертоњ анал≥тичних груп маЇ близьк≥ значенн€, тому розд≥ленн€ кат≥он≥в Ї неповним;
Ц осадженн€ сульф≥д≥в четвертоњ групи часто супроводжуЇтьс€ сп≥восадженн€м кат≥он≥в третьоњ групи;
Ц внасл≥док проходженн€ через багато стад≥й у к≥нцевому розчин≥ вм≥ст кат≥он≥в першоњ анал≥тичноњ групи стаЇ дуже низьким, що викликаЇ труднощ≥ њх ви€вленн€;
Ц дл€ проведенн€ повного анал≥зу витрачаЇтьс€ багато часу
(до 25-30 годин);
Ц у метод≥ застосовуЇтьс€ отруйний г≥дроген сульф≥д та сульф≥ди, що вимагаЇ спец≥альних умов техн≥ки безпеки при проведенн≥ анал≥з≥в.






