≈лектронна будова кат≥он≥в першоњ анал≥тичноњ групи наступна: Na+ − [Ne]; K+ − [Ar].
4.1.1. –еакц≥њ ви€вленн€ кат≥он≥в Na+
ƒосл≥д 1. ѕри д≥њ на розчин, що м≥стить кат≥они Na+, розчином кал≥й диг≥дроантимонату утворюЇтьс€ б≥лий кристал≥чний осад натр≥й диг≥дроантимонату:
Na+ + KH2SbO4 → NaH2SbO4↓ + K+;
Na+ + H2SbO4− → NaH2SbO4↓.
ƒл€ проведенн€ ц≥Їњ реакц≥њ у проб≥рку внос€ть 5-6 крапель розчину сол≥ Ќатр≥ю ≥ додають ст≥льки ж розчину KH2SbO4.
–еакц≥€ дуже малочутлива. ќсад €к такий майже не утворюЇтьс€. —постер≥гаЇтьс€ лише помутн≥нн€ вм≥сту проб≥рки ≥ лише тод≥, коли потерти скл€ною паличкою внутр≥шн≥ ст≥нки проб≥рки дл€ того, щоб створити центри кристал≥зац≥њ NaH2SbO4. –озчин дл€ ви€вленн€ йон≥в Na+ повинен м≥стити значну к≥льк≥сть цих йон≥в, а середовище маЇ бути нейтральним чи слабколужним. ” кислому середовищ≥ KH2SbO4 перетворюЇтьс€ у малорозчинну метастиб≥йну кислоту, що €вл€Ї собою аморфний осад б≥лого кольору:
KH2SbO4.+ Ќ+→ H3SbO4 + K+;
H3SbO4 → HSbO3↓ + Ќ2ќ.
якщо йони Na+ визначати цим реагентом у кислому середовищ≥, то по€ва б≥лого аморфного осаду ще не св≥дчить про на€вн≥сть у розчин≥ йон≥в Na+.
ƒл€ покращенн€ утворенн€ осаду NaH2SbO4 реакц≥ю потр≥бно проводити при охолодженн≥.
ƒосл≥д 2. ѕ≥рох≥м≥чна реакц≥€ ви€вленн€ йон≥в Na+
ѕлатинову чи н≥хромову дротинку, на к≥нц≥ €коњ Ї петл€, занурюють у розчин, що м≥стить йони Na+, чи на петлю набирають сухоњ речовини, а пот≥м внос€ть у безбарвне полумТ€ пальника. ѕолумТ€ пальника за на€вност≥ сполук Ќатр≥ю забарвлюЇтьс€ в жовтий кол≥р. –еакц≥€ дуже чутлива, але у присутност≥ у досл≥джуваному середовищ≥ ≥нших йон≥в забарвленн€ полумТ€ може спотворюватись. “ому п≥рох≥м≥чний спос≥б ви€вленн€ йон≥в Na+ не можна вважати ц≥лком достов≥рним.
ƒосл≥д 3. Ќайб≥льш специф≥чною реакц≥Їю ви€вленн€ йон≥в Na+ Ї м≥крокристалоскоп≥чна реакц≥€ з цинк-уран≥л ацетатом.
Ќа предметне скло м≥кроскопа нанос€ть краплю розчину, що м≥стить йони Na+. ќбережно випарюють краплину досуха над полумТ€м пальника. ѕ≥сл€ охолодженн€ на м≥сце сухого залишку нанос€ть краплю розчину цинк-уран≥л ацетату Zn(UO2)3(CH3COO)8. ”творюютьс€ правильн≥ кристали тетраедричноњ чи октаедричноњ форми бл≥до-жовтого кольору натр≥й-цинк-уран≥л ацетату NaZn(UO2)3(CH3COO)9∙9Ќ2ќ.
якщо на предметному скл≥ ви€витьс€ товстий шар кристал≥в, то значну частину њх змивають водою, залишивши лише дуже малу к≥льк≥сть њх. –озгл€дають п≥д м≥кроскопом форму та забарвленн€ кристал≥в натр≥й-цинк-уран≥л ацетату. …они Na+ за ц≥Їю реакц≥Їю краще ви€вл€ти з розведених розчин≥в. «аважають ви€вленню Na+ кат≥они Ag+ та йони Sb3+ ≥ ан≥они AsO43Ц, €к≥ з
цинк-уран≥л ацетатом утворюють осади, аналог≥чн≥ €к з кат≥оном Na+.

4.1.2. –еакц≥њ ви€вленн€ кат≥он≥в +
ƒосл≥д 1. …они + з г≥дротартрат-ан≥онами з сол≥ NaHC4H4O6 утворюють б≥лий кристал≥чний осад кал≥й г≥дротартрату:
K+ + HC4H4O6− → KHC4H4O6↓.
ƒл€ проведенн€ ц≥Їњ реакц≥њ у проб≥рку внос€ть 5-6 крапель розчину сол≥ ал≥ю ≥ додають такий же обТЇм розчину г≥дротартрату. ¬м≥ст проб≥рки перем≥шують скл€ною паличкою, потираючи нею внутр≥шн≥ ст≥нки проб≥рки. ¬ипадаЇ б≥лий кристал≥чний осад кал≥й г≥дротартрату. ÷€ реакц≥€ дуже малочутлива ≥ не специф≥чна. ƒл€ ви€вленн€ йон≥в + за ц≥Їю реакц≥Їю необх≥дна значна концентрац≥€ њх у досл≥джуваному розчин≥. ћала чутлив≥сть реакц≥њ по€снюЇтьс€ досить значною розчинн≥стю кал≥й г≥дротартрату. ƒ–(KHC4H4O6)=3,4∙10Ц4.
|
|
|
ƒл€ проведенн€ реакц≥њ зам≥сть NaHC4H4O6 можна брати винну кислоту. якщо осад не випадаЇ, то треба знизити концентрац≥ю г≥дроген-≥он≥в шл€хом додаванн€ розчину натр≥й ацетату.
ѕеред проведенн€м реакц≥њ осадженн€ йон≥в + у вигл€д≥ KHC4H4O6 попередньо необх≥дно видалити з розчину йони амон≥ю, оск≥льки NH4+ з ан≥онами HC4H4O6− утворюють под≥бний осад NH4HC4H4O6.
ќсад кал≥й г≥дротартрату розчин€Їтьс€ €к в концентрованих розчинах луг≥в, так ≥ концентрованих кислот, оск≥льки в кислому середовищ≥ утворюЇтьс€ добре розчинна у вод≥ винна кислота:
| KHC4H4O6 + Ќ+ → | 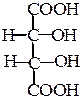
| + K+ |
онстанта дисоц≥ац≥њ винноњ кислоти 1=1,0∙10Ц3; 2=4,6∙10Ц10.
” лужному середовищ≥ утворюЇтьс€ середн€ розчинна у вод≥ с≥ль винноњ кислоти:
| KHC4H4O6 + NaOH → | 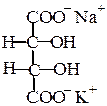
| + H2O. |
| сегнетова с≥ль |
ѕри нагр≥ванн≥ осад KHC4H4O6 теж розчин€Їтьс€, а також розчин€Їтьс€ при додаванн≥ до осаду значноњ к≥лькост≥ холодноњ води.
ƒосл≥д 2. Ѕ≥льш чутливою реакц≥Їю на кат≥они + Ї взаЇмод≥€ њх з розчином натр≥й гексан≥тро(≤≤≤) кобальтатом:
2 + + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2Na+.
”творюЇтьс€ оранжево-жовтий осад комплексноњ сол≥
натр≥й-кал≥й гексан≥тро(≤≤≤) кобальтату, €кий розчинний в сильних кислотах. ” лужному середовищ≥ в≥дбуваЇтьс€ руйнуванн€ комплексноњ сол≥ Na3[Co(NO2)6] ≥ утворюЇтьс€ темно-бурий осад Co(OH)3.
—л≥д мати на уваз≥, що Na3[Co(NO2)6] швидко розкладаЇтьс€ при збер≥ганн≥, тому дл€ проведенн€ реакц≥њ ви€вленн€ йон≥в + сл≥д користуватись св≥жоприготовленим розчином цього реагенту. якщо розчин реагенту маЇ рожеве забарвленн€, то такий розчин вже не придатний дл€ анал≥зу.
–еагент також розкладаЇтьс€ у лужному та дуже кислому середовищах.
јналог≥чну реакц≥ю з Na3[Co(NO2)6] дають також йони NH4+.
2NH4+ + Na3[Co(NO2)6] → (NH4)2Na[Co(NO2)6]↓ + 2Na+.
”творюЇтьс€ оранжево-червоне забарвленн€ розчину. ќсаду (NH4)2Na[Co(NO2)6] утворюЇтьс€ значно менше, н≥ж осаду K2Na[Co(NO2)6] ≥ забарвленн€ його Ї б≥льш темним.
ƒосл≥д 3. ћ≥крокристалоскоп≥чна реакц≥€ ви€вленн€ йон≥в +
« кат≥онами + натр≥й-плюмбум гаксан≥тро(≤≤) купрат Na2Pb[Cu(NO2)6] утворюЇ куб≥чн≥ кристали чорного чи коричневого кольору кал≥й-плюмбум гексан≥тро(≤≤) купрату:
2 + + Pb2+ + [Cu(NO2)6]4Ц → K2Pb[Cu(NO2)6]↓.
ƒл€ проведенн€ ц≥Їњ реакц≥њ краплю розчину, що м≥стить йони +, нанос€ть на предметне скло м≥кроскопа ≥ випарюють њњ над полумТ€м пальника. ѕ≥сл€ охолодженн€ скла на сухий залишок нанос€ть краплю розчину натр≥й-плюмбум гаксан≥тро(≤≤) купрату. ”творюютьс€ характерн≥ куб≥чн≥ кристали. –еакц≥ю провод€ть у середовищ≥ рЌ=6-7.
¬и€вленню йон≥в + за ц≥Їю реакц≥Їю заважають йони амон≥ю.
–еагент з йонами NH4+ утворюЇ аналог≥чн≥ кристали
амон≥й-плюмбум гексан≥тро(≤≤) купрату:
2NH4+ + Pb2+ + [Cu(NO2)6]4Ц → (NH4)2Pb[Cu(NO2)6]↓.
–ис. Е ристали кал≥й-плюмбум гексан≥тро(II) купрату
|
|
|
ƒосл≥д 4. ѕ≥рох≥м≥чна реакц≥€ ви€вленн€ йон≥в +
ѕлатинову чи н≥хромову дротинку з к≥льцем на к≥нц≥ змочують хлоридною кислотою та прожарюють у полумТњ пальника дл€ видаленн€ сл≥д≥в солей до повного зникненн€ забарвленн€ полумТ€. –озжареною дротинкою торкаютьс€ кристал≥в сол≥ кал≥ю. ристалики сол≥, €к≥ прилипли до дротинки, внос€ть у безбарвну частину полумТ€ пальника. ѕолумТ€ забарвлюЇтьс€ у бл≥до-ф≥олетовий кол≥р. «абарвленн€ полумТ€ краще спостер≥гати кр≥зь синЇ скло дл€ поглинанн€ жовтих промен≥в, обумовлених йонами Ќатр≥ю.
4.1.3. –еакц≥њ ви€вленн€ кат≥он≥в NH4+
ƒосл≥д 1. ѕри д≥њ луг≥в на середовище, що м≥стить йони NH4+, вид≥л€Їтьс€ амон≥ак: NH4+ + ќЌ− → NH3↑ + Ќ2ќ, €кий можна ви€вити за допомогою ун≥версального ≥ндикаторного паперу.
ƒл€ проведенн€ цього досл≥ду у проб≥рку внос€ть дек≥лька крапель розчину, що м≥стить йони NH4+, додають такий же обТЇм концентрованого розчину лугу ≥ нагр≥вають. Ќад отвором проб≥рки тримають змочену водою смужку ун≥версального ≥ндикаторного паперу. «а на€вност≥ амон≥аку ≥ндикаторний пап≥р набуваЇ синього забарвленн€.
ƒосл≥д 2. ¬и€вленн€ йон≥в NH4+ з реактивом Ќеслера
–еактив Ќеслера Ї сум≥шшю комплексноњ сол≥ K2[HgI4] з ќЌ.
ѕри взаЇмод≥њ цього реактиву з с≥ллю амон≥ю утворюЇтьс€ нерозчинна комплексна сполука червоно-бурого кольору:
| NH4Cl + 2K2[HgI4] + 4KOH → | 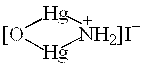
| + KCl + 7KI +3H2O; |
NH4+ + 2[HgI4]2Ц + 4OHЦ → [OHg2NH2]I↓ + 7IЦ +3H2O.
” проб≥рку внос€ть 3-4 крапл≥ розчину, що м≥стить йони NH4+, додають таку ж к≥льк≥сть або трохи б≥льше реактиву Ќеслера. ѕри цьому випадаЇ осад червоно-бурого забарвленн€. –еакц≥€ Ї дуже чутливою. ”творений осад розчин€Їтьс€ в сол€х амон≥ю, тому реактив Ќеслера маЇ бути у надлишку.
¬и€вленню йон≥в NH4+ за ц≥Їю реакц≥Їю заважають йони Fe3+, Cr3+, Co2+, Ni2+ та ≥нш≥, €к≥ з реактивом Ќеслера утворюють осади р≥зного забарвленн€. ƒл€ маскуванн€ йон≥в, що заважають, додають розчин кал≥й-натр≥й тартрату KNaC4H4O6, €кий звТ€зуЇ ц≥ йони у комплексн≥ сполуки.
¬и€вленн€ йон≥в NH4+ реактивом Ќеслера краще проводити в газов≥й фаз≥. ƒл€ цього досл≥джуваний на йони NH4+ розчин внос€ть у проб≥рку, додають дек≥лька крапель концентрованого розчину лугу. Ќад отвором проб≥рки тримають смужку ф≥льтрувального паперу, змоченого реактивом Ќеслера. —ум≥ш у проб≥рц≥ нагр≥вають. јмон≥ак, що при цьому вид≥л€Їтьс€, реагуЇ з реактивом Ќеслера ≥ смужка паперу набуваЇ цегл€но-червоного забарвленн€.
ƒосл≥д 3. …они амон≥ю утворюють з натр≥й г≥дротартратом чи винною кислотою осад амон≥й г≥фдротартрату, схожий на осад KЌC4H4O6, про що вже було зазначено вище.
ƒосл≥д 4. як вже зазначалос€, йони NH4+ утворюють з натр≥й-плюмбум гексан≥тро(≤≤) купратом куб≥чн≥ кристали чорного кольору (NH4)2Pb[Cu(NO2)6] схож≥ на кристали K2Pb[Cu(NO2)6].
ƒосл≥д 5. як ≥ йони +, йони NH4+ утворюють з Na3[Co(NO2)6] схожий оранжевий осад (NH4)2Na[Co(NO2)6].
ƒосл≥д 6. —ол≥ амон≥ю терм≥чно нест≥йк≥. “ак, амон≥й г≥дрокарбонат NH4HCO3 пом≥тно розкладаЇтьс€ вже при к≥мнатн≥й температур≥ ≥ у звТ€зку ≥з цим тхне амон≥аком. ѕри нагр≥ванн≥ до 4000— вс≥ амон≥йн≥ сол≥ розкладаютьс€:
NH4Cl → NH3↑ + HCl↑;
(NH4)3PO4 → 3NH3↑ + H3PO4;
(NH4)2CO3 → 2NH3↑ + CO2↑+ H2O.
” амон≥ачних сол€х кислот-окисник≥в при нагр≥ванн≥ в≥дбуваютьс€ окисно-в≥дновн≥ процеси:
NH4NO3 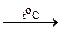 N2O↑ + 2H2O;
N2O↑ + 2H2O;
NH4NO2 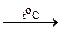 N2↑ + 2H2O;
N2↑ + 2H2O;
(NH4)2Cr2O7 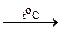 N2↑ + Cr2O3 + 4H2O.
N2↑ + Cr2O3 + 4H2O.
«а цими реакц≥€ми можна ви€вити тверд≥ амон≥йн≥ сол≥. ƒл€ цього в суху проб≥рку внос€ть сух≥ досл≥джуван≥ речовини ≥ нагр≥вають. “верд≥ продукти розкладу досл≥джують на в≥дсутн≥сть йон≥в амон≥ю, а у випадку NH4Cl Ц на ст≥нках проб≥рки осаджуЇтьс€ ц€ с≥ль при охолодженн≥ у вигл€д≥ б≥лого нальоту:
NH3 + HCl → NH4Cl.






