| є п/п | Ќазва | ‘ормула | ѕозначенн€ | ќдиниц≥ вим≥рюванн€ |
| ћаса речовини | ___ | m | кг(г)* | |
| ќбТЇм | ___ | V | 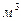 (л, мл) (л, мл)
| |
| √устина речовини | 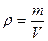
| 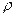 - густина речовини або розчину - густина речовини або розчину
| 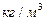
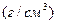
| |
| јтомна одиниц€ маси | а.о.м.= 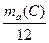
| а.о.м.
 маса атома, — - арбон маса атома, — - арбон
| кг (г) | |
| ¬≥дносна атомна маса | 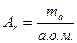
| 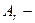 в≥дно-сна атомна маса в≥дно-сна атомна маса
| __ | |
| ¬≥дносна молекул€рна маса | 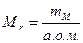 або
або
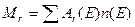
| 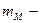 маса молекули
n(≈)-число атом≥в елемента маса молекули
n(≈)-число атом≥в елемента
| ___ |
| ¬изначенн€ та приклад розрахунку або запису |
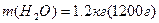
|
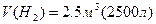
|
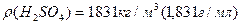
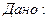 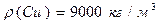
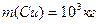 V-?
V-?
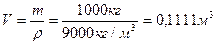
|
1/12 маса атома нукл≥да арбону 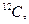 що дор≥внюЇ що дор≥внюЇ 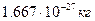
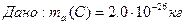 а.о.м. -?
а.о.м
а.о.м. -?
а.о.м 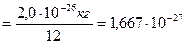 кг кг
|
¬еличина, що дор≥внюЇ в≥дношенню середньоњ маси атома до 1/12 маси атома арбону 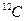
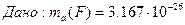 кг кг
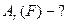
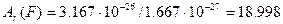
|
ƒано: х≥м≥чна формула води Ќ 2ќ
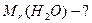
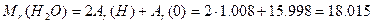
|
| ћол€рна маса | 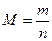
| n-к≥льк≥сть речовини (моль) або 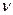
| кг/моль (г/моль) | |
| ћоль | 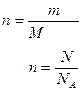
| N-число молекул атом≥в чи ≥нших структур-них одиниць | моль | |
| „исло јвогадро (стала јвогадро) |
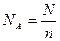
| N 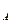 -число јвогадро -число јвогадро
| 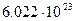 1/моль
1/моль
| |
| ћол€рний обТЇм газу | 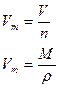
| V 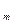 -мол€рний обТЇм газу -мол€рний обТЇм газу
| 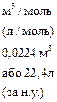
| |
| ¬≥дносна густина газу | 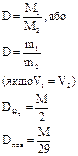
| D-в≥дносна густина газу | __ |
ћаса одного мол€ речовини, виражена в к≥лограмах або грамах
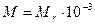 (кг/моль) або (кг/моль) або 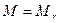 (г/моль) (г/моль)
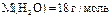
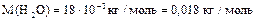 
|
≥льк≥сть речовини, що м≥стить ст≥льки структурних одиниць (атом≥в, молекул, йон≥в, електрон≥в, тощо), ск≥льки атом≥в м≥стить в 0,012 кг нукл≥да
арбону 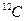 ƒано: m(H
ƒано: m(H 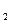 O)=90 г
n-? O)=90 г
n-?
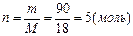 , або , або 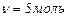
|
„исло структурних одиниць, що м≥ститьс€ в 1 моль речовини
ќбчислити абсолютну масу молекули азоту.
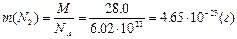
|
¬≥дношенн€ обТЇму речовини до к≥льк≥сть ц≥Їњ речовини
ƒано: 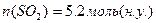
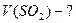
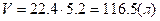 ¬изначити густину пов≥тр€ за н.у.
¬изначити густину пов≥тр€ за н.у.
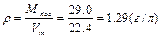
|
¬изначити густину азоту за воднем.
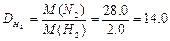 ƒано:
ƒано: 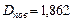
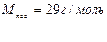 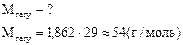
|
| ћасова частка (елемента в речовин≥) | 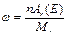
|
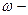 масова частка масова частка
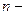 число атом≥в елемента число атом≥в елемента
| ___ | ||||||||
| ќбТЇмна частка речовини | 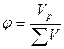
| 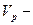 обТЇм речовини; обТЇм речовини;
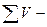 загальний обТЇм загальний обТЇм
| ___ | ||||||||
| “емпература | ___ | t | (кельв≥н) 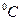 (гра-дус ÷ельс≥€) (гра-дус ÷ельс≥€)
| ||||||||
| “иск | ___ | P | ѕа (паскаль) (атм) | ||||||||
| ≥льк≥сть теплоти | 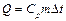
| 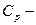 теплоЇмн≥сть теплоЇмн≥сть 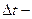 зм≥на температури зм≥на температури
| ƒж, кƒж (кал) | ||||||||
| „ас | ___ |
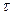
| с (хв) | ||||||||
| ¬алентн≥сть | 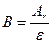
| ¬-валентн≥сть, позначаЇтьс€ римським цифрами ≤, ≤≤, ≤≤≤Е | |||||||||
| ’≥м≥чний екв≥валент (елемента) | 
|
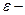 екв≥валент екв≥валент
| |||||||||
ƒано: ƒифосфатну кислоту Ќ  – – 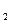 ќ ќ 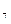
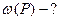
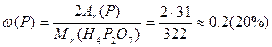
| |||||||||||
ƒано: сум≥ш, що складаЇтьс€ з 2 л ќ 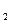 ≥ 3 л N ≥ 3 л N 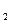
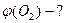

| |||||||||||
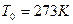 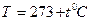
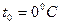
| |||||||||||
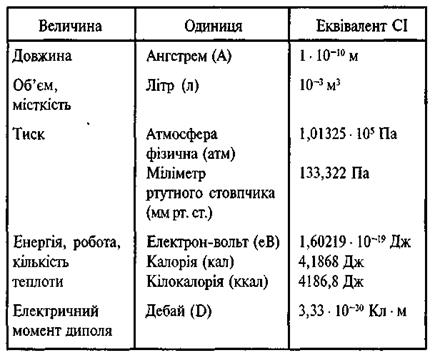
1атм=1,013 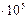 ѕа=760 мм.рт. ст. ѕа=760 мм.рт. ст.
| |||||||||||
| 1 кал=4,18 ƒж | |||||||||||
| 1 хв=60 c | |||||||||||
«датн≥сть атома х≥м≥чного елемента сполучатис€ з певним числом атом≥в ≥нших елемент≥в або приЇднувати число сп≥льних електронних пар, €к≥ звТ€зують атоми
Ќ:Ќ або Ќ-Ќ, Ќ-ќ-Ќ ¬(Ќ)=≤
Ќ-ќ-ќ-Ќ ¬(0)=≤≤
:N 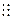 N: або N N: або N 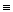 N B(N)=III
NH N B(N)=III
NH  Cl B(N)=IV Cl B(N)=IV
| |||||||||||
≥льк≥сть елемента, що сполучаЇтьс€ з одним молем атом≥в √≥дрогену або зам≥щуЇ таку саму к≥льк≥сть атом≥в водню в ≥нших реакц≥€х
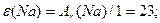 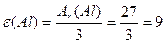
| |||||||||||
| ћол€рна маса екв≥ва-лента | 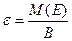
| ћ(≈)- мол€рна маса атом≥в елемента | кг/моль (г/моль) | ||||||||
| ≈кв≥валент оксид≥в | 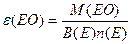 або або
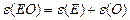
| ¬(≈)- валент-н≥сть n(E)-число атом≥в елемента | |||||||||
| ислот | 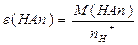 або
або
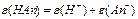
| n-число йон≥в Ќ 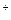 (основн≥сть) (основн≥сть)
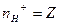
| |||||||||
| ќснов |
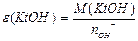
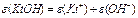
|
n-число групи ќЌ 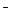 (кислот-н≥сть)
(кислот-н≥сть)
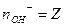
| |||||||||
| —олей |
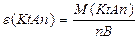
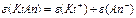
| ¬-валент-н≥сть металу; n-число кат≥он≥в Z=n B | |||||||||
ћаса одного екв≥валента елемента називаЇтьс€ мол€рною масою екв≥валента
¬изначити мол€рн≥ маси екв≥валент≥в елемент≥в у сполуках: 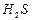 та та 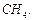
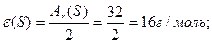 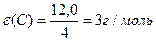
| |||||||||||
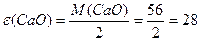 ; ;
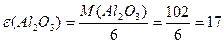 або
або 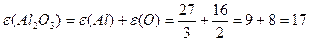
| |||||||||||
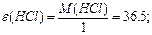
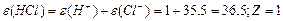
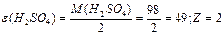 або
або 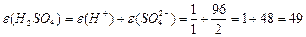
| |||||||||||
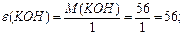
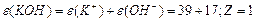
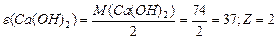 або
або 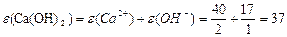
| |||||||||||
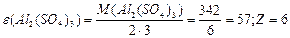 , або , або
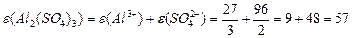
| |||||||||||
| ≈кв≥валент електро-х≥м≥чний | 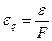
| 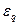 -електро-х≥м≥чний екв≥валент
F- число ‘араде€ -електро-х≥м≥чний екв≥валент
F- число ‘араде€
| (г/ л, мг/ л) | ||||||||
| —туп≥нь окисненн€ | ___ | с.о. познача-Їтьс€ арабськи-ми цифрами ≥з знаком У+Ф або У-Ф | ___ | ||||||||
| ≈лектродний потенц≥ал (стандартний) | ≈,
е 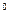
| ¬ (м¬) | |||||||||
| ќкисно-в≥дновний потенц≥ал (стандартний) | ≈,
е 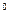
| ¬ (м¬) | |||||||||
| ≈нтальп≥€ (теплота) утворенн€ речовини —тандартна ентальп≥€ утворенн€ |
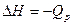
| 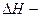 зм≥-на ентальп≥њ або зм≥-на ентальп≥њ або 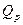 - тепловий ефект за сталого тиску –=соnst - тепловий ефект за сталого тиску –=соnst
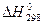
| кƒж/моль (ккал/моль) | ||||||||
|
|
|
ћаса речовини, що окислюЇтьс€ або в≥дновлюЇтьс€ на електродах внасл≥док проходженн€ кр≥зь електрол≥т 1 л електрики
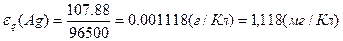
|
”мовний зар€д атома в сполуц≥, обчислений виход€чи з припущенн€, що дана сполука складаЇтьс€ т≥льки з йон≥в
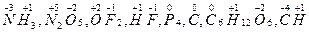
|
| ѕотенц≥ал, що виникаЇ на меж≥ под≥лу метал-розчин в раз≥ зануренн€ металевоњ пластинки в розчин њњ сол≥ (стандартний - в раз≥ концентрац≥њ йон≥в в сол≥ 1 моль/л, “=298 в≥дносно стандартного водневого електрода) |
| ≥льк≥сть теплоти, €ка вид≥л€Їтьс€ або поглинаЇтьс€ внасл≥док утворенн€ одного мол€ речовини з простих речовин ≈нтальп≥€, вим≥р€на за стандартних умов, називаЇтьс€ стандартною ентальп≥Їю (“=298 , –=101,3 кѕа) |
—п≥вв≥дношенн€ м≥ж де€кими позасистемними одиниц€ми та одиниц€ми CI