ѕасивн≥сть металу створюЇтьс€ утворенн€м на його поверхн≥ тонкоњ пл≥вки оксиду. –ечовини, €к≥ спри€ють утворенню такоњ пл≥вки, €к ми вже в≥дзначали, називаютьс€ пасиваторами. —в≥тов≥ витрати металу, звТ€заноњ з короз≥Їю складають дес€тки млн. т вр≥к, тому методам захисту в≥д короз≥њ прид≥л€Їтьс€ належна увага.
≤нг≥б≥торний метод
≤нг≥б≥тори - спов≥льнювач≥ короз≥њ, це складн≥ х≥м≥чн≥ речовини, €к≥ адсорбуютьс€ на поверхн≥ металу, захищаючи його в≥д короз≥њ. ≤нг≥б≥торами можуть служити K2CrO4, K2Cr2O7, NaNO2, Na3PO4, а також високомолекул€рн≥ орган≥чн≥ речовини. ѕо м≥р≥ експлуатац≥њ трубопроводу, зб≥льшуЇтьс€ к≥льк≥сть продукту короз≥њ ≥ зб≥льшуЇтьс€ оп≥р при перекачуванн≥ продукту. ѕ≥сл€ перекриванн€ трубопроводу провод€ть чистку, ввод€ть ≥нг≥б≥тор ≥ п≥зн≥ше пропускають слабий розчин кислоти (рис.13.13).

–исунок 13.13 Ц јдсорбц≥€ ≥нг≥б≥тора на внутр≥шн≥й поверхн≥ трубопровода
ѕродукти короз≥њ взаЇмод≥ють з останньою по схем≥:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
≥ вивод€тьс€ з реакц≥йноњ зони нейтральним розчином.
«ахисн≥ покритт€
ƒл€ захисту в≥д короз≥њ метал покривають ≥ншим металом, б≥льш ст≥йким по в≥дношенню до навколишнього середовища. «ахисне покритт€ повинно бути суц≥льним ≥ дуже густим. ѕри порушенн≥ ц≥л≥сност≥ метал, €кий захищаЇтьс€ приходить в контакт з агресивним середовищем, що визиваЇ короз≥ю, тобто утворюЇтьс€ гальван≥чний елемент. –озр≥зн€ють гар€че покритт€, метод напиленн€ коли р≥дкий метал напилюють на ≥нший, гальваностег≥ю ≥ т.д. ¬с≥ види покрить розд≥л€ють на дв≥ категор≥њ:
јнодне покритт€ - покритт€ даного металу б≥льш активним металом, наприклад Fe можна захистити AI, Zn, Cd (рис. 13.14):
атодне покритт€ Ц покритт€ даного мталу менш активним металом, наприклад Fe можна захистити Sn, Pb.

–исунок 13.14 Ц ≈лекторх≥м≥чн≥ процеси при анодному та катодному захист≥
–озгл€немо модель, коли деталь працюЇ в стац≥онарному режим≥, тобто в спок≥йному стан≥, без удар≥в, в≥брац≥њ. ¬ першому випадку зал≥зо покрите цинком. ÷инк - дорогий метал ≥, очевидно, таке покритт€ вимагаЇ значних затрат. якщо ми маЇмо суц≥льне покритт€, то в стац≥онарному, режим≥ б≥льш виг≥дно покривати оловом (б≥льш пасивним металом). ѕри порушенн≥ ц≥лостност≥ покривного шару, цинк €к б≥льш активний метал, посилаЇ своњ йони в розчин. ¬иникаЇ подв≥йний електричний шар: Zn0 - 2ē → Zn2+
якщо ж весь час забирати електрони, тод≥ цинк руйнуЇтьс€, тобто п≥ддаЇтьс€ короз≥њ: 2H+ + 2 ē → H2. ¬≥дновленн€ водню проходить на зал≥з≥.
¬ даному випадку цинк окислюЇтьс€ весь час, не дивл€чись на те, що в на€вност≥ тр≥щини. ќтже розгл€нутий випадок анодного покритт€, тобто покритт€ б≥льш активним металом захищаЇ метал нав≥ть у випадку тр≥щин.
¬ другому випадку зал≥зо б≥льш активне, посилаЇ своњ йони в розчин: Fe0 Ц 2 ē → Fe2+; 2H+ + 2 ē → H2.
оли порушуЇтьс€ покритт€ краще щоб олова взагал≥ не було, процес короз≥њ проходить надзвичайно швидко. Ќевиг≥дн≥сть покритт€ малоактивним металом очевидна. якщо ж метал менш активний н≥ж метал, що захищаЇтьс€, таке покритт€ носить назву катодного. ѕри пошкодженн≥ катодного покритт€ метал, €кий ми захищаЇмо п≥ддаЇтьс€ б≥льш≥й короз≥њ.
|
|
|
«ахисн≥ покритт€ провод€ть ще фарбами, емал€ми, пол≥мерними речовинами, оксидними пл≥вками. „асто провод€ть процес ворон≥нн€, внасл≥док чого на поверхн≥ металу утворюютьс€ в≥дпов≥дн≥ оксиди (Fe3O4, Cr2O3 та ≥нш≥).
ѕротекторний захист
ƒо металу, €кий необх≥дно захистити в≥д короз≥њ прикр≥пл€ютьс€ пластинки б≥льш активного металу Ц протектора (рис. 13. 15).

–исунок 13.15 Ц ѕротекторний захист фрагмента зал≥зноњ конструкц≥њ
¬ гальван≥чн≥й пар≥ протектором Ї анод, а конструкц≥€ катодом. ѕротектор поступово руйнуЇтьс€:
2п0 - 2ē → Zn2+; 2H+ + 2 ē → H2 (Fe).
“ак захищають метал≥чн≥ конструкц≥њ, €к≥ знаход€тьс€ у водному середовищ≥.
атодний захист
¬с€ поверхн€ металу, €кий захищаЇтьс€ в≥д короз≥њ штучно робитьс€ катодом (рис.13.16):
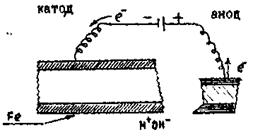
–исунок 13.16 Ц атодний захист фрагмента зал≥зноњ конструкц≥њ
÷е дос€гаЇтьс€ приЇднанн€м металу €кий ми захищаЇмо до катоду зовн≥шнього джерела струму. “акий захист в≥д короз≥њ називаЇтьс€ катодним. Ќа метал≥ катоду проходить процес: Fe0 Ц 2 ē → Fe2+, тобто катод окиснюЇтьс€, ржав≥Ї, а контрукц≥€ буде захищеною. Ќа катод≥:
Fe2+ + 2 ē → Fe0, тобто проходить процес в≥дновленн€.
¬икористанн€ вказаного методу вимагаЇ витрат електричноњ енерг≥њ, але цей спос≥б п≥ддаЇтьс€ легкому контролю по величин≥ струму, значить п≥ддаЇтьс€ дистанц≥йному управл≥нню.
ожного року внасл≥док короз≥њ безповоротно витрачаЇтьс€ величезна к≥льк≥сть металу. —в≥това витрата металу становить приблизно 20 млн. т в р≥к. ¬итрати на ремонт або зам≥ну деталей суден, автомоб≥л≥в, апаратури х≥м≥чних виробництв, прилад≥в у багато раз≥в перевищують варт≥сть металу з €кого њх виготовл€ють. ≤стотними бувають непр€м≥ витрати, спричинен≥ короз≥Їю. ƒо них можна в≥днести вит≥канн€ нафти або газу з трубопровод≥в, псуванн€ харчових продукт≥в, втрати здоровТ€. ќтже, боротьба э короз≥Їю Ї важливою н/г проблемою. Ќа захист в≥д короз≥њ витрачаютьс€ значн≥ кошти з метою розвитку роб≥т по електрох≥м≥чних процесах, удосконаленню њх на виробництвах ≥ впровадженню передових теор≥й в практику.
ѕитанн€ дл€ самоконтролю
13.1. ўо таке електродний потенц≥ал? ” чому р≥зниц€ м≥ж електродним ≥ в≥дновним, в≥дновним ≥ окисним потенц≥алом?
13.2. „ому не можна вим≥р€ти абсолютне значенн€ електродного потенц≥алу?
13.3. як≥ продукти можна одержати електрол≥зом? Ќавед≥ть приклади електрол≥зу з р≥зними типами електрод≥в.
13.4. « €кою метою використовують акумул€тори та паливн≥ елементи. Ќавед≥ть приклади з написанн€м електрох≥м≥чних р≥вн€нь реакц≥й.
13.5. «разки сплаву зал≥за пом≥стили:
1) у дистильовану воду
2) у воду, насичену киснем
3) у воду, насичену сум≥шшю газ≥в: кисню ≥ карбон (IV) оксиду
4) у воду, через €ку пропускали попередньо газопод≥бний водень.
ороз≥€ сплаву сильн≥ше проходить у випадку...
13.6. Ќа швидк≥сть короз≥њ метал≥чних конструкц≥й ≥стотно впливаЇ характер електрол≥ту. Ќайб≥льш швидко буде п≥ддаватись короз≥њ метал≥чний вир≥б, €кщо електрол≥т м≥стить:
1) окисник в кислому середовищ≥ при п≥двищен≥й температур≥;
2) в≥дновник в кислому середовищ≥ при пом≥рн≥й температур≥;
|
|
|
3) окисник у лужному середовищ≥ при низьк≥й температур≥;
4) в≥дновник у лужному середовищ≥ при п≥двищен≥й температур≥.
13.7. ≈лектрох≥м≥чна короз≥€ метал≥в, €ка наносить велику шкоду, €вл€Ї собою:
1) руйнуванн€ металу при реагуванн≥ його ≥з оксидами н≥трогену;
2) реагуванн€ металу ≥з киснем пов≥тр€;
3) руйнуванн€ металу в середовищ≥ електрол≥ту ≥з виникненн€м всередин≥ системи електричного струму;
4) реагуванн€ металу ≥з оксидами сульфуру (IV ≥ VI).
13.8. ороз≥€ метал≥в наносить велику шкоду народному господарству. “ому дл€ боротьби ≥з нею використовують так≥ основн≥ способи €к...






