ѕриклад 1. „им в≥др≥зн€ютьс€ кристал≥чн≥ гратки метал≥в в≥д: а) йонних; б) атомних?
¬≥дпов≥дь:
ристал≥чн≥ гратки метал≥в утворюютьс€ т≥льки позитивними йонами. …онн≥ Ц €к позитивними, так ≥ негативно зар€дженими йонами. “ип звТ€зку в кристал≥чних гратках метал≥в Ц метал≥чний, а в атомних Ц ковалентний.
Ѕудова кристал≥чних граток метал≥в обумовлюЇтьс€ њх ф≥зичними ≥ х≥м≥чними властивост€ми. «авд€ки рухливим електронам метали мають високу тепло- ≥ електропров≥дн≥сть. ѕоск≥льки метали легко в≥ддають зовн≥шн≥ електрони, тому вони Ї сильними в≥дновниками.
ѕитанн€ 2. як≥ загальн≥ ф≥зичн≥ властивост≥ метал≥в? ѕо€сн≥ть ц≥ властивост≥, ірунтуючись на у€вленн€х про метал≥чний звТ€зок.
¬≥дпов≥дь:
‘≥зичн≥ властивост≥ метал≥в: метал≥чний блиск, висока тепло- ≥ електропров≥дн≥сть, ковк≥сть ≥ пластичн≥сть. ѕров≥дн≥сть тепла ≥ електрики по€снюЇтьс€ рухом в≥льних електрон≥в в кристал≥чн≥й гратц≥ метал≥в. овк≥сть ≥ пластичн≥сть метал≥в по€снюЇтьс€ рухом окремих шар≥в йон≥в один в≥дносно ≥ншого. √устина метал≥в, температури њх плавленн€ ≥ кип≥нн€ в≥др≥зн€ютьс€ ≥ залежать в≥д м≥цност≥ метал≥чного звТ€зку.
ѕитанн€ 3. „ому де€к≥ метали пластичн≥ (наприклад, м≥дь), а ≥нш≥ Ц крихк≥ (наприклад, стиб≥й)?
¬≥дпов≥дь:
јтоми крихких метал≥в мають число в≥льних електрон≥в в≥д пТ€ти до семи. ÷≥ електрони забезпечують м≥цну взаЇмод≥ю м≥ж окремими шарами йон≥в ≥ запоб≥гають њх ковзанню один в≥дносно ≥ншого. ¬заЇмод≥€ м≥ж йонними шарами у пластичних метал≥в мала, оск≥льки число в≥льних електрон≥в м≥ж шарами менше, н≥ж у крихких метал≥в.
ѕриклад 4. Ќа основ≥ вченн€ про будову атом≥в по€сн≥сть, чим метали за х≥м≥чними властивост€ми в≥др≥зн€ютьс€ в≥д неметал≥в.
¬≥дпов≥дь:
ќсновна в≥дм≥нн≥сть метал≥в в≥д неметал≥в та, що атоми метал≥в легко в≥ддають своњ валентн≥ електрони, тобто Ї сильними в≥дновниками. ћетали окиснюютьс€ окисниками: киснем, воднем, галогенами, с≥ркою, г≥дроген-≥онами та йонами ≥нших метал≥в.
ѕриклад 5. „ому метали взаЇмод≥ють з неметалами? Ќапиш≥ть р≥вн€нн€ реакц≥й, вкаж≥ть €к≥ продукти реакц≥й утворюютьс€.
¬≥дпов≥дь:
’≥м≥чн≥ властивост≥ метал≥в визначаютьс€ здатн≥стю њх атом≥в легко в≥ддавати валентн≥ електрони ≥ перетворюватись на позитивн≥ йони внасл≥док низьких значень електронегативностей, €к≥ обумовлен≥ невеликими енерг≥€ми йон≥зац≥њ та спор≥днен≥стю до електрона (часто в≥дТЇмною). ѕриклади взаЇмод≥њ метал≥в з неметалами:
| –еагент (неметал) | –≥вн€нн€ реакц≥й | ѕродукти реакц≥й |
| исень | 2Ca + O2 → 2CaO 4Fe + 3O2 →2 Fe2O3 2Na + O2 → Na2O2 | оксид або пероксид |
(з киснем реагують ус≥ метали, кр≥м золота, ср≥бла, платинових метал≥в).
| —≥рка | Fe + S → FeS | сульф≥д |
(з с≥ркою реагують ус≥ метали, кр≥м золота та платини).
| ’лор | 2Fe + 3Cl2 → 2FeCl3 2Au + 3Cl2 → 2AuCl3 | хлорид |
(реагують - вс≥).
| јзот | 6Na + N2 → 2Na3N | н≥трид |
(реагують т≥льки лужн≥, магн≥й та лужноземельн≥).
| ‘осфор | 3Mg + 2P → Ca3P2 3Na + P → Na3P | фосф≥д |
(реагують майже вс≥)
|
|
|
| ¬углець | 4Al + 3C → Al4C3 3Fe + C → Fe3C | карб≥д |
(реагують майже вс≥)
| ремн≥й | 2Ca + Si → Ca2Si | сил≥цид |
(реагують майже вс≥)
| ¬одень | 2La + 3H2 → 2LaH3 | г≥дрид |
(реагують майже вс≥).
ѕриклад 6. як взаЇмод≥ють метали з водою? Ќапиш≥ть р≥вн€нн€ в≥дпов≥дних реакц≥й.
¬≥дпов≥дь:
ѕо в≥дношенню до води та водних розчин≥в метали д≥л€тьс€ на активн≥, пасивуюч≥ та ≥нертн≥. ¬с≥ метали, €к≥ знаход€тьс€ в р€ду активност≥ до водню повинн≥ вит≥сн€ти його з води. ¬ д≥йсност≥ - вит≥сн€ють т≥льки активн≥ метали, решта не вит≥сн€ють, тому що:
1. ћетали покриваютьс€ оксидною пл≥вкою, €ка захищаЇ њх в≥д розчиненн€.
2. –€д активност≥ справджуЇтьс€ дл€ 1 моль∙екв./лрозчин≥в, а концентрац≥€ йон≥в H+ у вод≥ т≥льки 10-7 моль/л, надзвичайно мала.
« водою при звичайн≥й температур≥ взаЇмод≥ють лужн≥ та лужноземельн≥ метали ≥ тал≥й. ѕри цьому утворюютьс€ в≥дпов≥дн≥ г≥дроксиди ≥ вид≥л€Їтьс€ водень. Ќаприклад:
2Tl + 2H2O = 2TlOH + H2
Ca + 2H2O = Ca(OH)2 + H2
ѕри нагр≥ванн≥ з водою взаЇмод≥ють також магн≥й та берил≥й:
Mg + 2H2O = Mg(OH)2 + H2
Be + 2H2O = ¬e(ќЌ)2 + H2
ћетали п≥дгрупи сканд≥ю ≥ лантаноњди теж реагують з водою, хоча ≥пов≥льно:
2Sc + 6H2O = 2Sc(OH)3 + «H2↑
ѕри взаЇмод≥њ кал≥ю з водою загор€Їтьс€ водень, реакц≥€ Rb ≥ Cs супроводжуЇтьс€ вибухом.
јлюм≥н≥й, гал≥й, ≥нд≥й, герман≥й, олово, свинець, стиб≥й ≥ б≥смут при високих температурах взаЇмод≥ють з вод€ною парою, при цьому вид≥л€Їтьс€ водень ≥ утворюютьс€ в≥дпов≥дн≥ оксиди, в €ких метали про€вл€ють своњ ст≥йк≥ ступен≥ окисненн€.
Ќаприклад: Pb + H2O = PbO + H2
ƒе€к≥ метали здатн≥ взаЇмод≥€ти зводою не вит≥сн€ючи з нењ водню. ÷е по€снюЇтьс€ тим, що вони утворюють погано розчинн≥ у вод≥ г≥дроксиди, €к≥ ос≥дають на поверхню металу ≥ утворюють на н≥й захисн≥ пл≥вки. Ќаприклад, магн≥й, €кий спочатку взаЇмод≥Ї з водою, пот≥м покриваЇтьс€ нерозчинним г≥дроксидом:
Mg + 2H2O = Mg(OH)2 + H2↑
якщо ж г≥дроксид нест≥йкий, то в≥н на поверхн≥ металу розпадаЇтьс€ ≥ утворюЇ захисну пл≥вку оксиду, наприклад, Al2O3, —r2ќ3, на цинку у вигл€д≥ ZnO ≥ т.д. «меншенн€ активност≥ металу за рахунок утворенн€ захисних пл≥вок називаЇтьс€ пасивац≥Їю. ѕри видаленн≥ захисноњ пл≥вки метал реагуЇ з водою.
« метал≥в поб≥чних п≥дгруп, з водою, при нагр≥ванн≥ взаЇмод≥ють т≥льки елементи третьоњ поб≥чноњ п≥дгрупи. ѕри цьому вид≥л€Їтьс€ водень ≥ утворюютьс€ практично нерозчинн≥ у вод≥ г≥дроксиди:
2La + 6H2ќ = 2La(ќH)3 + «Ќ2
≤нш≥ d -метали, за вин€тком найменш активних (технец≥ю, рен≥ю, метал≥в родини платини, метал≥в поб≥чноњ п≥дгрупи першоњ групи та ртут≥), взаЇмод≥ють при високих температурах з вод€ною парою. ѕри цьому вид≥л€Їтьс€ водень ≥ утворюютьс€ в≥дпов≥дн≥ оксиди або г≥дроксиди:
2Cr + «Ќ2ќ = —r2ќ3 +3H2
Mn + 2H2O = Mn(OH)2 + Ќ2
ѕри нагр≥ванн≥ лантаноњди взаЇмод≥ють з водою, при цьому утворюютьс€ нерозчинн≥ у вод≥ г≥дроксиди:
2Lа + 6H2O = 2Lа(OH)3 + 3H2,
де Ln - атом лантаноњду. ÷ей процес краще в≥дбуваЇтьс€ з металами цер≥Ївоњ групи. ”ран ≥ тор≥й взаЇмод≥ють з вод€ною парою при температур≥ 200-3000C, при цьому водень, щоутворюЇтьс€, реагуЇ з металом, утворюючи г≥дрид:
U + 2H2O = UO2 + 2Ќ2↑
2U + 3H2 = 2UH3
ѕриклад 7. як взаЇмод≥ють метали з лугами? Ќапиш≥ть р≥вн€нн€ в≥дпов≥дних реакц≥й.
|
|
|
¬≥дпов≥дь:
3 лугами взаЇмод≥ють т≥льки т≥ метали, оксиди €кихволод≥ють амфотерними властивост€ми. ѕри д≥њ лугу на цинк одержуЇтьс€ с≥ль цинковоњ кислоти - цинкат з вид≥ленн€м водню, €ке повТ€зуЇтьс€ з взаЇмод≥Їю атом≥в металу з молекулами води
Zn + Ќ2ќ = Zn(OH)2 + Ќ2
–оль лугу пол€гаЇ в розчиненн≥ захисноњ пл≥вки
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
—умарно записують:
Zn + 2NaќЌ + 2H2O = Na2[Zn(OH)4] + H2↑
2Al + 2NaќЌ + 6H2O = 2Na[Al(OH)4] + 3H2↑
або 2Al + 2NaќЌ + 2H2O= 2NaAlO2 + 3H2↑
Ѕерил≥й, алюм≥н≥й, гал≥й, ≥нд≥й, олово й свинець розчин€ютьс€ у лугах, причому олово й свинець краще, при нагр≥ванн≥, з утворенн€м в≥дпов≥дних г≥дроксосолей:
Be + 2KќЌ + 2H2O = K2[Be(OH)4] + H2↑
2Al + 2KќЌ + 6H2O= 2K[Al(OH)4] + 3H2↑
Pb + 2KќЌ + 2H2O = K2[Pb(OH)4] + H2↑
Sn + 2KќЌ + 4H2O = K2[Sn(OH)6] + 2H2↑
¬с≥ ≥нш≥ елемент≥в головних п≥дгруп у лугах нерозчинн≥.
ƒе€к≥ метали поб≥чних п≥дгруп добре розчинн≥ у лугах, зокрема цинк. “итан, циркон≥й, а також ванад≥й, н≥об≥й ≥ тантал пов≥льно взаЇмод≥ють при нагр≥ванн≥ з концентрованими розчинами луг≥в, окиснюючись до вищих ступен≥в окисненн€ ≥ утворюючи сол≥ в≥дпов≥дних кислот:
Ti + 2KOH + H2O = K2TiO3 +2H2
2V + 2KOH + 4H2O = 2KVO3 + 5H2
’ром, вольфрам, рен≥й ≥ метали родини платини взаЇмод≥ють при висок≥й температур≥ з розтопленими лугами в присутност≥ окисник≥в (кисню, кал≥й н≥трату KNO3, кал≥й перхлорату KClO4 тощо):
W + 2KOH + 3KNO3 = K2WO4 + KNO2 + H2O
« лугами за звичайних умовлантаноњди й актиноњди не взаЇмод≥ють.
ѕриклад 8. як реагують метали з найб≥льш вживаними кислотами HCl, HNO3, H2SO4?
¬≥дпов≥дь:
ћайже вс≥ метали окиснюютьс€ кислотами. ’арактер взаЇмод≥њ з кислотою залежить в≥д активност≥ металу, його властивостей, а також в≥д концентрац≥њ кислоти.
ѕри взаЇмод≥њ безоксигеновоњ кислоти з металом, роль окислювача в≥д≥граЇ йон г≥дрогену Ќ+. якщо ж з металом реагуЇ оксигеновм≥сна кислота, то в рол≥ окислювача виступаЇ Ќ+, або ан≥он кислотного залишку.
’лоридна кислота HCl сильна кислота (α = 99%), вона м≥стить 38% HCl у водному розчин≥ (б≥льше г≥дроген хлориду у вод≥ не розчин€Їтьс€).
’лороводнева кислота Ц слабкий окисник за рахунок йон≥в Ќ+ , тому вона взаЇмод≥Ї лише з металами, €к≥ сто€ть в р€ду стандартних електродних потенц≥ал≥в перед воднем, наприклад:
2 HCl + Mg → MgCl2 + H2↑
HCl + Cu ≠
—хема взаЇмод≥њ сульфатноњ кислоти з металами:
|
|
|
|

ѕриклади:
ѕ≥д час взаЇмод≥њ з активними металами (наприклад, ≥з магн≥Їм) в залежност≥ в≥д концентрац≥њ ≥ температури паралельно в≥дбуваютьс€ к≥лька реакц≥й з утворенн€м сполук с≥рки, в €ких с≥рка маЇ р≥зн≥ ступен≥ окисненн€ (S+4O2, S0,
H2S-2); однак переважають реакц≥њ з утворенн€м S0 ≥ H2S.
 +
+  =
= 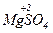 +
+  + 2H2O
+ 2H2O
 Ц 2e → Ц 2e → 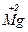
| в≥дновник | |
 + 2e → + 2e → 
| окисник |
8  8
8
3  +
+ 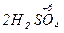 = 3
= 3 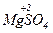 +
+  + 4H2O
+ 4H2O
 Ц 2e → Ц 2e → 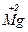
| в≥дновник | ||
 + 6e → + 6e → 
| окисник |
16  16
16
4  +
+  = 4
= 4 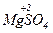 +
+  + 4H2O
+ 4H2O
 Ц 2e → Ц 2e → 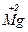
| в≥дновник | ||
 + 8e → + 8e → 
| окисник |
20  20
20
¬насл≥док взаЇмод≥њ з малоактивними металами (наприклад, м≥ддю) утворюютьс€ с≥ль та сульфур (≤V):оксид
Cu + 2H2SO4(к) → CuSO4 + SO2 + 2H2O
” випадку розведеноњ сульфатноњ кислоти метали реагують з нею аналог≥чно хлоридн≥й кислот≥, тобто вид≥л€Їтьс€ водень:
Zn + H2SO4 (р) → ZnSO4 + H2↑
Ќ≥тратна кислота Ц сильний окисник. ¬насл≥док взаЇмод≥њ з металами водень не вид≥л€Їтьс€, в≥н окислюЇтьс€ з утворенн€м води.
—хема взаЇмод≥њ н≥тратноњ кислоти з металами:

ѕриклади:
a)  + 4
+ 4  =
=  + 2
+ 2  + 2H2O
+ 2H2O
 Ц 2e → Ц 2e → 
| в≥дновник | ||
 + e → + e → 
| окисник |
12  12
12
б)  + 10Ќ
+ 10Ќ 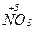 (к) = 4
(к) = 4  +
+  + 5H2O
+ 5H2O
|
|
|
 Ц 2e → Ц 2e → 
| в≥дновник | ||
2  + 8e → 2 + 8e → 2 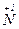
| окисник |
30  30
30
в)  + 4H
+ 4H  O3(р) = 3
O3(р) = 3  NO3 +
NO3 +  O + 2H2O
O + 2H2O
 Цe → Цe → 
| в≥дновник | ||
 + 3e → + 3e → 
| окисник |
12  12
12
г) 4  + 10 H
+ 10 H  O3 (–) = 4
O3 (–) = 4  +
+  + 3H2O
+ 3H2O
 Ц 2e → Ц 2e → 
| в≥дновник | ||
 + 8e → + 8e → 
| окисник |
30  30
30
Ќе реагуЇ н≥тратна кислота з платиною (Pt), золотом (Au), рад≥Їм (Rh), тал≥Їм (Tl), ≥рид≥Їм (Ir), пасивуЇ (при звичайн≥й температур≥): алюм≥н≥й (Al), хром (Cr), зал≥зо (Fe).
ѕриклад 9. як можна встановити, що при гор≥нн≥ метал≥чного натр≥ю утворюЇтьс€ не оксид, а пероксид?
¬≥дпов≥дь:
Ќатр≥й пероксид, на в≥дм≥ну в≥д оксиду, сильний окисник, в≥н окислюЇ йодиди в кислому середовищ≥ до йоду.
 .
.
Ќатр≥й оксид реагуЇ не з  , а ≥з
, а ≥з 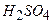 .
.
 .
.
ѕриклад 10. јтоми €ких елемент≥в Ї б≥льш сильними в≥дновниками Ц лужн≥ метали чи водень? ѕ≥дверд≥ть в≥дпов≥дь р≥вн€нн€ми реакц≥й.
¬≥дпов≥дь:
Ћужн≥ метали Ц б≥льш сильн≥ в≥дновники, н≥ж водень. ÷е п≥дтверджуЇтьс€ тим, що вони вит≥сн€ють водень ≥з води ≥ кислот:
 ;
;
 .
.
ѕриклад 11 „ому у фотоелементах використовують переважно цез≥й а не л≥т≥й?
¬≥дпов≥дь:
≈нерг≥€ йон≥зац≥њ атома цез≥ю Ц найменша серед вс≥х лужних метал≥в (за виключенн€м рад≥оактивного франц≥ю), тому при опром≥ненн≥ цез≥ю з його поверхн≥ легко в≥дриваютьс€ електрони, €к≥ використовуютьс€ у фотоелементах.
ѕриклад 12. Ќапиш≥ть р≥вн€нн€ реакц≥й, €к≥ дозвол€ють зд≥йснити наступн≥ перетворенн€:
 .
.
¬≥дпов≥дь:
1) натр≥й утворюютьс€ п≥д час електрол≥зу розплаву натр≥й хлориду
 ;
;
2) натр≥й реагуЇ ≥з воднем:
 .
.
3) натр≥й г≥дрид повн≥стю г≥дрол≥зуЇтьс€:
 .
.
4) при пропусканн≥ надлишку сульфур (IV) оксиду через розчин натр≥й г≥дроксиду утворюЇтьс€ натр≥й г≥дросульф≥т
 .
.
ѕриклад 13. Ќапиш≥ть р≥вн€нн€ реакц≥й:
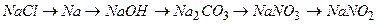 .
.
¬≥дпов≥дь:
 ;
;
 ;
;
 ;
;
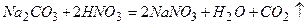 ;
;
 ↑.
↑.
ѕриклад 14. ” вашому розпор€дженн≥ натр≥й хлорид ≥ вода. як≥ речовини можна отримати ≥з цих речовин, використовуючи необх≥дн≥ прилади?
¬≥дпов≥дь:
1)  ;
;
2) 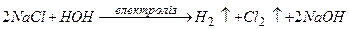 .
.
3)  .
.
4)  .
.
5)  .
.
6)  .
.
7) 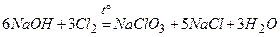 .
.
8)  .
.
9)  .
.
10)  .
.
11)  .
.
ѕриклад 15. Ќапиш≥ть р≥вн€нн€ реакц≥й взаЇмод≥њ лужних метал≥в з киснем
¬≥дпов≥дь:
¬с≥ лужн≥ метали легко окиснюютьс€ киснем пов≥тр€, причому л≥т≥й утворюЇ оксид:
 ;
;
натр≥й пероксид:
 ;
;
кал≥й, руб≥д≥й та цез≥й Ц надпероксиди
 .
.
ѕриклад 16. ћетал≥чний кальц≥й тверд≥ший за л≥т≥й, але мТ€кший в≥д берил≥ю. як це можна по€снити, ірунтуючись на вченн≥ про будову кристал≥чних іраток.
¬≥дпов≥дь:
альц≥й тверд≥ший за л≥т≥й, оск≥льки в≥н маЇ два електрони на зовн≥шньому р≥вн≥, а л≥т≥й Ц один, ≥ тому в утворенн≥ метал≥чного звТ€зку в кальц≥ю беруть участь б≥льше число електрон≥в, н≥ж у л≥т≥ю. «начить, метал≥чний звТ€зок в кальц≥ю м≥цн≥ший, н≥ж у л≥т≥ю, тому кальц≥й тверд≥ший.
јтом берил≥ю маЇ менший рад≥ус, н≥ж атом кальц≥ю, тому в метал≥чного берил≥ю шари йон≥в м≥цн≥ше звТ€зан≥ один з одним, н≥ж у метал≥чного кальц≥ю. «начить, берил≥й тверд≥ший, н≥ж кальц≥й
÷≥ приклади св≥дчать про те, що тверд≥сть металу однозначно повТ€зана з м≥цн≥стю метал≥чного звТ€зку.






