Приклад 1. Яким чином характеризує хімічні властивості металів електрохімічний ряд напруг?
(Див. додаток Ж).
Відповідь:
1) Чим більш негативний електродний потенціал металів, тим більша його відновна властивість.
2) Кожний метал витісняє (відновлює) із розчинів солей ті метали, які розміщені в ряду напруг металів після нього. Винятком є лише лужні і лужноземельні метали, які не будуть відновлювати йони інших металів із розчинів їх солей. Це пов'язано з тим, що в даних випадках з більшою швидкістю протікають реакції взаємодії металів з водою.
3) Всі метали, які мають негативний стандартний електродний потенціал, тобто знаходяться в ряді напруг металів лівіше водню, здатні витісняти його із розчинів кислот.
Електрохімічний ряд напруг металів характеризує поведінку металів і їх солей тільки у водних розчинах, поскільки потенціали враховують особливості взаємодії того чи іншого йону металу з молекулами розчинника. Тому ряд починається з літію. Це пов'язано із винятково високою енергією процесу гідратації йонів літію в порівнянні із йонами інших лужних металів.
Приклад 2. Який пристрій використовують для перетворення енергії хімічної реакції в електричну?
Відповідь:
Система або пристрій для безпосереднього перетворення енергії хімічної реакції в електричну називається гальванічним елементом.
Прикладом такої системи є гальванічний елемент Даніеля – Якобі (рис 13.1):
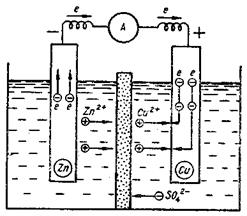
Рисунок 13.1 – Гальванічний елемент Даніеля - Якобі
Гальванічний елемент Даніеля - Якобі складається із цинкового і мідного електродів, занурених відповідно у розчини сульфатів цинку і купруму, які розділені пористою перегородкою (рис.13.1).
Під час роботи цинк окислюється
Zn = Zn2+ + 2ē (окиснення),
а йони купруму відновлюються
Cu2+ + 2е = Cu (відновлення).
Сумарний процес:
Zn + Cu2+= Cu + Zn2+
Ця реакція є оборотною, оскільки рівновага зміщується вліво, якщо пропускати електричний струм від зовнішнього джерела у протилежному напрямку.
Електрод, на якому відбувається окиснення, називається анодом (Zn). Електрод, на якому відбувається відновлення — катодом (Cu).
Схематично гальванічний елемент Даніеля – Якобі зображають так:
(—) Zn ׀ Zn2+ ׀׀ Cu ׀ +2 Cu (+)
На цинковому електроді відбувається розчинення цинку з перетворенням його атомів на йони, (процес окиснення), а вивільнені електрони по провіднику переходять на мідний електрод, де відбувається розрядження катіонів Купруму, що супроводжується виділенням металічної міді (процес відновлення).
Електричний струм, що виникає в гальванічному елементі, здатний виконувати корисну роботу. Величина роботи, яку можна виконати внаслідок перетворення хімічної енергії окисно-відновної реакції, що відбувається в гальванічному елементі, залежить від величини струму, який виникає в цьому елементі.
Максимальне значення напруги гальванічного елемента, що відповідає перебігу реакції в прямому і зворотному напрямках називається електрорушійною силою гальванічного елемента (ЕРС). Вона дорівнює різниці потенціалів між його електродами.
Приклад 3. На яких окисно-відновних процесах базується робота акумуляторів?
Відповідь:
Акумулятори — це прилади для накопичування хімічної енергії, яка в разі потреби може перетворюватися в електричну енергію.
Вони здатні перетворювати нагромаджену хімічну енергію на електричну (при розрядженні), а електричну – на хімічну (при зарядженні).
Найбільше поширення і практичне застосування мають свинцевий і лужні акумулятори.
Свинцевий, або кислотний, акумулятор складається з двох електродів, занурених у розчин сульфатної кислоти (22—28 %-й). Один електрод (спресований PbO2) є позитивним полюсом, а другий (решітчаста пластина металічного свинцю) — негативним полюсом акумулятора. Схему свинцевого акумулятора можна записати так:
(-) Pb ׀ H+, SO42- ׀ PbO2 (+)
Під час зарядження, коли через акумулятор пропускають постійний електричний струм, на електродах відбуваються такі електрохімічні процеси:
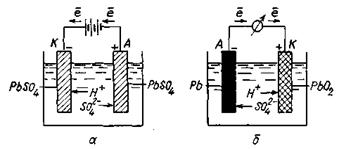
Рисунок 13.2 - Схема роботи свинцевого акумулятора
На катоді (-): PbSO4 + 2ē → Pb + SO42 -.
На аноді (+): PbSO4 + 2H2O — 2ē → PbO2 + 4H+ + SO42-
Під час розряджання акумулятора на електродах відбуваються протилежні процеси (рис.13.2):
На аноді (-): Pb + SO42- — 2ē → PbSO4 φ° = 0,36 В.
На катоді (+): PbO2 + 4H+ + SO42- + 2ē → PbSO4 + 2H2O
φ° = 1,68 В.
Загальне рівняння реакції роботи свинцевого акумулятора має вигляд:
розрядження
Pb + 2H2SO4 + PbO2  PbSO4 + 2PbSO4 + 2H2O.
PbSO4 + 2PbSO4 + 2H2O.
EPC акумулятора Е° = φ°кат. - φ°ан. = +1,68 - (-0,36) = + 2,04 В.
Якщо при експлуатації акумулятора EPC зменшується до 1,85 В, то його треба зарядити, під'єднавши до зовнішнього джерела постійного струму.
До лужних акумуляторів належать залізно-нікелевий, кадмієвий і срібно-цинковий акумулятори. Електролітом для них є 20 - 30 %-й розчин лугу KOH і LiOH.
Зарядження і розрядження лужного залізо-нікелевого акумулятора відбувається за схемою:
розрядження
Fe + 2Ni(OH)3  Fe(OH)2 + 2Ni(OH)2.
Fe(OH)2 + 2Ni(OH)2.
Негативним електродом є спресований порошок заліза з добавками меркурій пероксиду тощо, а позитивним електродом - Ni(OH)3, (точніше, гідратований нікель оксид Ni2O3 ∙ H2O, або NiO(OH), тобто
(-) Fe ׀ K+, OH- ׀ Ni(OH)3 (+)
Залізо-нікелевий акумулятор має EPC 1,36 В.
У кадмієво-нікелевому акумуляторі замість заліза катодом є губчастий кадмій. Схема такого акумулятора має вигляд:
(-) Cd ׀ K+, ОН- ׀ Ni(OH)3 (+),
а заряджається і розряджається він за рівнянням:
розряджається
Cd + 2Ni(OH)3  Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
У срібно-цинковому акумуляторі катодом єцинк, а анодом – аргентум оксиди. Хімічні реакції, що відбуваються при розрядженні і заряджанні акумулятора наступні:
розряджається
Ag + Zn(OH)2  AgO + Zn + H2O.
AgO + Zn + H2O.
Електрична схема такого акумулятора має вигляд:
(-) Zn ׀ K+, OH -, AgO ׀ Ag (+).
EPС срібно-цинкового акумулятора дорівнює 1,85 В. Він має високу ємність на одиницю маси і тому останнім часом його часто використовують як автономне джерело енергії.
До акумуляторів пред’являють жорсткі технічні умови (до маси, габаритів, ємності на одиницю маси, вартості тощо), тому обмежується кількість окисно-відновних реакцій, які можна реалізувати.
Приклад 4. В яких елементах використовують перетворення енергії горіння в електричну?
Відповідь:
Останнім часом у різних країнах використовують нові джерела електричного струму - паливні елементи. В них електричний струм виникає в результаті хімічної взаємодії горючих речовин (водню, коксу, природного газу, бензину тощо) з окисниками (кисень, повітря, хлор, фтор), які безпосередньо подаються ззовні до електродів, а продукти реакції відводяться.
Технічно впроваджувати паливні елементи складно, однак дуже важливо, оскільки ККД їх ~ 100% (рис. 13.3). Прикладом може бути лужний воднево-кисневий паливний елемент, в якому здійснюється електрохімічне окиснення водню. Цей елемент складається з дрібнопористих вугільних або нікелевих електродів, занурених у лужний розчин електроліту. На електродах відбуваються такі електрохімічні процеси:
Анод 2H2 + 4OH- - 4ē= 4H2O
Катод O2 + 2H2O + 4ē = 4OH-

2H2 + O2 = 2H2O
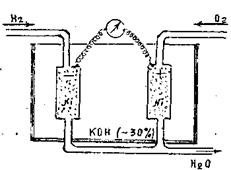
Рисунок 13.3 - Схема роботи воднево-кисневого паливного елемента
Водень дифундує крізь пористий електрод з каталізаторами (Pt, Pd, Ni), кисень - крізь другий електрод зі змішаними каталізаторами (Co, Al або Fe, Mn і Ag). ККД воднево-кисневого елемента становить 60 - 70 %.
Приклад 5. Під дією чого відбувається електроліз? Що відбувається на електродах?
Відповідь:
Електроліз - це сукупність окисно-відновних електрохімічних процесів. Вони відбуваються під впливом електричного струму на електродах, занурених у розчин або розплав електроліту. Під дією джерела струму на одному з електродів утворюється надлишок електронів ("-" електрод), на другому - нестача електронів ("+" електрод). Під час проходження електричного струму через електроліт виникає спрямований рух йонів. Катіони переміщуються до негативного електроду, аніони - до позитивного.
Йони, які перебувають поблизу негативного електроду, приймають електрони, тобто відновлюються. Електрод, на якому відбувається реакція відновлення, називають катодом. Йони, які перебувають поблизу позитивного електрода, віддають електрони, тобто окиснюються. Такий електрод називається анодом (рис. 13.4).
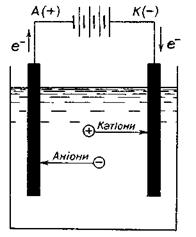
Рисунок 13.4 – Схема роботи електролізера
Приклад 6. Із яких матеріалів виготовляють електроди?
Відповідь:
Важливу роль в процесі електролізу відіграє матеріал, з якого виготовлено електроди, особливо анод, який може окислюватись. У зв'язку з цим розрізняють електроліз з інертними і активними анодами. Для інертних анодів використовують графіт, вугілля, платину, а як активні - будь-який метал.
Приклад 7. Поясніть суть електролізу водних розчинів.
Відповідь: Під час електролізу водних розчинів з інертними електродами поряд з катіонами та аніонами в електрохімічних реакціях беруть участь молекули води.
Катодні процеси.
Щоб визначити, які йони братимуть участь в катодному процесі, необхідно врахувати значення стандартних потенціалів електродів, яким відповідають йони в розчині. Тому доцільно користуватись рядом стандартних потенціалів.
Можливі наступні випадки:
1) Якщо в розчині містяться йони металів, для яких 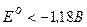 (від початку ряду активності до
(від початку ряду активності до 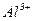 включно), то відновлюватись будуть молекули води:
включно), то відновлюватись будуть молекули води:
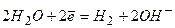
2) Якщо в розчині містяться йони металів з 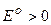 (від
(від 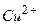 до
до 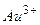 ), то вони практично повністю відновлюються. Наприклад:
), то вони практично повністю відновлюються. Наприклад:
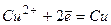
3) У розчині, що містить йони металів із значеннями стандартних потенціалів електродів металів: 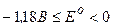 (від
(від 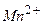 до
до 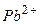 ), то відбувається одночасно два процеси - відновлення катіонів металу і молекул води:
), то відбувається одночасно два процеси - відновлення катіонів металу і молекул води:
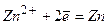
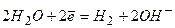
У цих паралельних процесах буде переважати перший, тобто спочатку відновлюється цинк.
Анодні процеси.
1) У реакціях на аноді можуть брати участь аніони деяких безоксигенових кислот (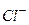 ,
, 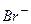 ,
, 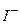 ,
, 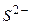 ) та гідроксид-іони
) та гідроксид-іони 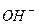 , наприклад:
, наприклад:
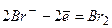
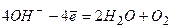
2) Якщо ж у розчині наявні аніони 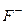 ,
, 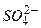 ,
, 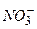 ,
, 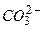 , то окиснення зазнає не аніон, а вода:
, то окиснення зазнає не аніон, а вода:
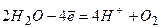
3) Під час електролізу з розчинними електродами на аноді окислюється метал. наприклад, якщо анод нікелевий:
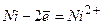
Приклад 8 Складіть рівняння електролізу водного розчину сульфатної кислоти з інертними електродами.
Відповідь: У водному розчині сульфатна кислота практично повністю дисоціює на йони:
І ступінь 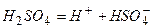
ІІ ступінь 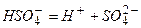
Катод (-) Анод (+)
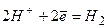
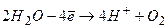
Складаємо загальне рівняння електролізу:
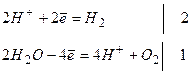
____________________________________
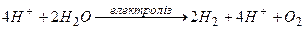
або
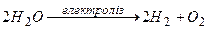
Під час електролізу розчину сульфатної кислоти розкладається вода з утворенням водню і кисню.
Приклад 9. Складіть електрохімічне рівняння реакцій електролізу розплаву натрій гідроксиду.
Відповідь:
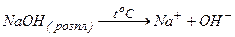
катод (-) 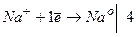
анод (+) 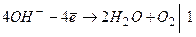
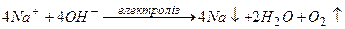
Приклад 10. Які процеси мають місце при електролізі водних розчинів в залежності від середовища?
Відповідь:
При електролізі водних розчинів залежно від середовища можуть мати місце різні процеси: для їх розуміння вони зведені у відповідну таблицю:
| Катод (-) | Середовище | Анод (+) |
2H+ + 2ē → H20
 2H2O + 2ē → H20 + 2OH-
2H2O + 2ē → H20 + 2OH-
| кисле нейтральне лужне |  2H2O → O20 + 4H+ + 4ē
4OH- → 2H2O + O20 + 4ē
2H2O → O20 + 4H+ + 4ē
4OH- → 2H2O + O20 + 4ē
|
Важливим є розуміння процесів, що мають місце на аноді і катоді при проходженні електролізу водних розчинів.
Приклад 11. Поясніть послідовність розряду йонів на катоді і аноді.
Відповідь:
Послідовність розряду йонів:
На катоді: Послідовність розряду катіонів визначається їх положенням в ряду напруг, схематично його запишемо:

Н+ (Н2О) розряджаються, тобто відновлюються накатоді при потенціалах, що відповідають положенню між Al3+ і Mn2+; Визначимо послідовність розряду катіонів на катоді при наявності йонів:
H2O Ag1+ K1+ Ni2+ Mg2+
3 1 - 2 -
В першу чергу, на катоді будуть розряджатися катіони з найбільш позитивним потенціалом, тобто Ag1+ потенціал якого становить +0,799 B; після цього відновленню підлягають йони Ni2+ потенціал якого -0,250 В і в кінцевому плані катіони водню (якщо середовище кисле), або електрохімічно відновлюються молекули води. Йони Mg2+ (потенціал -2,363 В) і K1+ (потенціал -2,924 В) не відновлюються, поскільки знаходяться лівіше від місця розряду молекул води. З вищенаведеного можна зробити висновок: при електролізі водних розчинів солей на катоді не відновлюються найбільш активні метали (від початку ряду напруг до Al включно).
На аноді: На аноді можуть розряджатися негативно заряджені групи, або нейтральні молекули, тобто окиснюватися.
Розряд відбувається в нижчезазначеній послідовності:
І S2-; C1 -; І -; Br -; OH -
тобто руйнуються аніони безоксигенових кислот;
ІІ H2O
III SO42-; СО3 2-, NO3- (оксигеновмісні аніони).
При електролізі водних розчинів аніони оксигеновмісних кислот, як правило, не розряджаються.
Визначимо послідовність окиснення відповідних аніонів:
Н2O Сl- SO42- NOз - І-
3 2 - - 1
В першу чергу розряджаються в даному випадку І- в порівнянні з йонами Сl-, як такі, що мають більший радіус йона. Після цього розряду підлягають молекули води з виділенням кисню, аніони оксигеновмісних кислот практично не розряджаються.
Послідовність розряду аніонів:
В першу чергу розряджаються аніони кислотних залишків, які не містять оксигену, тобто С l-, І -, CN -, S 2- і ін.
В другу чергу розряджаються гідроксильні йони, якщо електролізу піддається сіль оксигеновмісної кислоти, або сама кислота. Утворені при розрядці гідроксильних йонів нейтральні групи ОН тут же розкладаються згідно рівняння:
4OH- = 2H2O + O2↑
4OH- -4ē → 2H2O + O2↑
Не розряджаються йони
SO42-; CO32-; NOз – і т. д.
Приклад 12. Визначіть: а) послідовність розряду (відновлення) катіонів на катоді при наявності йонів:
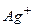
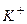
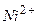

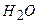
та б) розряду (окиснення) аніонів на аноді:
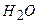
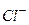
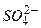
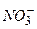
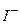
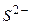
Відповідь: а) В першу чергу на катоді будуть розряджатися катіони з найбільш позитивним потенціалом, тобто 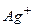 , потенціал якого становить
, потенціал якого становить 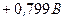 ; після цього відновленню підлягають йони
; після цього відновленню підлягають йони 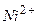 потенціал якого
потенціал якого 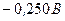 і в кінцевому плані катіони Гідрогену (якщо середовище кисле), або електрохімічно відновлюються молекули води. Йони
і в кінцевому плані катіони Гідрогену (якщо середовище кисле), або електрохімічно відновлюються молекули води. Йони  (потенціал
(потенціал 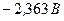 ) і
) і 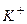 (потенціал
(потенціал 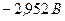 ) не відновлюються, поскільки знаходяться лівіше від місця розряду молекул води.
) не відновлюються, поскільки знаходяться лівіше від місця розряду молекул води.
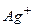
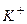
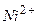

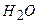
1 - 2 - 3
б) В першу чергу розряджаються, в даному випадку, йони 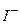 , як такі, що мають більший радіус в порівнянні з йонами
, як такі, що мають більший радіус в порівнянні з йонами 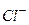 . Пізніше розряд проходить у послідовності
. Пізніше розряд проходить у послідовності 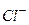 ,
, 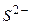 . Останніми розряджаються молекули води.
. Останніми розряджаються молекули води.
Аніони оксигеновмісних кислот практично не розряджаються.
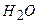
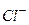
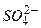
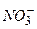
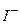
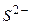
4 2 - - 1 3
Приклад 13. Зарисуйте схему і запишіть електрохімічні рівняння, що мають місце при електролізі водних розчинів CuCl2, KI, K2SO4 з інертним анодом.
Відповідь:
1. Електроліз розчину CuCl 2 з інертним анодом (рис.13.5)
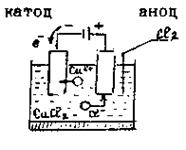
Рисунок 13.5 - Схема електролізу розчину CuCl 2 з інертним анодом
Мідь в ряді напруг розміщена після водню, тому біля катоду відбуватиметься розряд йонів і виділення металічної міді. Біля аноду розряджатимуться хлорид-іони. Схема електролізу розчину купрум (ІІ) хлориду:
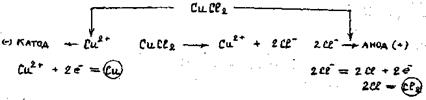
2. Електроліз розчину калій йодиду.
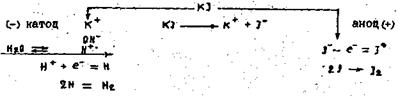
Калій знаходиться в ряду напруг набагато лівіше водню, внаслідок чого на катоді розряджаються не йони К+, а гідроген-іони з води. Атоми Гідрогену, які при цьому утворюються з’єднуються в молекулу, таким чином біля катоду виділяється водень. По мірі розряду йонів водню дисоціюють нові молекули води, внаслідок чого біля катоду утворюється надлишок гідроксильних йонів, а також йони калію, які безперервно переміщуються до катоду, внаслідок чого утворюється КОН. Біля аноду проходить виділення йоду, так як йони йоду розряджаються легше ніж гідроксильні йони води. Схема електролізу розчину калій йодиду:
3. Електроліз розчину K2SO4 з інертним анодом.
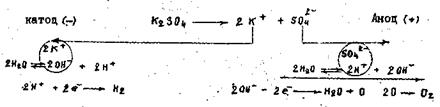
Поскільки калій в ряду напруг розміщений значно лівіше водню, то біля катоду відбуватиметься виділення водню і нагромадження гідроксильних йонів ОН -. Біля аноду виділятиметься кисень і нагромаджуються йони H+. Одночасно в прикатодний простір надходитимуть йони К+, а в анодний - йони SO42-.
Отже, розчин залишатиметься електронейтральним. Але в прикатодному просторі нагромаджується луг, а в прианодному - кислота. Схема електролізу розчину калій сульфату:
Приклад 14. Наведіть приклади електролізів розчинів NiSO4 і CuCl2 з розчинним анодом.
Відповідь:
1. Електроліз розчину NiSO4 з розчинним анодом.
Розглянемо електроліз розчину NiSO4 з нікелевим анодом (рис. 13.6).
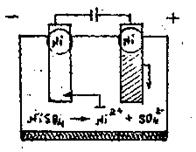
Рисунок 13.6 - Схема електролізу розчину NiSO4 з нікелевим анодом
Стандартний потенціал Ni (-0,250 В) трохи більший ніж -0,41 В, тому під час електролізу нейтрального розчину NiSO4 на катоді в основному розряджається йон Ni2+; і виділяється метал. На аноді відбуватиметься протилежний процес - окиснення металу, поскільки потенціал Ni, значно менший за потенціал окиснення води, тим більше за потенціал йону SO42-. Отже електроліз зводиться до розчинення металу аноду і виділення його на катоді:

2. Електроліз CuCl2 з мідним (розчинним) анодом.
По особливому проходить процес електролізу, якщо анод виготовлений з того ж металу, сіль якого знаходиться в розчині (рис. 13.7)

Рисунок 13.7 - Схема електролізу розчину CuCl 2 з мідним (розчинним) анодом
В цьому випадку йони не розряджаються біля аноду, але сам анод розчиняється, посилаючи в розчин йони Cu2+.
Схема електролізу:
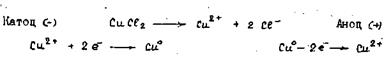
Весь процес зводиться до виділення міді Cu0 на катоді і поступового розчинення анода. Кількість CuCl2 в розчині залишається незмінною.
Приклад 15. Запишіть електрохімічні рівняння електролізу розплаву натрій хлориду та магній хлориду.
Відповідь:
Електролізом розплавів добувають метали, що мають більш негативні електродні потенціали і деякі їхні сплави.
Під час електролізу розплавів електролітів з інертними електродами на катоді завжди відновлюються катіони металу, а на аноді окиснюються аніони.
Приклад електролізу розплаву натрій хлориду:
NaCl 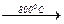 Na+ + Сl− (електроліт)
Na+ + Сl− (електроліт)
| катод (-) Na+ +ē → Na0 анод (+) 2 Сl− - 2ē → Сl2 |
2 Na+ + 2 Сl−  2 Na + Cl2
2 Na + Cl2
або
2 NaCl 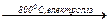 2 Na + Cl2
2 Na + Cl2
Приклад електролізу розплаву магній хлориду:
MgCl2 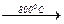 Mg2+ + 2Cl-
Mg2+ + 2Cl-
катод (-) Mg2+ +2ē → Mg0
анод (+) 2 Сl− - 2ē → Сl2
Mg2+ + 2Cl-  Mg0 + Cl2
Mg0 + Cl2
або
MgCl2  Mg + Cl2
Mg + Cl2
Тепер електролізом добувають Al, Mg, Na, Li, Be, Ca. Для добування K, Ba, Rb, Cs електроліз розплавів практично не застосовується через високу хімічну активність цих металів і велику розчинність їх у розплавлених солях. Іноді добувають електролізом тугоплавкі метали Ti, Zr, Cr та інші.
Приклад 16. Наведіть приклади використання електролізу.
Відповідь:
Процеси гальваностегії – це процеси нанесення за допомогою електролізу на поверхні металевих виробів шарів інших металів для захисту цих виробів від корозії, надання їх поверхності твердості, а також в декоративних цілях
(рис. 13.8).
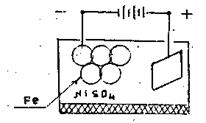
Рисунок 13.8 - Схема процесу гальваностегії
З численних гальванотехнічних процесів, що застосовуються в техніці, найважливішими є хромування і нікелювання. Суть гальванічного нанесення - добре очищену і знежирену деталь занурюють у розчин солі того металу, яким її слід покрити і приєднують як катод до кола постійного струму. Під час пропускання струму на деталі осаджується шар захисного металу. Найкращий захист створюють дрібнокристалічні щільні осади. Такі осади мають, крім того, кращі механічні властивості.
Гальванопластикою називають процеси виготовлення точних металічних копій з рельєфних предметів електроосадженням металу. За допомогою гальванопластики виготовляють матриці для пресування різних виробів (грамофонних пластинок, ґудзиків, тощо), матриці для тиснення шкіри та паперу, виготовлення радіотехнічних схем, друкарських кліше. Гальванопластику відкрив рос. академік Б.C. Якобі в 30-х роках XIX ct.
До гальванотехніки належать також інші види електрохімічної обробки поверхні металів: електрополірування сталі, оксидування алюмінію, магнію. Оксидування – це анодна обробка металів, в ході якої змінюється структура оксидної плівки на його поверхні. Це надає більшої корозійної стійкості металу. Крім того, метал набуває гарного зовнішнього вигляду.
У хімічній промисловості за допомогою електролізу добувають різні продукти - фтор, хлор, їдкий натр, H2 і O2 високої чистоти, H2O2 та багато ін.
Електролітичне виділення металу з розчину називається електроекстракцією. Руду, або збагачену руду - концентрат обробляють певними реагентами, внаслідок чого метал переходить в розчин. Після очищення від домішок розчин піддають електролізу. Метал виділяється на катоді і має високу чистоту. Цим способом добувають Zn, Cd, Co, Cr, Mn та інші.
Електролітичне рафінування застосовується для видалення з них домішок і для вилучення цінних компонентів. З металу, що підлягає очищенню, відливають пластини і ставлять їх як аноди в електролізер. При проходженні струму метал зазнає анодного розчинення - переходить у вигляді катіонів у розчин. Дані катіони металу розряджаються на катоді, утворюючи компактний осад чистого металу. Домішки, які є в аноді, або залишаються нерозчиненими і випадають у вигляді анодного шлаку, або переходять в електроліт, звідки їх видаляють.
Розглянемо електрорафінування міді: основним компонентом розчину є купрум (ІІ) сульфат, вказаний розчин має низьку електропровідність. Щоб збільшити її до розчину добавляють і деякі інші добавки, що сприяють утворенню компактного осаду. Металічні домішки, що є в неочищеній "чорновій міді" множна розділити на дві групи:
1. Fe, Co, Ni, Zn, які мають більш негативні електродні потенціали ніж мідь. Тому вони анодно розчиняються разом з міддю, але не осаджуються на катоді, а нагромаджуються в електроліті у вигляді сульфатів. У зв’язку з цим електроліт періодично змінюють.
2. Au, Ag, Pb, Sn мають дещо більш позитивні електродні потенціали. Благородні метали (Au, Ag) не зазнають анодного розчинення, а під час процесу осідають біля анода, утворюючи анодний шлам. Олово і свинець розчиняються разом з міддю, але в електроліті утворюють малорозчинні сполуки, що випадають в осад. Електролітичним способом рафінують Cu, Ni, Pb, Sn, Au, Mg
Розглянемо електрохімічний метод очищення чорнової міді, яка містить нижчезазначені домішки (рис.13.9):
- більш активних металів: Fe, Co, Ni, Zn...
- менш активних металів: Au, Ag, Pb, Sn...
На аноді безперечно в першу чергу окиснюються метали з найбільш від’ємним електродним потенціалом, тобто Ni;. На катоді відновлюватимуться йони металу з найбільш позитивним потенціалом, тобто Cu2+ (рис 13.9);
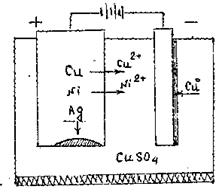
Рисунок 13.9 – Схема електрохімічного методу очищення чорнової міді
+: Ni0 → Ni2+ + 2ē
Cu0 → Cu2+ + 2ē
-: Cu2+ + 2ē → Cu0
Срібло випадає в осад у вигляді анодного шламу.
Приклад 17. Дайте визначення поняття „хімічної та електрохімічної корозії”. Наведіть приклади.
Відповідь:






