Відповідь:
Дано:
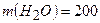 г г
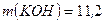 г г
 г/мл г/мл
| Розв’язок:
1. Обчислюємо масу добутого розчину:
 г
2. Визначаємо об’єм цього розчину: г
2. Визначаємо об’єм цього розчину:
 ; ;
 мл=0,203 л. мл=0,203 л.
|
Знайти:
 -? -?
|
3. Обчислюємо кількість речовини калій гідроксиду, який міститься в розчині:

де  г/моль.
г/моль.
4. Молярна концентрація розчину 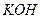 визначається:
визначається:
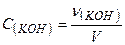 ;
;
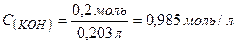
Приклад 19. Який об’єм 2 М розчину NaCl потрібен для одержання 2 л 5% розчину густиною 1,05 г/мл.
| Дано: V 5% NaCl = 2 л ρ = 1,05 г/мл | Розв’язок: Обчислюємо масу добутого розчину: m = 2000 ∙ 1,05 = 2100 г Визначаємо масу NaCl у розчині: m = 2100 ∙ 5% = 105 г. Визначаємо кількість речовини NaCl у одержаному розчині: M (NaCl) = 58,5 г/моль, ν (NaCl) = 105 г/58,5г/моль = 1,79 моль. |
| Знайти: V2M NaCl -? |
Визначаємо об’єм 2М розчину, у якому міститься така кількість NaCl:
V2M = ν (NaCl)/C(NaCl) = 1,79/2 = 0,895 л = 895 мл.
Приклад 20. Як називається добуток концентрацій йонів малорозчинного електроліту у насиченому розчині при певній температурі.
Відповідь:
Для малорозчинної сполуки, яка перебуває у рівновазі зі своїм насиченим розчином, рівняння динамічної рівноваги матиме вигляд
KmAn ↔ mKn+ + nАm-.
Осад Розчин
Згідно з законом діючих мас, константа рівноваги цієї реакції:

де [KmAn] – концентрація речовини в осаді, яка не залежить від кількості твердої фази. Оскільки [KmAn] = const, то і
K ∙ [KmAn] = const, а отже і [Kn+]m[ Аm-]n = const.
Отже, у насиченому при певній температурі розчині добуток концентрацій йонів малорозчинного електроліту є сталою величиною, яка називається добутком розчинності (ДР). Наприклад, для малорозчинного у воді купрум (ІІ) гідроксиду маємо:
Cu(OH)2 ↔ Cu2+ + 2OH−;
ДР(Cu(OH)2) = [Cu2+][OH−]2 = 6 ∙ 1020 (моль/л)3.
Значення ДР погано розчинних у воді сполук можна обчислити за їх розчинністю або електропровідністю розчинів. Оскільки ДР сполуки за певної температури є сталою величиною, то збільшення концентрації одного з йонів, на які дисоціює сполука, зменшує концентрацію іншого. Введення однойменних йонів у розчин малорозчинного електроліту знижує його розчинність.
Умови виділення і розчинення осаду:
• якщо [Kn+]m[ Аm-]n < ДР, то розчин ненасичений і осад розчиняється;
• якщо [Kn+]m[ Аm-]n = ДР, то розчин насичений і система перебуває в рівновазі;
• якщо [Kn+]m[ Аm-]n > ДР, то розчин пересичений і відбувається випадання осаду.
Приклад 21. ДР BaF2 при 18 0С дорівнює 1,7∙10-6. Обчисліть концентрацію йонів Ba2+ i F− у насиченому розчині при даній температурі.
| Дано: ДР (BaF2) = 1,7∙10-6 | Розв’язок: BaF2 ↔ Ba2+ + 2 F− Відповідно до рівняння дисоціа ці ї C(F-) = 2 C(Ba2+) Тоді ДР (BaF2) = C(Ba2+) ∙ [2 C(Ba2+)]2 = 4 [C(Ba2+)]3 |
| Знайти: C(Ba2+) -? C(F-) -? |

C(F-) = 2 C(Ba2+) = 1,5∙10-2 моль/л
Приклад 22. Змішали 200 мл 0,02 М розчину СаCl2 та 100 мл 0,01 М розчину Na2SO4. Чи випаде осад?
ДР (CaSO4) = 1,3∙104‑.
| Дано: C (CaCl2) = 0,02 M C (Na2SO4) = 0,01 M ДР (CaSO4) = 1,3∙10-4 | Розв’язок: CaCl2 + Na2SO4 = CaSO4 ↓+ 2 NaCl Як було зазначено вище, осад випадатиме, якщо C(Ca2+)∙C(SO42-) > ДР Визначаємо молярні концентрації відповідних йонів у вихідних розчинах: C(Ca2+) = C (CaCl2) = 0,02 моль/л C(SO42-) = C (Na2SO4) = 0,01 моль/л |
| Знайти: Чи випаде осад? |
Визначаємо кількості речовин даних йонів у вихідних розчинах:
ν (Ca2+) = 0,02 моль/л∙0,2 л = 0,004 моль;
ν (SO42-) = 0,01 моль/л∙0,1 л = 0,001 моль.
Визначаємо об’єм одержаного розчину:
V = 0,1 + 0,2 = 0,3 л.
Визначаємо відповідні концентрації у одержаному розчині:
C(Ca2+) = 0,004 моль/0,3 л = 0,013 моль/л;
C(SO42-) = 0,001 моль/0,3 л = 0,003 моль/л.
Визначаємо добуток концентрацій і порівнюємо з ДР:
C(Ca2+)∙C(SO42-) = 0,013 ∙ 0,003 = 4,3∙10-5 < ДР.
Отже, осад не випаде.
Приклад 23. Визначити рН 0,005М розчину Н2SO4.
| Дано: C (Н2SO4) = 0,005 M | Розв’язок: Н2SO4 ↔ 2 Н+ + SO42 - рН = -lg [Н+] Визначаємо молярну концентрацію йонів Н+. Оскільки при дисоціації 1 молекули кислоти утворюється 2 йони Н+, то [Н+] = 2 ∙ C (Н2SO4) = = 2 ∙ 0,005 = 0,01 моль/л рН = -lg(0,01) = 2 |
| Знайти: рН –? |
Приклад 24. Визначити рН 0,001М розчину NaOH.
| Дано: C (NaOH) = 0,001 M | Розв’язок: NaOH ↔ Na+ + OH - рН = -lg [Н+] Визначаємо молярну концентрацію йонів Н+. Оскільки [Н+][ОН-] = 10-14, то [ Н+] = 10-14/[ОН-]. Концетрація йонів ОН-, згідно рівняння дисоціації, рівна C (NaOH). [ ОН-] = C (NaOH) = 0,001 моль/л [ Н+] = 10-14/0,001 = 10-11 моль/л рН = -lg(10-11) = 11 |
| Знайти: рН –? |






