ѕриклад 1. як≥ системи називаютьс€ розчинами? « €ких компонент≥в вони складаютьс€? (ƒив. додаток ƒ).
¬≥дпов≥дь:
–озчин Ц це гомогенна система з молекул, йон≥в чи ≥нших частинок, складена двома ≥ б≥льше компонентами, к≥льк≥сн≥ сп≥вв≥дношенн€ €ких можуть зм≥нюватись в широких межах.
ќдн≥Їю з головних умов, коли дану систему називають розчином Ї њњ ст≥йк≥сть, тобто неможлив≥сть розд≥ленн€ на складов≥ компоненти при довгому сто€нн≥. ≤ншою ознакою розчин≥в Ї можлив≥сть зм≥нювати в широких межах њх х≥м≥чний склад не зм≥нюючи агрегатного стану. ≤снують газов≥, р≥дк≥ ≥ тверд≥ розчини.
–озчини займають пром≥жне положенн€ м≥ж механ≥чними сум≥шами частинок ≥ ≥ндив≥дуальними х≥м≥чними сполуками. ¬≥д сум≥шей розчини в≥др≥зн€ютьс€ тим, що будь-€кий м≥кроскоп≥чний обТЇм розчину маЇ такий же склад, €к ≥ вс€ маса розчину. Ќа в≥дм≥ну в≥д х≥м≥чних сполук розчини мають зм≥нний склад ≥ не п≥дл€гають закону кратних в≥дношень.
–озчини складаютьс€ ≥з компонент≥в. ќдин з них називаЇтьс€ розчинником, ≥нший - розчиненою речовиною (розчинених речовин в розчин≥ може бути €к завгодно багато).
–озчинником умовно вважають компонент, агрегатний стан €кого не зм≥нюЇтьс€ при утворенн≥ розчину ≥ вм≥ст €кого переважаЇ в дан≥й систем≥.
Ќаприклад, пов≥тр€ Ц це розчин кисню, карбон (≤V) оксиду, вод€них пар≥в, ≥нертних та ≥нших газ≥в в азот≥, поск≥льки його вм≥ст в пов≥тр≥ складаЇ 78%.
ѕриклад 2. як≥ розчини називаютьс€ насиченими, ненасиченими, перенасиченими?
¬≥дпов≥дь:
–озчин, у €кому речовина б≥льше не розчин€Їтьс€ за даноњ температури, називаЇтьс€ насиченими.
Ќаприклад, у вод≥ масою 100 г при t0 = 200C розчин€Їтьс€ натр≥й хлорид масою 36 г. Ѕ≥льше натр≥й хлориду в такому обТЇм≥ води розчинитис€ не може, тобто маЇмо насичений розчин.
–озчин, у €кому речовина ще може розчинитис€ за даноњ температури, називаЇтьс€ ненасиченим.
Ќаприклад, €кщо у вод≥ масою 100 г розчинити натр≥й хлорид масою 20 г при t0 = 200C, утворитьс€ ненасичений розчин. ” цьому розчин≥, за такоњ ж температури, може ще розчинитис€ ц€ с≥ль масою 16 г.
ѕон€тт€ Днасичен≥Ф ≥ Дненасичен≥ розчиниФ не сл≥д ототожнювати з пон€тт€м Дконцентрован≥Ф ≥ Дрозведен≥ розчиниФ. ≤снуЇ багато малорозчинних речовин, насичен≥ розчини €ких мають низьку концентрац≥ю розчиненою речовини (наприклад з —а(ќЌ)2, —аSO4 тощо).
ƒл€ де€ких речовин можна отримати розчини, концентрац≥€ €ких за даноњ температури вища, н≥ж концентрац≥€ насиченого розчину. “ак≥ розчини називаютьс€ перенасиченим. ¬они нест≥йк≥, ≥ €кщо внести в такий розчин центр кристал≥зац≥њ (кристалик розчиненоњ речовини, пил тощо), надлишок розчиненоњ речовини викристал≥зуЇтьс€. ÷е в≥дбуваЇтьс€ тому, що швидк≥сть вид≥ленн€ речовини з розчину б≥льша за швидк≥сть розчиненн€.
Ќаприклад, за нагр≥ванн€ можна одержати досить концентрований розчин натр≥й ацетату, в≥дд≥лити його в≥д твердоњ фази ≥ обережно охолодити, п≥сл€ чого концентрац≥€ сол≥ буде б≥льшою, н≥ж в насиченому розчин≥, але њњ надлишок з розчину не вид≥л€Їтьс€.
ѕеренасичен≥ розчини часто застосовують дл€ очищенн€ речовин (метод перекристал≥зац≥њ).
|
|
|
ѕриклад 3. який процес називаЇтьс€ розчинн≥стю?
¬≥дпов≥дь:
¬ природ≥ немаЇ абсолютно нерозчинних речовин. ¬ластив≥сть речовини розчин€тись в даному розчиннику за даних умов (температур≥, тиску) чисельно характеризуЇтьс€ розчинн≥стю.
–озчинн≥сть Ц це максимальна маса речовини, €ка може розчин€тись в 100 г, розчинника.
ѕри розчинност≥ вс≥ речовини д≥л€ть на три групи. якщо в 100 г води розчин€Їтьс€ б≥льше 10 г, то така речовина називаЇтьс€ добре розчинною ≥ позначаЇтьс€ в таблиц≥ розчинност≥ Д р Ф.
якщо в 100 г води розчин€Їтьс€ менше 1 г речовини Ц малорозчинною (м), а коли розчин€Їтьс€ менше 0,01 г речовини Ц нерозчинною (н).
≥льк≥сною характеристикою розчинност≥ речовин Ї коеф≥ц≥Їнт розчинност≥. оеф≥ц≥Їнтом розчинност≥ називаЇтьс€ в≥дношенн€ маси речовини, €ка утворюЇ при дан≥й температур≥ насичений розчин, до обТЇму розчинника: 

де Ks Ц коеф≥ц≥Їнт розчинност≥;
mp Ц маса речовини, €ка утворюЇ насичений при дан≥й температур≥ розчин;
V Ц обТЇм розчинника.
ƒл€ водних розчин≥в:

де m (H2O) Ц маса води.
–озчинн≥сть залежить в≥д температури, тому коеф≥ц≥Їнти розчинност≥ будуть справедлив≥ т≥льки певним температурам. Ќаприклад, €кщо при 60˚— в 100 г води може розчинитис€ 61 г MgCl2, то й коеф≥ц≥Їнт розчинност≥ дор≥внюЇ:
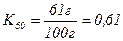 (величина безрозм≥рна).
(величина безрозм≥рна).
ѕриклад 4. ƒайте визначенн€ пон€тт€ Дступ≥нь дисоц≥ац≥њФ. як розд≥л€ють електрол≥ти за ступенем дисоц≥ац≥њ?
¬≥дпов≥дь:
—туп≥нь дисоц≥ац≥њ Ц визначаЇтьс€ сп≥вв≥дношенн€м концентрац≥й т≥Їњ частки електрол≥ту, що зазнала розпаду на йони, до загальноњ його концентрац≥њ:

де α Ц ступ≥нь дисоц≥ац≥њ;
Nдис . Ц молекули, що розпалис€ на йони;
N Ц вих≥дне число розчинених молекул.
—туп≥нь дисоц≥ац≥њ виражаЇтьс€ у в≥дсотках, чи числом в≥д 0 до 1. Ќаприклад, дл€ 0,001ћ водних розчин≥в кислот ступ≥нь дисоц≥ац≥њ маЇ так≥ значенн€:
хлоридна (HCl) Ц 0,993 або 99,3%
сульфатна (H2SO4)Ц 0,960 або 96,0%
оцтова (CH3COOH) Ц 0,126 або 12,6%
ц≥ан≥дна (HCN) Ц 0,0011 або 0,11%
«а величиною ступен€ дисоц≥ац≥њ електрол≥ти под≥л€ють на сильн≥ (α близько 100%), слабк≥ (α менше 5%).
| –ечовини | —ильн≥ електрол≥ти | —лабк≥ електрол≥ти |
| ислоти | H2SO4, HNO3, HCl, HBr, HI, HClO4, HMnO4, H2SeO4, H2TeO4 | ќрган≥чн≥ кислоти, HCN, H2S, H2SiO3, H2CO3 |
| ќснови | Ћуги (г≥дроксиди елемент≥в ≤ ј та ≤≤ ј п≥дгруп кр≥м Be(OH)2 Mg(OH)2), TlOH | NH3∙H2O(NH4OH); основи d-елемент≥в (зокрема Fe(OH)3, Cr(OH)3, Cu(OH)2); основи p-елемент≥в (Al(OH)3, Bi(OH)3, Sn(OH)2) |
| —ол≥ | ћайже вс≥ | Hg2Cl2, Fe(NCS)3, Pb(CH3COO)2 |
≤нод≥ вид≥л€ють пром≥жну групу речовин Ц це електрол≥ти середньоњ (пром≥жноњ) сили (α ~3-5%). ƒо них в≥днос€ть: розчини HNO2, HF, H2Sќ3, H3PO4, Ќ–ќ3, Ca(OH)2.
“ак≥й розпод≥л Ї досить умовним, оск≥льки ступ≥нь дисоц≥ац≥њ залежить в≥д багатьох фактор≥в: в≥д природи розчинника, температури, концентрац≥њ розчину. “ак, чим б≥льше розведенн€, тим б≥льшим стаЇ ступ≥нь дисоц≥ац≥њ.
ѕриклад 5. „ому дор≥внюють константи електрол≥тичноњ дисоц≥ац≥њ сильних ≥ слабких електрол≥т≥в?
¬≥дпов≥дь:
≈лектрол≥тична дисоц≥ац≥€ - це р≥вноважний процес, €кий можна характеризувати константою електрол≥тичноњ р≥вноваги.
ƒл€ прикладу дисоц≥ац≥њ слабкого електрол≥ту амон≥й г≥дроксиду константу електрол≥тичноњ дисоц≥ац≥њ можна записати так:
|
|
|
NH4OH ↔ NH4+ + ќЌ-
зв≥дки:
д = 

де [NH4+] ≥ [OH−] - концентрац≥њ йон≥в, моль/л.
„им б≥льше значенн€ Kд - тим краще електрол≥т розпадаЇтьс€, на йони. ƒл€ даного електрол≥ту значенн€ K пост≥йне при певн≥й температур≥ ≥ не залежить в≥д концентрац≥њ.
—ильн≥ електрол≥ти мають K > 10-1, слабк≥ - електрол≥ти мають значенн€ K < 10-3.
“ак дл€ CH3COOH (t = 250C) Kд = 1,75 ∙ 10-5 вказуЇ на те, що оцтова кислота - слабкий електрол≥т. ƒл€ —а(ќЌ)2 (t = 250C) д = 4,0 ∙ 10 -2 - електрол≥т середньоњ сили, €кий швидше можна в≥днести до сильних електрол≥т≥в.
Ѕагатоосновн≥ кислоти ≥ основи дисоц≥юють стад≥йно. ¬≥дпов≥дно, дл€ кожноњ стад≥њ р≥вноважного стану ≥снують своњ значенн€ константи дисоц≥ац≥њ. “ак дл€ ортофосфатноњ кислоти Ќ3–ќ4:
≤ стад≥€ Ќ3–ќ4 ↔ H+ + H2PO4 -
1 =  = 7,1 ∙ 10-3
= 7,1 ∙ 10-3
ѕ стад≥€ H2PO4- ↔ H+ + HPO42 -
2 =  = 6,2 ∙ 10-8
= 6,2 ∙ 10-8
≤ѕ стад≥€ HPO42 - ↔ H+ + PO43-
3 =  = 4,4 ∙ 10-13
= 4,4 ∙ 10-13
онстанта дисоц≥ац≥њ багатоосновноњ кислоти дл€ вс≥х стад≥й р≥вна добутку констант њњ окремих стад≥й. Ќаприклад, дл€ Ќ3–ќ4 д р≥вна:
д = 1 ∙ 2 ∙ 3
як видно ≥з значень констант дисоц≥ац≥њ дл€ ортофосфатноњ кислоти (≥ дл€ ≥нших багатоосновних кислот) кожне наступне значенн€ в≥др≥зн€Їтьс€ в≥д попереднього ~ в 105 раз.
ѕор≥внюючи величини Kд р≥зних стад≥й даЇ можлив≥сть говорити про те, що дл€ ортофосфатноњ кислоти (≥ дл€ ≥нших багатоосновних кислот) дисоц≥ац≥€ прот≥каЇ в основному по перш≥й стад≥њ.
“аке ж сп≥вв≥дношенн€ м≥ж Kд характерне ≥ дл€ основ.
ѕриклад 6. як розраховуЇтьс€ водневий показник?
¬≥дпов≥дь:
„иста вода за звичайних умов в мал≥й м≥р≥ проводить електричний струм. ѕриблизно лише одна з 10 млн. молекул дисоц≥юЇ на йони:
Ќ2ќ ↔ Ќ+ + ќЌ- ΔЌ = 57,3 кƒж
онстанта дисоц≥ац≥њ води: д =  = 1,8∙10-16 (за температури 298 ).
= 1,8∙10-16 (за температури 298 ).
¬насл≥док незначноњ дисоц≥ац≥њ можна вважати, що концентрац≥€ недисоц≥йованоњ частини молекул Ќ2ќ Ї сталою. –озраховуЇмо [ Ќ2ќ ], прийн€вши до уваги, що маса 1 л води ~ 1000 г:
[ Ќ2ќ] = 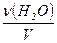 =
= 
ѕеренесемо стал≥ члени у вираз≥ константи дисоц≥ац≥њ в л≥ву частину:
∙ [H2O] = [H+] ∙ [OH-]
÷е означаЇ, що за певноњ температури добуток ∙ [H2O] Ї сталою величиною. «а 298 в≥н дор≥внюЇ
1,8 ∙ 10-16 ∙ 55,56 = 10-14 ≥ називаЇтьс€ йонним добутком води в:
в = [H+] ∙ [OH-] = 10-14
…онний добуток залежить в≥д температури. «а нагр≥ванн€, зг≥дно з принципом Ће ЎательЇ, посилюЇтьс€ процес утворенн€ йон≥в.
ƒл€ х≥м≥чно чистоњ (дистильованоњ) води:
[H+] = [OH-] = 10-7 моль/л
¬одневий показник Ц це в≥дТЇмний дес€тковий логарифм концентрац≥њ кат≥он≥в √≥дрогену:
рЌ = -lg[H+]
¬одневий показник використовуЇтьс€ дл€ визначенн€ кислотност≥ середовища:
Ўкала рЌ
|
|
|
|


|
|
|

Ќа практиц≥` дл€ визначенн€ рЌ середовища використовують ≥ндикатори та спец≥альн≥ вим≥рювальн≥ йоном≥ри (рЌ -метри).
ѕриклад 7. ўо таке йон г≥дроксон≥ю ≥ €к в≥н утворюЇтьс€? який тип звТ€зку в цьому йон≥?
¬≥дпов≥дь:
…он г≥дроксон≥ю  - це г≥драт йона √≥дрогену, €кий утворюЇтьс€ при дисоц≥ац≥њ молекул кислоти у вод≥. “ип звТ€зку в йон≥ г≥дроксон≥ю - донорно-акцепторний. —хема утворенн€ йону г≥дроксон≥ю:
- це г≥драт йона √≥дрогену, €кий утворюЇтьс€ при дисоц≥ац≥њ молекул кислоти у вод≥. “ип звТ€зку в йон≥ г≥дроксон≥ю - донорно-акцепторний. —хема утворенн€ йону г≥дроксон≥ю:  .
.
ѕриклад 8. Ќапиш≥ть р≥вн€нн€ процес≥в дисоц≥ац≥њ ортофосфатноњ кислоти, кал≥й г≥дроксиду ≥ алюм≥н≥й сульфату.
¬≥дпов≥дь:
Ѕагатоосновн≥ кислоти дисоц≥юють ступ≥нчасто:


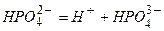
ал≥й г≥дроксид дисоц≥юЇ на йон ал≥ю ≥ г≥дроксид-≥он:

јлюм≥н≥й сульфат дисоц≥юЇ за схемою:

ѕриклад 9. Ќапиш≥ть р≥вн€нн€ процес≥в дисоц≥ац≥њ цинк г≥дроксиду, кал≥й г≥дрогенсульфату ≥ магн≥йг≥дроксо н≥трату.
¬≥дпов≥дь:
а) дисоц≥ац≥€ цинк г≥дроксиду
ƒисоц≥ац≥€ амфотерних електрол≥т≥в можлива по м≥сц€х обох звТ€зк≥в. Ќаприклад:
|
|
|


б) дисоц≥ац≥€ кал≥й г≥дрогенсульфату
ѕри дисоц≥ац≥њ кислих солей, складн≥ ан≥они кислотного залишку розкладаютьс€ (дисоц≥юють) з утворенн€м йон≥в  :
:

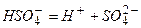
в) дисоц≥ац≥€ магн≥йг≥дроксо н≥трату
ѕри дисоц≥ац≥њ основних солей утворюютьс€ складн≥ кат≥они, здатн≥ дисоц≥ювати з утворенн€м г≥дроксид-≥он≥в


ѕриклад 10. ƒано розчини, €к≥ м≥ст€ть йони 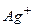 ,
,  ,
,  ,
,  . «а допомогою €ких реакц≥й можна визначити ц≥ розчини? Ќапиш≥ть р≥вн€нн€ реакц≥й.
. «а допомогою €ких реакц≥й можна визначити ц≥ розчини? Ќапиш≥ть р≥вн€нн€ реакц≥й.
¬≥дпов≥дь:
–озчин, €кий м≥стить йони 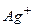 , можна визначити, доливаючи до нього розчин натр≥й хлориду. ѕри цьому випадаЇ б≥лий осад аргентум хлориду
, можна визначити, доливаючи до нього розчин натр≥й хлориду. ѕри цьому випадаЇ б≥лий осад аргентум хлориду

–озчин, €кий м≥стить йони  , можна визначити за допомогою розчину бар≥й хлориду. ѕри цьому випадаЇ б≥лий осад бар≥й сульфату
, можна визначити за допомогою розчину бар≥й хлориду. ѕри цьому випадаЇ б≥лий осад бар≥й сульфату







