Розчин, який містить йон  , можна визначити, доливаючи до нього розчин аргентум нітрату
, можна визначити, доливаючи до нього розчин аргентум нітрату  , при цьому виділяється жовтий осад аргентум йодиду
, при цьому виділяється жовтий осад аргентум йодиду

Приклад 11. Як можна приготувати розчин із заданою масовою часткою розчиненої речовини?
Відповідь:
Для того щоб приготувати розчин із масовою часткою розчиненої речовини 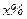 , потрібно х г речовини розчинити в
, потрібно х г речовини розчинити в 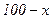 г води.
г води.
Приклад 12. В 500 г розчину, насиченого при 20 °С, міститься 120 г калій нітрату. Визначіть розчинність цієї солі.
Відповідь:
Дано:
  г г
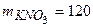 г г

| Розв’язок:
1. Визначаємо масовий вміст розчину 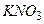 В 500 г розчину міститься 120 г
В 500 г розчину міститься 120 г 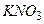 і 380 г і 380 г 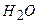 2. Обчислюємо розчинність
2. Обчислюємо розчинність 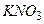 при температурі 20 °С.
В 380 г при температурі 20 °С.
В 380 г 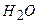 розчинилось 120 г розчинилось 120 г 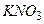
|
Знайти:
розчинність 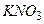 -? -?
|
100 г 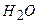 - х
- х

Відповідь: розчинність 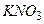 - 31,6 г
- 31,6 г
Приклад 13. Коефіцієнт розчинності натрій броміду дорівнює 16,8 (температура 20 °С). Обчисліть масову частку натрій броміду в його насиченому розчині при температурі 20 °С.
Дано:
 г г
 г г
| Розв’язок:
1. Обчислюємо масу насиченого розчину натрій броміду, який містить воду масою 100 г
 2. Обчислюємо масову частку
2. Обчислюємо масову частку  в насиченому при температурі 20 °С розчині в насиченому при температурі 20 °С розчині
|
Знайти:
 -? -?
|

 або 14,4%
або 14,4%
Відповідь:  або 14%.
або 14%.
Приклад 14. Насичений при 100°С розчин калій хлориду масою 156 г охолодили до 10°С. Обчислити масу калій хлориду, який викристалізувався. Коефіцієнти розчинності калій хлориду становлять 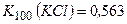 ;
;  .
.
Дано:
 г г

| Розв’язок:
1. Щоб розрахувати масу солі, яка викристалізується при охолодженні розчину, потрібно знайти різницю мас 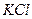 , що знаходиться в розчині при 100°С і 10°С.
Коефіцієнт розчинності для водних розчинів визначається як відношення маси речовини , що знаходиться в розчині при 100°С і 10°С.
Коефіцієнт розчинності для водних розчинів визначається як відношення маси речовини  , що утворює насичений при даній температурі розчин, до маси води , що утворює насичений при даній температурі розчин, до маси води  : :
|
Знайти:
 -? -?
|

2. Приймаємо, що маса калій хлориду в насиченому розчині дорівнює  г, тоді маса води становить156-
г, тоді маса води становить156-  .
.
3. Складаємо і розв’язуємо рівняння
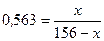

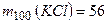 г
г
4. Обчислюємо масу води:
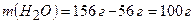
5. Визначаємо масу калій хлориду, який розчиняється у воді при 10°С:
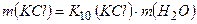

6. Знаходимо масу калій хлориду, що викристалізувався:

Відповідь: викристалізується 12,4 г калій хлориду.
Приклад 15. До розчину об’ємом 2 л з масовою часткою нітратної кислоти 60% і густиною 131 г/см3 долили 1400 мл води. Яка масова частка нітратної кислоти в одержаному розчині?
Дано:

 г/см3 г/см3


| Розв’язок:
1. Обчислюємо масу 2 л розчину кислоти:
 2. Визначаємо масу одержаного розчину:
2. Визначаємо масу одержаного розчину:
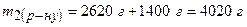 3. Обчислюємо масу нітратної кислоти в розчині, який має масу 2620 г:
3. Обчислюємо масу нітратної кислоти в розчині, який має масу 2620 г:
|
Знайти:
 -? -?
|
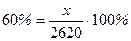
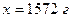
4. Розраховуємо масову частку нітратної кислоти в одержаному розчині:
 або 39,1%
або 39,1%
Відповідь: масова частка нітратної кислоти в одержаному розчині 39,1%.
Приклад 16. Маємо розчини калію гідроксиду з масовими частками 16 і 30%. Обчисліть масу кожного розчину, яку потрібно взяти для приготування розчину масою 600 г з масовою часткою 20%
Дано:
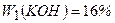

 г г

| Розв’язок:
1. Скористаємося для розв’язання цієї задачі правилом змішування. Запишемо одну під одною масові частки вихідних розчинів, а посередині і праворуч від них – масову частку розчину, який потрібно приготувати:
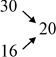
|
Знайти:
 -? -?  -? -?
|
2. Від більшої масової частки віднімаємо задану і запишемо результат знизу праворуч; від заданої масової частки віднімаємо меншу і запишемо результат зверху праворуч:
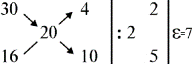
Числа 2 і 5 показують, в якому масовому співвідношенні потрібно взяти розчини.
3. Обчислюємо необхідну масу першого розчину, який має 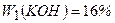


4. Обчислюємо масу другого розчину, який має 

Відповідь: необхідно взяти маси 171,43 г (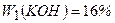 ) і 428,57 г (
) і 428,57 г ( ).
).
Приклад 17. На що вказує кількісна характеристика розчинності – молярна концентрація (молярність)?
Відповідь:
Молярність визначається числом молей розчиненої речовини в 1 л розчину. Як відомо, маса одного моля речовини в грамах чисельно рівна відносній атомній або відносній молекулярній масі цієї речовини. Молярну масу найчастіше позначають буквою  . Наприклад,
. Наприклад,  г/моль,
г/моль,  г/моль,
г/моль,
 г/моль.
г/моль.
Основною одиницею молярної концентрації в системі СІ є моль в кубічному метрі (моль/м3). Проте частіше застосовують таку одиницю, як моль в літрі /моль/л/. Отже, молярна концентрація показує кількість розчиненої речовини, яка знаходиться в 1 л розчину.
Молярну концентрацію в більшості випадків позначають буквами  , а після конкретного числового значення великою буквою
, а після конкретного числового значення великою буквою  . Наприклад:
. Наприклад:  моль/л або
моль/л або 
 чи 3
чи 3 
 - це форми запису молярної концентрації розчину їдкого натру, який містить 3 молі
- це форми запису молярної концентрації розчину їдкого натру, який містить 3 молі  ; або 120 г
; або 120 г  (враховуючи, що молекулярна маса
(враховуючи, що молекулярна маса  (г) /
(г) /  ) в 1 літрі розчину.
) в 1 літрі розчину.
Розчини з вмістом в 1 л розчину 0,1 моль, 0,01 моль, 0,001 моль – називають, відповідно деци -, санти – та мілімолярними розчинами.
Коли відома маса речовини ( ) в 1 л розчину, то молярну концентрацію зручно обчислювати за формулою:
) в 1 л розчину, то молярну концентрацію зручно обчислювати за формулою:

де  - молярна маса речовини
- молярна маса речовини 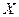 .
.
В загальному вигляді молярна концентрація речовини 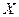 - це відношення кількості речовини
- це відношення кількості речовини 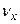 (в молях) до об’єму
(в молях) до об’єму 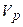 розчину:
розчину: 
де 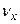 - кількість молей речовини
- кількість молей речовини 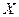 .
.






