Зміст закону Гесса можна вивести із ентальпійної діаграми:
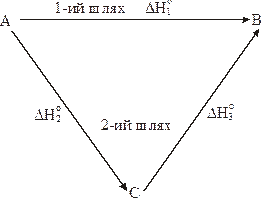
Речовина А перетворюється в речовину В двома шляхами.
Шлях 1. безпосереднє перетворення з тепловим ефектом ΔН1.
Шлях 2. спочатку А перетворюється в С (ΔН2), а потім речовина С - в В (ΔН3). Згідно закону Гесса:
ΔН1 = ΔН2 + ΔН3
Ентальпійна діаграма.
Розглянемо закон Гесса на прикладах.
Приклад 1.
Зміна величини ентальпії реакції згорання метану з утворенням карбон (IV) оксиду і рідкої води можна вирахувати за значенням ΔН в стадії конденсації водяного пару і ΔН в стадії згоряння метану з утворенням газоподібної води:
CH4(г) + 2О2(г) → СО2(г) + 2Н2О(г) (1) ΔН = - 802 кДж
2Н2О(г) → 2Н2О(р) (2) ΔН = - 88 кДж
CH4(г) + 2О2(г) + 2Н2О(г) → СО2(г) + 2Н2О(р) + 2Н2О(г) (3)
ΔН = - 890 кДж
Вилучаємо із лівої і правої частини рівняння (3) 2Н2О(г) одержимо сумарне рівняння:
CH4(г) + 2О2(г) → СО2(г) + 2Н2О(р) ΔН = - 890 кДж
Приклад 2.
Розглянемо три способи утворення плюмбум (ІІ) сульфату із свинцю, сірки і кисню.
1. Змішують свинець із сіркою і прожарюють в атмосфері кисню до утворення плюмбуму (ІІ) сульфату
Pb(тв) + S(ромб) + 2О2(г) = Pb SО4(тв)
ΔН = - 918,39 кДж
2. Із свинцю добувають плюмбум (ІІ) оксид, а із сірки – сульфур (VІ) оксид. Визначають теплові ефекти кожної реакції. Вимірюють тепловий ефект взаємодії цих оксидів з утворенням сульфату.
Pb(т) + 1/2О(г) = PbО(тв) Δ Н1 = - 217,86 кДж
S(ромб) + 3/2О2 (г) = SО3(г) Δ Н2 = - 395,18 кДж
PbО(т) + SО3(г) = PbSО4(т) Δ Н3 = - 305,35 кДж
Тепловий ефект реакції дорівнює:
Δ Н = Δ Н1 + Δ Н2 + Δ Н3
Δ Н = - 613,04 + (- 305,35) = - 918,39 кДж
Розрахунки свідчать, що тепловий ефект утворення плюмбум (ІІ) сульфату не залежить від шляху, яким відбувається реакція (тобто від кількості стадій).
Із закону Гесса можна зробити важливі висновки:
· якщо здійснити дві реакції, в результаті яких з двох різних вихідних речовин утворюються дві однакові кінцеві речовини, то різниця теплових ефектів дорівнює тепловому ефекту переходу першої речовини в другу.
Наприклад:
С(графіт) + О2(г) = СО2(г) Δ Н1 = - 393,5 кДж
С(алмаз) + О2(г) = СО2(г) Δ Н2 = - 395,39 кДж
Тепловий ефект переходу графіту в алмаз:
Δ Н1 - Δ Н2 = - 393,51 - (- 395,39) = - 1,88 кДж
· якщо здійснити дві реакції так, що з однакових вихідних речовин утворюються різні кінцеві сполуки, то різниця між тепловими ефектами дорівнює тепловому ефекту преходу одного кінцевого продукту в другий.
Наприклад, за відомими тепловими ефектами згоряння графіту до СО і СО2:
С(графіт) + О(г) = СО(г) (1) Δ Н1 = - 393,51 кДж
СО(г) + 1/2О2 (г) = СО2 (г) (2) Δ Н2 = - 282,963 кДж
Віднімаючи рівняння (2) від (1), визначимо, що для реакції
С(графіт) + 1/2О2 (г) = СО(г) Δ Н = - 110,54 кДж
Розглянемо, як використовується такий процес на практиці. Один із способів газифікації викопного вугілля – це добування водяного газу в газогенераторах. Коли над нагрітим до 6000С вугіллям пропускати водяну пару, то утворюється водяний газ - суміш СО2 і Н2:
С(тв) + Н2О(г) = СО(г) + Н2(г) (1) Δ Н1 = 131,38 кДж
В результаті спалювання водяного газу з утворенням вуглекислого газу і води виділяється теплота:
СО(г) + 1/2О2 (г) = СО2(г) (2) Δ Н2 = - 282,963 кДж
Н2(г) + 1/2О2 (г) = Н2О(г) (3) Δ Н3 = - 241,83 кДж
Отже, сумарна реакція (2) + (3):
СО(г) + Н2(г) + О2 (г) = СО2(г) + Н2О(г)
супроводжується виділенням теплоти:
Δ Н = (- 282,963) + (- 241,83) = - 524,8 кДж
Але, на утворення водяного газу (1) було витрачено
Δ Н1 = 131,38 кДж
Отже,
С(тв) + Н2О(г) = СО(г) + Н2(г) Δ Н1 = 131,38 кДж
СО(г) + 1/2О2 (г) = СО2(г) Δ Н2 = - 282,96 кДж
Н2(г) + 1/2О2 (г) = Н2О(г) Δ Н3 = - 241,83 кДж

Сумарно С(г) + О2(г) = СО2(г) Δ Н = - 393,41 кДж
Відповідно до закону Гесса тепловий ефект спалювання вугілля безпосередньо в печах і круговим шляхом, включаючи його газифікацію, однаковий, але водяний газ раціональніше спалюється і економічно вигідніше використовується.
Зміна температури і тиску мало впливає на величину Δ Н. Наприклад для реакції
С(графіт) + СО2 (г) = 2СО(г)
Δ Н500оС = - 173,64 кДж, Δ Н1500оС = - 165,27 кДж
Різниця на 10000С змінює тепловий ефект всього на 8,37 кДж
У термохімії широко користуються такою характеристикою речовин як стандартна теплота утворення. Стандартною теплотою утворення сполуки ΔН0298 домовились вважати тепловий ефект утворення одного моля речовини з простих речовин, стабільних при 250 (298 К) і тискові 1 атм. (Стандартні теплоти утворення речовин можна знайти в довідковій літературі).
За законом Гесса можна обчислити теплові ефекти реакції, якщо відомі стандартні теплоти утворення вихідних сполук і продуктів реакції, і навпаки, обчислювати стандартні теплоти утворення, якщо відомі теплові ефекти реакції.
Так, тепловий ефект реакції дорівнює сумі стандартних теплот утворення кінцевих речовин без сум стандартних теплот утворення вихідних речовин з урахуванням стехіометричних коефіцієнтів.
Так, для реакції типу
аА + вВ = сС + dD,
де а, в, с, d - стехіометричні коефіцієнти перед формулами речовин А, В, С, D тепловий ефект Δ Н визначається рівністю
Δ Н = (с Δ НС + d Δ НD) - (a Δ НA + b Δ НB),
в якій Δ НA, Δ НB, Δ НС і Δ НD - теплоти утворення відповідних речовин.
Наприклад, тепловий ефект реакції горіння етилового спирту
С2Н5ОН(р) + 3О2(г) = 2СО2(г) + 3Н2О(г) .
дорівнює:
Δ Н = (- 2 . 393,6 - 3 . 241,8) - (- 277,7) = - 1234,9 кДж
при цьому слід врахувати, що Δ Нутв кисню дорівнює нулю, інші стандартні теплоти утворення Δ Н0утв беруться із довідкової літератури.
Якшо в результаті ряду послідовних хімічних реакцій система приходить в стан, який повністю співпадає із вихідним (замкнутий циклічний процес), то сума теплових ефектів цих реакцій дорівнює нулю, тобто для ряду реакцій:
А → В Δ Н1
В → С Δ Н2
С → D Δ Н3
D → А Δ Н4
сума їх теплових ефектів Δ Н1 + Δ Н2 + Δ Н3 + Δ Н4 = 0
Знаючи, наприклад, теплоти сотень сполук можна розрахувати за ними теплові ефекти багатьох тисяч різних реакцій, в яких беруть участь ці речовини в різних поєднаннях.
Значення Δ Н0утв для простих речовин дорівнюють нулю.
Приклад: 1) Обчислити тепловий ефект реакції окиснення амоніаку.
4NH3(г) + О2(г) = 2N2(г) + 6 Н2О(г)
Δ Н0298 утв NH3(г) = – 46,191 кДж /моль, Δ Н0298 утв О2(г) = 0
Δ Н0298 утв H2О(г) = – 241,84 кДж /моль, Δ Н0298 утв N2(г) = 0
Δ Н0298 = 6 . (– 241,84) – 4 . (– 46,181) = – 1266,24 кДж
2) Визначити стандартну теплоту утворення амоніаку.
З даних попередньої задачі виходить, що
4 Δ Н0298 (NH3) = 6 . (- 241,84) – (- 1246,25) = - 204,76 кДж
Δ Н0298 (NH3) = - 46,15 кДж /моль,
Під час досліджень органічних сполук часто вимірюють стандартні теплоти згоряння. Стандартні теплоти згоряння, як правило, на порядок більші величини, ніж стандартні теплоти утворення.
Приклад.
Чому дорівнює тепловий ефект реакцій полімеризації етину в бензен.
3С2Н2(г) → С6Н6(г)
Δ Н0298 згоряння С2Н2(г) = - 1299,63 кДж /моль
Δ Н0298 згоряння С6Н6(г) = - 3267,62 кДж /моль
Δ Н0298 = 3 Δ Н0298 С2Н2(г) - Δ Н0298 С6Н6(г)
Δ Н0298 = 3 (-1299,63) – (-3267,62) = - 631,28 кДж
Закон Гесса дає змогу обчислити таку важливу характеристику хімічних сполук як енергія зв’язків .
Для прикладу розглянемо обчислення енергії зв’язку
О – Н в молекулі води, яку можна синтезувати так:
Н2(г) + 1/2О2 (г) = Н2О(г) Δ Н0298 = - 241,835 кДж
Можна інакше: водень і кисень піддати дисоціації на атоми.
(Δ Н0дис)Н2 = 435,97 кДж
(1/2Δ Н0дис)О2 = 247,69 кДж;
Потім з атомів водню і кисню в газоподібному стані добути газоподібну воду:
2Н + О = Н2О(г)
Δ Н0298 цієї реакції, що віднесено до моля води, називається атомарною теплотою утворення (Δ Н0ат)Н2О
Вона дорівнює сумі енергій двох зв’язків О – Н.
Атомарна теплота утворення (Δ Н0ат) Н2О відрізняється від
(Δ Н0утв) величиною енергії, що витрачається на дисоціацію води і кисню.
Отже,
(Δ Н0ат)Н2О (г) = (Δ Н0дис) Н2 + 1/2 (Δ Н0дис) О2 - (Δ Н0утв) Н2О (г)
(Δ Нат) Н2О = (435,97 + 247,69) - (241,84) = 925,5 кДж
енергія зв’язку О – Н дорівнює половині атомарної теплоти утворення Н2О, якщо розраховувати на моль води:
ЕО-Н = 1/2 (Δ Н0ат) = 462,75 кДж
Для молекул, які мають в своєму складі більш ніж два атоми, застосовують поняття „середня енергія хімічного зв’язку”. Так, для метану СН4 енергія одного зв’язку С – Н дорівнює: ЕзвС-Н = Δ Нат /4,
де Δ Нат - енергія атомізації метану.
В таблиці наведено середні значення енергії хімічного зв’язку між деякими атомами. Енергія хімічного зв’язку дає змогу порівняти міцність зв’язків одних атомів з іншими, а також оцінити енергію утворення молекул з вільних атомів:
| Зв’язок | Езв, кДж | Зв’язок | Езв, кДж |
| Н – Н | N – H | 402,5 | |
| Н – F | C – H | 401,6 | |
| H – Br | C – Cl | ||
| H – J | C – C | ||
| Cl – Cl | C = C | ||
| Br – Br | Na – Cl | ||
| O – H | K – Cl |
За термохічними розрахунками аналогічно можна визначити енергію кристалічних граток, теплоту розчинення або гідратації тощо.
Приклад 7. Як пов’язані теплоти утворення сполук і періодичний закон?
Відповідь:
Зміни в електронних структурах атомів при утворенні складних речовин з простих, як це випливає з періодичного закону, теж виявляють певну періодичність. У сукупності даних, які мають виявити періодичність властивостей, значне місце відводиться змінам функцій стану, зокрема ентальпії. У цьому можна переконатися, порівнюючи ΔН0298 утворення однотипних хімічних сполук елементів (сульфідів, хлоридів, фторидів, оксидів).
Зміна ΔН0298 утворення хлоридів різних елементів виявляє періодичну залежність від протонного числа елементів.
Максимальне значення ΔН0298 спостерігається для
S – елементів (метали головних підгруп І і ІІ груп), набагато менші ΔН0298 - для р -елементів, близьке значення ΔН029 8 спостерігається для d - елементів і значне зближення величин для f – елементів.
Отже, періодичний закон Д.І. Менделєєва охоплює властивості не тільки простих речовин, а й сполук елементів.
Приклад 8. Від чого залежить теплопровідна властивість палива?
Відповідь:
Нафта, природний газ, вугілля є головними джерелами енергії. Теплотвірна властивість палива підвищується із відносним вмістом в них Карбону і Гідрогену. Наприклад, теплотвірна властивість бітумного вугілля вища, ніж у дерева, поскільки вугілля містить більше вуглецю.
В таблиці порівнюються характеристики різних видів палив. Палива (а також і продукти харчування) складаються із суміші речовин їх теплотвірна властивість вказується з розрахунку на один грам, а не на моль. Теплотвірна здатність та склад деяких розповсюджених видів палив:
| Паливо | Приблизний елементний склад, % | Теплотвірна здатність, кДж/г | ||
| С | Н | О | ||
| Антрацит | ||||
| Бензин | ||||
| Бітумне вугілля | ||||
| Водень | ||||
| Деревина (сосна) | ||||
| Деревне вугілля | ||||
| Природний газ | ||||
| Сира нафта |
Вугілля, нафта і природний газ в наш час використовується скоріше, ніж проходить його подальше утворення. Переробка цих природних копалин у відповідні види палив приводить до певних екологічних проблем. Тому в перспективі розглядаються інші енергетичні джерела. Наприклад, використання водню, синтез – газу, енергії сонця і вітру.
Приклад 9. Яка енергія називається калорійністю (або теплотвірною властивістю)?
Відповідь:
В організмі людини проходить багаточисельні біохімічні перетворення, які називаються обміном речовин. Ці процеси супроводжуються певною зміною ентальпії. Енергія людині необхідна для підтримки температури тіла і для виконання м’язевої роботи. Тож під час ходьби витрачається енергії 16кДж/хв, а під час бігу 40 кДж/хв. Основним джерелом енергії для людини є їжа і напої. В порівнянні з цим енергія, яка поступає в тіло людини у вигляді тепла, наприклад під час сидіння коло вогню, дуже мала. Енергетичні затрати залежать від статі, росту, ваги, характеру діяльності.
Якщо точно виміряти кількість теплоти, яку виділяє людина, кисню, що вбирається з повітря, вуглекислого газу і азоту, що видихається і т.д. і звести тепловий баланс процесів обміну, то прийдемо до висновку, що тепловий ефект хімічного процесу в організмі і калориметрі практично однаковий. Калорійність деяких харчових продуктів:
| Харчовий продукт | Приблизний склад, % | Калорійність, кДж/г | ||
| білки | жири | вуглеводи | ||
| Зелений горошок | 1,9 | – | 1,5 | |
| Земляні горіхи | ||||
| Молоко | 3,3 | |||
| Пиво | 0,3 | 1,2 | 1,8 | |
| Вершкова помадка | ||||
| Сосиски | – | |||
| Сир (чеддер) | ||||
| Хліб (білий) | ||||
| Яблука (свіжі) | 0,4 | 0,5 | 2,5 | |
| Яйця (курячі) | 0,7 |
Беремо до уваги, що окиснення 1 г жиру до вуглекислого газу і води супроводжується виділенням
38,91 кДж теплоти, повне окиснення 1 г вуглеводів до вуглекислого газу і води – 17,57 кДж; повне окиснення 1 г білків до вуглекислого газу, води і сечовини – виділенням 17,572 кДж теплоти.
Якщо людина виконує роботу середньої трудності, то тепловий баланс за добу такий:
| Енергія, що надійшла з харчовими продуктами: 56,5 г білків – 991,61 кДж 143 г жирів – 5468,49 кДж 79,9 г вуглеводів – 1401,64 кДж | Витрачена енергія. Виділилось теплоти з різними продуктами життєдіяльності організму – 6048 кДж Випаровувалося через шкіру – 949,77 кДж |
| Усього 7861,74 кДж | Усього 7755,07 кДж |
Точність експерименту ~ 1 %.
Енергія, яка виділяється при згорянні їжі, називається калорійністю (або теплотвірною властивістю).
Одержані дані дають підставу стверджувати, що закон Гесса так само справджується для живих організмів, як для неживих систем.
Приклад 10. Як визначається напрям хімічної реакції.
Відповідь:
Для процесів,що відбуваються спонтано в природі, відомі дві рушійні сили: перша - намагання системи перейти в стан з найменшою енергією і виділити під час переходу теплоту тобто знизити ентальпію; друга - намагання системи перейти в найбільш імовірний стан з максимально допустимим за цих умов ступенем безладності, тобто підвищити ентропію.
У хімічних процессах одночасно змінюються енергетичний запас системи і ступінь безладності. Якщо реакція відбувається при сталому тиску і температурі, то рушійну силу називають ізобарно-ізотермічним потенціалом і позначають літерою G.
Цей потенціал повязаний з ентальпією, ентропією і температурою співвідношенням.
G = H – TS
Хімічні процеси харектерезуюються своїми певними потенціалами. Потенціал, який є рушійною силою хімічних процесів, що відбуваються за Р, Т = const, називається енергією Гіббса (G) на честь американського вченого Дж.У.Гіббса, який ввів у термодинаміку цю функцію, а також ізобарно-ізотермічним потенціаломм, або вільною енергією за сталого тиску.
Зміна енергії Гіббса дорівнює максимальній корисній роботі, яку виконує система в цьому процесі.
∆G=Amax.
Корисною роботою називають всю роботу, виконану в ході процесу, за винятком роботи проти сил зовнішнього тиску.
Характер зміни енергії Гіббса дає підставу для висновку - можливе чи неможливе в принципі здійснення процесу. Він підлягає рівнянню
ΔG=ΔH-TΔS
де ΔG -зміна енергії Гіббса; ΔH -зміна ентальпії; ΔS -зміна ентропії; Т –зміна температури.
Напрям процесу визначається співвідношенням ΔH і TΔS, оскільки величина ΔH відображає намагання частинок обєднуватися в більші агрегації, а величина ΔS має протилежну тенденцію - намагання частинок розміщуватися безладно, роз’єднано. Так, чим більше під час реакції зростатеме ентропія і зменшуватиметься ентальпія, тим більше зменшуватиметься енергія Гіббса.
Умовою принципової можливості перебігу реакції є від’ємне значення ΔG, тобто ΔG < 0.
Приклад 1
Розкладання гідроген пероксиду при 298К і атмосферному тиску:
2H2O2(г) → 2H2O(г) + O2(г) ΔG = − 250 кДж
У цьому разі ентальпія зменшується (ΔH<0), а ентропія зростає (ΔS>0), тому й ΔG<0. Відбувається спонтанний екзотермічний процес розкладання гідроген пероксиду.
Приклад 2
Взаємодія азоту з киснем при температурі 298 і атмосферному тиску має відповідати рівнянню:
N2 (г)+ 2O2 (г) → 2NO2 (г) ΔG = −104 кДж
Якщо ж ентропія зменшується (ΔS<0), а ентальпія збільшуться (ΔH>0), то величина зміни енергії Гіббса більша від нуля (ΔG>0) і процес спонтанно не відбувається.
Тому реакція самочинної взаємодії кисню з азотом не відбувається, поскільки вона супруводжується зниженням ентропії і збільшеням ентальпії.Реакція ендотермічна, тому зміна енергії Гіббса додатня. Для перебігу такого процесу потрібно, щоб енергія надходила ззовні.
Якщо в системі не відбувається ні енергетичних змін (ΔH=0) ні змін ступеня безладності (ΔS=0), то G=0. Така система перебуває в стані рівноваги.
ΔH=T ΔS
Абсолютні значення енергії Гіббса G визначити неможливо. Тому важливо знати зміну енергії Гіббса ΔG при тих чи інших перетвореннях. Для визначення ΔG як і у випадку визначення зміни ентальпії, роботу, яку виконують деякі системи, умовно приймають за нуль. Так, за нуль приймають роботу утворення молекул простих речовин H2, O2, N2, Cl2, Br2 тощо.
Корисну роботу утворення інших речовин розраховують відносно таких умов: концентрації всіх компонентів реакції (в умовах нерівноважної системи) беруть такими, що дорівнюють 1 моль/дм³; температуру T = 298 K; тиск Ρ=101,3 кПа.
Таке значення енергії Гіббса називається стандартною енергією Гіббса ΔG0298. Значення стандартних енергій Гіббса ΔG0298 утворення речовини визначаються експериментально і подаються в довідковій літературі.
Як і ΔH системи, ΔG не залежить від способу проведеня процесу а залежить тільки від початкових і кінцевих продуктів реакції. Тому зміна енергії Гіббса для хімічноїї реакції дорівнює різниці між сумою енергій Гіббса утворення ΔG продуктів реакцій і сумою енергії Гіббса утворення вихідних речовин.
ΔG=Σ ΔG0прод.-Σ ΔG0вих речовин.
Зміна енергії Гіббса для хімічної реакції
aА + bB = cC + dD
дорівнює:
ΔG=(cΔG0утв C+dΔG0утв D)-(aΔG0утв A+bΔG0утв B).
Отже, знаючи ΔG0298 утворення речовини можна розрахувати ΔG для будь-якої реакції.
Слід зауважити, що висновки про можливість перебігу хімічної реакції зроблені на основі величини ΔG, обчисленої за стандартних умов. Зміна температури, концентрації та інших параметрів спричинює зміну ΔG і тим самим зумовлює зміну висновків про можливість перебігу реакції. Великі додатні значення ΔG вказують на неможливість перебігу реакції за будь-яких умов. Якщо додатні значення ΔG малі (до 40 кДж/моль), то за рахунок зміни концентрації реакцію можна здійснити, тобто при ΔG < 40кДж/моль процес ще можливий.
Для хімічного процесу:
CO2 (г) + 2ΝH3 (г) = (ΝH2)CO2 (т) + H2O(г) ΔG = 0,99 кДж
ΔG0 цієї реакції мала позитивна величина.
Значить, процес утворення сечовини за стандартних умов самовільно відбуватися не може.
Однак, в промисловості одержують за цією реакцією сечовину при нагріванні суміші CO2 і ΝH3 до 195-200 0С під тиском 183-192 кПа
Приклад 3
Обчислити ΔG для реакції:
ΝO (г) +1/2O2 (г) = ΝO2 (г)
Зміна енергії Гіббса
ΔG = ΔG0утв NO2 - (ΔG0утв NO+1/2ΔG0утв O2) = 51,8 - (126,8+0) = – 79 кДж,
тобто реакція можлива і відбувається за будь-яких умов.
Приклад 4
Обчислити ΔG для реакції:
CаΟ(к) + C(к) = Cа(к) + CΟ(г)
Зміна енергії Гіббса
ΔG = (ΔG0утв CO + ΔG0утв Ca) = (ΔG0утв CaО + ΔG0утв C) = (–137,2 + 0) – (–603,8 + 0) = =446,6 кДж, тобто ΔG>0. Отже, реакція неможлива.
Однак, зворотня реакція
Cа(к) + CΟ(г) = CаΟ(к) + C(к) для якої ΔG= – 466,6кДж може відбуватися.
Чим більші абсолютні величини ΔG реагуючих систем, тим повільніше вступають в реакцію речовини, тим більше значення роботи хімічного процесу. І навпаки, речовини, які реагують між собою недостатньо енергійно, зазнають невеликих змін вільної енергії.
Всі реакції, які супроводжуються великою втратою вільної енергії відбуваються до кінця, іноді супроводжуючись вибухом.
Наприклад, утворення алюміній оксиду:
2Al+2/3O2== Al2O3 ΔG = – 1555кДж/моль
Крім того, позитивний знак при ΔG0 показує, що сполуки термодинамічно нестійкі.
Наприклад, утворення нітроген (І) оксиду із азоту і кисню супроводжується збільшенням вільної енергії:
ΔG0 N2O = 103,6 кДж/моль
Отже, величина вільної енергії (або енергії Гіббса) системи є характеристикою реакційної здатності реагуючих речовин, а знак її вказує на направленість процесу.
Питання для самоконтролю.
9.1 Що вивчає термодинаміка
9.2 Чому при проходженні хімічної реакції виділяється або поглинається енергія?
9.3 Що таке ендотермічні та екзотермічні реакції?
9.4 Що таке „термодинамічна система”?
9.5 Як класифікують системи в хімічній термодинаміці?
9.6 Що називається параметром стану?
9.7 Чому теплота і робота не являються параметрами стану?
9.8 Що називається процесом?
9.9 Які види процесів розрізняють в хімічній термодинаміці?
9.10 Дайте визначення поняттям внутрішньої енергії, роботи, ентальпії.
9.11 Як можна сформулювати перший закон термодинаміки?
9.12 Що таке термохімічне рівняння?
9.13 Чим відрізняється термохімічне рівняння від хімічного?
9.14 Які особливості термохімічних рівнянь?
9.15 В яких одиницях вимірюється теплові (енергетичні) ефекти хімічних реакцій?
9.16 Чи рівнозначні поняття “тепловий ефект реакції“ і “ентальпія реакції“?
9.17 Які умови в хімічній термодинаміці вважаються стандартними?
9.18 Що називається стандартною ентальпією утворення речовини?
9.19 Чому стандартні ентальпії утворення простих речовин часто не вказані в довіднику?
9.20 Що називається стандартною ентальпією згоряння речовини?
9.21 Для чого необхідно знати теплові ефекти реакцій?
9.22 Від чого залежить тепловий ефект реакції?
9.23 Який закон лежить в основі розрахунку теплового ефекту реакції? Сформулюйте його і з нього наслідок.
9.24 Як визначити експерементально тепловий ефект
реакції?
9.25 Як можна теоретично розрахувати тепловий ефект реакції?
9.26 Які два фактори визначають направленість самовільного процесу?
9.27 Який фізичний зміст ентропії?
9.28 В яких одиницях визначається ентропія?
9.29 Як можна сформулювати другий закон термодинаміки?
9.30 Від яких факторів залежить величина ентропії?
9.31 Що таке „стандартна ентропія речовини”? Чому її називають „абсолютною ентропією”?
9.32 Чим відрізняється енергія Гельмгольца від енергії Гіббса?
9.33 Як розрахувати енергію Гіббса реакції і які висновки можна зробити на основі цього розрахунку?
9.34 Чому зміна температури може змінити напрям хімчної реакції?
9.35 Що називається хімічною спорідненістю?
9.36 Чи всі види енергії входять в поняття „тепловий ефект реакції”?






