ѕоказатель преломлени€ Ц одна из характерных констант жидкого вещества. “аблица значений показателей преломлени€ важнейших органических соединений приведена, например, в У—правочнике химикаФ, т. IV, 2-е изд. (1965 г.), с. 821 Ц 894. ѕри обозначении величины показател€ преломлени€ указывают индексами температуру и длину волны: n D20 означает, что показатель преломлени€ измерен при 20∞ — и дл€ спектральной линии D желтого натриевого пламени.
ѕоказатель преломлени€ определ€ют с помощью рефрактометра. ¬о врем€ измерени€ следует поддерживать посто€нную температуру, чаще всего 20 ∞—. — ростом температуры величина показател€ преломлени€ падает. ƒл€ жидких органических веществ показатель преломлени€ колеблетс€ от 1,3 до 1,8. ќбычно на лабораторном рефрактометре показатель преломлени€ определ€ют с точностью до четвертого знака после зап€той.
–абота с рефрактометром
¬нешний вид рефрактометра и расположение его основных частей показаны на рис. 11.
ќткрывают рефрактометрический блок и осторожно протирают ватой, смоченной эфиром, плоскости призм дл€ удалени€ с них посторонних примесей. «атем на поверхность измерительной призмы пипеткой осторожно, не каса€сь призмы, нанос€т две Ц три капли жидкости. ќпускают измерительную призму и прижимают ее крючком 11.
»змерени€ прозрачных жидкостей провод€т в проход€щем свете, дл€ чего открывают заслонку 4 осветительной призмы. «аслонка 10 в этом случае должна быть закрыта.
«еркалом 5 добиваютс€ хорошего освещени€ шкалы, а окул€р 6 фокусируют так, чтобы четко были видны делени€ шкалы и перекрестие (рис. 10).
¬раща€ маховик 8 и наблюда€ в окул€р 6, наход€т границу раздела света и тени. ≈сли контуры границы размыты и окрашены, тогда поворотом маховика 7 устран€ют окрашенность границы. «атем поворотом маховика 8 точно совмещают границу раздела света и тени с перекрестием и снимают отсчет по шкале показателей преломлени€ с точностью до четвертого знака после зап€той.

–ис. 11. –ефрактометр »–‘-454: ј Ц вид шкалы и перекресть€, Ѕ Ц вид прибора слева, ¬ Ц вид справа. 1 Ц корпус рефрактометра, 2 Ц корпус измерительной призмы, 3 Ц корпус осветительной (верхней) призмы, 4 Ц заслонки осветительной призмы, 5 Ц зеркало дл€ подсветки шкалы, 6 Ц окул€р, 7 Ц маховик дл€ устранени€ цветной каймы, 8 Ц маховик дл€ совмещени€ границы светотени с перекрестием, 9 Ц термометр, 10 Ц заслонка с зеркалом дл€ освещени€ при работе с мутными образцами (в случае прозрачных жидкостей закрыта), 11 Ц крючок дл€ закреплени€ прижатых призм, 12 Ц штуцеры дл€ подвода и отвода термостатированной воды
ѕо€снени€ к синтезу
–еакци€ образовани€ бромистого изопропила при взаимодействии изопропилового спирта с Ќ¬r проходит по механизму нуклеофильного замещени€, катализируемого кислотами. Ѕромистый водород образуетс€ в результате реакции:
KBr + H2SO4 = HBr + KHSO4
„тобы образующийс€ бромистый водород как можно меньше улетал, в реакционную смесь добавл€ют воду, а саму реакционную смесь перед внесением в нее бромистого кали€ охлаждают.
|
|
|
–оль серной кислоты состоит также в протонировании изопропилового спирта:
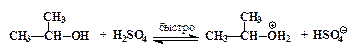
| (1) |
| изопропилоксоний-катион |
»зопропилоксоний-катион, будучи вторичным оксониевым ионом, может реагировать с нуклеофилом ¬r- по двум маршрутам: по механизму SN2:
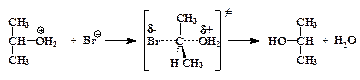
| (2) |
или по SN1:


| (3) (4) |
Ќар€ду с бромид-анионом в качестве нуклеофила может выступать и гидросульфат-анион ЌSO4‑:

| (5) |
| изопропилсульфат |
»зопропилсульфат, реагиру€ с бромид-анионом, также дает бромистый изопропил, а при высокой температуре (> 170 ∞—) способна к внутримолекул€рному отщеплению Ќ2Sќ4 с образованием пропилена.
ќбразующийс€ бромистый изопропил отгон€етс€ из реакционной смеси. ¬месте с бромпроизводным частично улетает и изопропиловый спирт, некоторое количество которого присутствует в реакционной смеси в свободном виде, так как равновесие (1) не полностью сдвинуто вправо. ¬ св€зи с этим установка снабжаетс€ дефлегматором, который позвол€ет частично отделить более высококип€щий спирт от бромистого изопропила и вернуть его в зону реакции.
¬заимодействие изопропилсерной кислоты со спиртом приводит к образованию небольших количеств простого диизопропилового эфира:

| (6) | |
| диизопропиловый эфир | ||
который может быть отделен от бромистого изопропила при обработке продукта концентрированной серной кислотой:

| (7) |
ѕродукт кислотно-основного взаимодействи€ простого эфира и H2SO4 в отличие от галогенпроизводного хорошо растворим в концентрированной серной кислоте (см. примечание 2).
онтрольные вопросы
1. «ачем в реакционную смесь перед началом синтеза добавл€ют воду, хот€ она не входит в уравнение основной реакции? ѕочему перед внесением бромида кали€ реакционную смесь необходимо как можно сильнее охладить?
2. акую роль в синтезе выполн€ет серна€ кислота?
3. «ачем установка дл€ синтеза бромистого изопропила снабжаетс€ дефлегматором? ѕочему продукт реакции рекомендуетс€ собирать под слоем воды?
4. Ќапишите уравнени€ реакций, в которые может вступать изопропилсульфат в различных услови€х. аковы механизмы этих реакций?
5. —равните между собой данные дл€ изопропилового спирта и бромистого изопропила: а) температуры кипени€, б) растворимости в воде. акие особенности строени€ этих веществ объ€сн€ют наблюдаемые различи€?
6. ¬ результате каких операций и каких реакций происходит очистка УсырогоФ бромистого изопропила от содержащихс€ в нем примесей?
7. —равните по данным из справочника физические свойства бромистого изопропила и бромистого н- пропила. ак практически можно отличить друг от друга эти изомеры?
8. „ем отличаютс€ между собой механизмы SN2 и SN1? ѕеречислите услови€, которые благопри€тствуют протеканию реакций замещени€ по тому или иному механизму.
јцетанилид (метод ј)

| анилин | ацетанилид |
¬ стакан или коническую колбу помещают 10 мл анилина и 30 мл воды. Ёнергично размешивают содержимое сосуда и при этом быстро вливают в него 11,5 мл уксусного ангидрида. ¬ результате выделени€ тепла реакции смесь разогреваетс€ и постепенно загустевает. –азмешивание продолжают до тех пор, пока не прекратитс€ выделение тепла и температура смеси не снизитс€ приблизительно до комнатной. «атем ее дополнительно охлаждают холодной водой и отфильтровывают ацетанилид на воронке Ѕюхнера. ќсадок равномерно распредел€ют по всей поверхности фильтра, хорошо отжимают и промывают небольшим количеством холодной воды так, чтобы вода медленно фильтровалась через слой уплотненного осадка. ѕосле того, как вс€ промывна€ вода будет отжата, осадок перенос€т на чистый лист бумаги, высушивают и определ€ют температуру плавлени€ ацетанилида. ќчистку продукта провод€т перекристаллизацией из воды (рис. 12).
|
|
|
Ќеочищенный ацетанилид помещают в стакан ј и к нему приливают некоторое количество воды. ¬ данном конкретном синтезе объем первоначально добавл€емой воды составл€ет приблизительно 200 мл. Ќагревают содержимое стакана ј так, чтобы вода закипела, и наблюдают за полнотой растворени€ в ней ацетанилида. ≈сли в первоначальном количестве воды все вещество не растворилось (плавают хлопь€, на дне видны масл€нистые капли, жидкость мутна€), то добавл€ют еще некоторое количество гор€чей воды. —нова нагревают смесь до кипени€ и наблюдают за полнотой растворени€. “ак поступают до тех пор, пока не получитс€ гомогенный, т. е. однородный, кип€щий насыщенный раствор ацетанилида. Ётот раствор иногда имеет бурый или желтоватый цвет из-за присутстви€ в нем смол и продуктов окислени€.
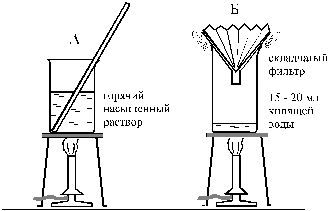
–ис. 12. ”становка дл€ Угор€чегоФ фильтровани€ насыщенного водного раствора ацетанилида
ƒл€ обесцвечивани€ раствор кип€т€т с 0,3 - 0,5 г активированного угл€. ѕеред добавлением угл€ кип€щий раствор надо об€зательно несколько охладить Ц отставить горелку на 0,5 Ц 1 мин, иначе при всыпании угл€ возможен выброс кип€щей смеси.
–аствор кип€т€т с углем в течение ~5 мин, след€ за тем, чтобы его объем не уменьшалс€ (при выкипании воду следует добавл€ть).
ƒл€ того, чтобы отфильтровать активированный уголь от гор€чего раствора, в стакан Ѕ помещают 15 Ц 20 мл воды. —верху стакан прикрывают стекл€нной воронкой, в которую вложен складчатый фильтр. ƒовод€т до кипени€ воду в стакане Ѕ и, прихватив полотенцем гор€чий стакан ј с раствором, осторожно и постепенно выливают кип€щий раствор из стакана ј на складчатый фильтр.
—одержимое стакана Ѕ должно посто€нно кипеть. ѕары воды обогревают стекл€нную воронку и не позвол€ют ацетанилиду закристаллизоватьс€ раньше времени на фильтре. –аствор в стакане ј в ходе фильтровани€ также поддерживают в кип€щем состо€нии. ћожно примен€ть и другие способы гор€чего фильтровани€.
ѕосле окончани€ фильтровани€ фильтрату дают охладитьс€. ¬ыпавшие красивые кристаллы чистого ацетанилида отфильтровывают на воронке Ѕюхнера. јцетанилид сушат на листе бумаги, помещенном на теплую (меньше 100 ∞—) асбестовую сетку, затем определ€ют температуру плавлени€ очищенного продукта. ¬ыход 90 %. “ пл 114 ∞—.
јцетанилид (метод Ѕ)
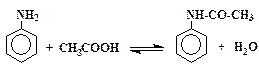
| —обирают под т€гой установку, изображенную на рис. 13. ¬ реакционную колбу помещают 10 мл анилина, 13 мл лед€ной уксусной кислоты и 0,1 г цинковой пыли (лед€ной называют безводную уксусную кислоту). ип€т€т смесь на сетке с такой интенсивностью, чтобы термометр показывал температуру 105 ± 5 ∞—. Ќагревание продолжают в течение 2 часов. «а это врем€ улетает больша€ часть воды, образовавшейс€ в результате реакции, вместе с некоторым количеством уксусной кислоты. ¬ыливают содержимое колбы в гор€чем состо€нии тонкой струей в стакан, содержащий 250 мл воды. —месь хорошо размешивают и охлаждают в холодной воде, а еще лучше в смеси воды со льдом или снегом. Ќеочищенный ацетанилид перенос€т на воронку Ѕюхнера, хорошо отжимают на фильтре с отсасыванием и про- |  –ис. 13. ”становка дл€ получени€ ацетанилида
–ис. 13. ”становка дл€ получени€ ацетанилида
|
мывают осадок холодной водой. ¬лажный ацетанилид перенос€т в стакан и постепенно приливают приблизительно 350 мл кип€щей воды. ¬есь ацетанилид должен растворитьс€. ≈сли раствор окрашен, к нему осторожно добавл€ют 1,5 Ц 2 г активированного угл€, кип€т€т
5 мин, а затем фильтруют от угл€ в гор€чем виде, как это описано в работе Ујцетанилид (метод ј)Ф. ƒают фильтрату охладитьс€, после чего фильтруют и хорошо отжимают очищенный ацетанилид на воронке Ѕюхнера. ќсадок высушивают при температуре не выше 100 ∞— и определ€ют температуру плавлени€ ацетанилида. ¬ыход 90 %.
“ пл 114 ∞—.
|
|
|
ѕо€снени€ к синтезу
„асть молекулы кислородсодержащей кислоты без гидроксильной группы называетс€ кислотным остатком или ацилом. Ќазвани€ и формулы некоторых кислот и ацилов приведены в таблице.
| ислота | јцил | |||
| ћуравьина€ | 
| ‘ормил | 
| |
| ”ксусна€ | 
| јцетил | 
| |
| ѕропионова€ | 
| ѕропионил | 
| |
| Ѕензойна€ | 
| Ѕензоил | 
| |
«амещение атомов водорода в молекулах органических соединений на ацилы называетс€ ацилированием. “аким образом, взаимодействие анилина с уксусным ангидридом (метод ј) или с уксусной кислотой (метод Ѕ) можно рассматривать как процесс замещени€ атома водорода в аминогруппе на ацетил, т. е. это ацилирование (конкретно Ц ацетилирование) анилина.
”ксусный ангидрид, как и ангидриды других кислот, хорошее ацилирующее средство и используетс€ наиболее часто. роме ангидридов дл€ ацилировани€ аминов иногда примен€ютс€ более дорогосто€щие хлорангидриды (RCOCl) и значительно реже сами карбоновые кислоты. арбоновые кислоты Ц слабые ацилирующие средства, поэтому их применение требует более жестких условий проведени€ реакций (сравнительно высока€ температура, отгонка воды).
јроматические амины, как правило, ацилируют дл€ того, чтобы снизить активирующее действие аминогруппы на бензольное кольцо. “ем самым предотвращают процессы окислени€ и осмолени€ аминов в таких реакци€х, как нитрование, сульфохлорирование, окисление других групп, содержащихс€ в молекулах аминов. Ётот прием носит название Узащита аминогруппыФ. јцилирование дает возможность получать моногалогенпроизводные ароматических аминов, тогда как действие галогенов (—l2, ¬r2, I2) на УнезащищенныеФ амины приводит к полигалогензамещенным. “ак, при действии брома на анилин вместо монобромзамещенного образуетс€ 2,4,6-триброманилин.
ѕосле проведени€ соответствующих реакций (нитровани€, галогенировани€, сульфохлорировани€ и т. д.) ацетильную группу можно удалить, т. е. заменить снова на водород в процессе гидролиза.
јцетанилид Ц это замещенный амид уксусной кислоты (фенил≠ацетамид) и, как все функциональные производные карбоновых кислот, он способен подвергатьс€ гидролизу в кислой или щелочной среде:


јцилирование аминов можно рассматривать как нуклеофильное замещение у карбонильного атома углерода в молекуле уксусного ангидрида. јмин, в данном случае анилин, выступает в качестве нуклеофильного реагента, а ацетат-анион —Ќ3—ќќ‑ Ц в качестве уход€щей группы.
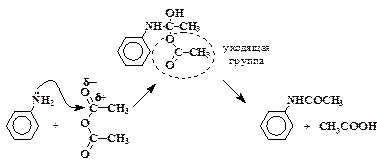
”ксусный ангидрид легко разлагаетс€ под действием воды:
—H3CO-O-COCH3 + H2O ¾Ѓ 2 CH3COOH.
Ќесмотр€ на это, реакцию между уксусным ангидридом и анилином провод€т в водной среде. «десь используетс€ свойство анилина и уксусного ангидрида сравнительно плохо раствор€тьс€ в воде, но хорошо раствор€тьс€ друг в друге. ¬ результате этого реакци€ уксусного ангидрида с анилином проходит быстрее, чем реакци€ ангидрида с водой. –астворению ангидрида в анилине, а значит и реакции между ними, способствует перевод анилина в состо€ние водной эмульсии путем энергичного размешивани€ смеси.
ќбычно первичные амины ацетилируют с помощью уксусного ангидрида (см. метод ј данного синтеза). ќднако ацетанилид можно получать и из более дешевого реагента Ц из уксусной кислоты.
–еакци€ анилина c уксусной кислотой обратима, поэтому образующуюс€ в ходе синтеза воду отгон€ют. ¬месте с ней из реакционной смеси улетает и некоторое количество уксусной кислоты. „тобы при отгонке соотношение вода:уксусна€ кислота сохран€лось в пользу воды, нагрев реакционной смеси тщательно регулируют так, чтобы температура паров на выходе из дефлегматора составл€ла 105 ± 5 ∞C. Ёто достигаетс€ уменьшением или увеличением количества газа, поступающего в горелку, либо отставл€€ в сторону горелку при увеличении температуры.
|
|
|
ƒл€ синтеза требуетс€ практически безводна€ уксусна€ кислота, котора€ называетс€ Улед€нойФ, так как при температуре ниже 16 ∞— она замерзает и становитс€ похожей на лед (“ пл 100 % уксусной кислоты 16,6 ∞—).
ѕри высокой температуре, при которой проходит реакци€, анилин может окисл€тьс€. ƒл€ предотвращени€ этого побочного процесса в реакционную смесь добавл€ют небольшое количество цинковой пыли. ÷инк в слабокислой среде восстанавливает начальные продукты окислени€ анилина до исходного амина.
онтрольные вопросы
1. акие реакции называютс€ реакци€ми ацилировани€? ”кажите наиболее часто употребл€емые ацилы и ацилирующие агенты.
2. — какой целью провод€т ацилирование аминов?
3. ќбъ€сните, почему группа -NЌ—ќ—Ќ3 €вл€етс€ более слабым электронодонором, чем группа -NЌ2?
4. ѕочему при получении п -броманилина бромируют ацетанилид, а не анилин? Ќапишите уравнени€ реакций, по которым получают n -броманилин из ацетанилида.
5. акое соединение €вл€етс€ более сильным основанием: анилин или ацетанилид? ƒайте объ€снение с использованием электронных представлений.
6. »звестно, что ангидриды кислот при растворении их в воде легко разлагаютс€ с образованием кислот. ѕочему же реакцию получени€ ацетанилида по методу ј провод€т в водной среде? ак объ€снить значительно меньшую растворимость в воде уксусного ангидрида по сравнению с уксусной кислотой?
7. ѕочему при получении ацетанилида по методу Ѕ уксусна€ кислота беретс€ с большим избытком по отношению к анилину?
8. »з каких веществ состоит реакционна€ смесь в конце реакции? ƒл€ удалени€ какой примеси осадок ацетанилида промывают водой на воронке Ѕюхнера при первом фильтровании? ѕочему дл€ промывани€ рекомендуетс€ примен€ть холодную воду?
9. акие правила техники безопасности должны выполн€тьс€ при проведении синтеза ацетанилида?






