јтомы водорода в бензольных кольцах ароматических соединений способны замещатьс€ на галогены (-—l, -¬r), остатки неорганических (-Nќ2, -Sќ3H) и органических (R-CO-) кислот, алкильные группы (-—Ќ3, -—Ќ2—Ќ3, -—Ќ(—Ќ3)2 и др.). ’арактерной чертой этих реакций €вл€етс€ участие в них электрофильных реагентов Ц частиц нуждающихс€ в электронах, часто положительно зар€женных. ѕоэтому такой тип реакций называетс€ электрофильным замещением и обозначаетс€ SE.
Ќекоторые реакции электрофильного замещени€ бензола:

| хлорирование |

| нитрование |
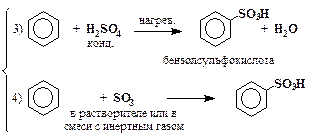
| сульфирование |
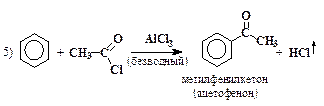
| јцилирование по методу ‘ридел€- рафтса |

| алкилирование по методу ‘ридел€- рафтса |
¬се реакции электрофильного замещени€ проход€т по одной общей схеме:
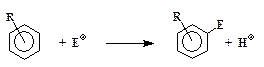
где ≈+Ц электрофил, т.е. частица, "люб€ща€ электроны", R Ц заместитель в бензольном кольце, положение которого (орто-, мета- или пара) в этих формулах не указано.
Ёлектрофилы образуютс€ в результате кислотно-основных взаимодействий, как правило, в растворител€х, способных сильно сольватировать ионы. —ледовательно, в реакционных смес€х SE-процессов об€зательно должны присутствовать сильные протонные или апротонные кислоты: Ќ2Sќ4 (конц.), ЌNќ3 (конц.), AlCl3 (безв.), FeCl3, BF3, SO3 и т.п.
¬ в реакци€х (1 Ц 6) в качестве электрофилов выступают соответственно Cl+, NO2+, HSO3+, SO3, CH3CO+ и CH3CH2+.
ѕримером образовани€ электрофила NO2+ Ц нитроний-катиона Ц €вл€етс€ реакци€:

ƒоказано, что переходные состо€ни€ всех реакций электрофильного замещени€ бензола и его производных образуютс€ в результате столкновени€ двух частиц, содержат как молекулу ароматического соединени€, так и электрофил. Ѕимолекул€рность реакции обозначают цифрой 2: SE2.
»звестно также, что в переходном состо€нии SE2-процесса еще сохран€етс€ ковалентна€ св€зь между углеродным атомом бензольного кольца и уход€щим атомом водорода.
Ётим экспериментальным фактам соответствует следующий механизм реакций SE2:
1. ќбразование электрофила ≈+ (см., напр., образование NO2+).
2. ќбразование p-комплекса (Упи-комплексаФ):

3. ќбразование s-комплекса (Усигма-комплексаФ):

4. ќтщепление протона:

ƒл€ большинства реакций SE2 стади€ 3, т. е. образование s-ком≠плекса, требует наибольшей энергии активации, поэтому она проходит медленнее других стадий.
“а из последовательных стадий процесса, котора€ имеет наибольшую энергию активации, называетс€ лимитирующей стадией. ќбразование s-комплекса Ц лимитирующа€ стади€ процесса SE2. „ем легче образуетс€ s-комплекс, тем быстрее проходит электрофильное замещение у соответствующего атома углерода в бензольном кольце.
ѕереход ароматического соединени€ в s -комплекс требует значительных затрат энергии. ¬о-первых, s -комплекс €вл€етс€ карбокатионом, а карбокатионы, как известно, неустойчивы, и во-вторых, при образовании s -комплекса разрушаетс€ ароматическа€ p -электрон≠на€ система и тер€етс€ энерги€ ароматической стабилизации. јтом углерода, присоединивший электрофильный реагент, из sp 2-переходит в sp 3-состо€ние и образуетс€ не ароматическа€ разомкнута€ π -система. ” σ -комплекса 5 атомов углерода остаютс€ в sp 2-гибридном состо€нии и их pz -орбитали образуют две св€зывающих, две разрыхл€ющих и одну несв€зывающую орбиталь. ѕоложительный зар€д σ -комплекса, главным образом, находитс€ на Ќ—ћќ, т.е. в о - и п -положени€х по отношению к sp 3-гибридному атому углерода.
|
|
|
s- омплекс по энергии близок к переходному состо€нию рис. 15.

–ис. 15. Ёнергетические диаграммы нитровани€ ароматических соединений:
1 Ц нитробензола, 2 Ц бензола, 3 Ц толуола
¬ соответствии с принципом ’еммонда это означает, что они близки и по структуре). ¬идно также, что энергетические уровни s -комплексов и соответствующих переходных состо€ний мен€ютс€ симбатно, т.е. рост энергии s -комплекса сопровождаетс€ увеличением энергии активации реакции. ћожно сказать, что энергетический уровень s -комплекса предопредел€ет величину энергии активации реакции ароматического соединени€.
»з рис. 15 следует, что при нитровании ароматических соединений величины энергии активации последовательно уменьшаютс€ в р€ду: нитробензол, бензол, толуол. ¬ соответствии с этим при одинаковых услови€х толуол нитруетс€ легче, чем бензол, а бензол Ц легче, чем нитробензол.
ќт относительной легкости образовани€ соответствующих s -комплексов зависит и преимущественное образование тех или иных изомеров при замещении в молекулах монозамещенных бензола. ¬ общем виде образование различных изомеров при электрофильном замещении можно представить в виде схемы:

Ёлектронодонорные заместители ј (-NH2, -NHCH3, -N(CH3)2,
-OH, -OCH3, CH3, другие алкилы и т. д.) стабилизируют орто - и пара - s -комплексы, поэтому среди продуктов электрофильного замещени€ в молекулах соответствующих ароматических соединений преобладают орто - и пара - замещенные, а мета -изомеры образуютс€ в небольших количествах (до 5 %). “акие заместители называютс€ орто -, пара -ориентирующими или заместител€ми первого рода. Ёлектронодонорные заместители облегчают электрофильное замещение в молекуле
–h-ј по сравнению с незамещенным бензолом –h-Ќ, (см. энергетическую диаграмму).
Ёлектроноакцепторные заместители:

наоборот, способствуют энергетической дестабилизации s -комп≠лексов, увеличивают ≈ реакций электрофильного замещени€ и уменьшают их скорость. ќсобенно сильное вли€ние они оказывают на орто - и пара -положени€ Ph-A. ¬ их присутствии энерги€ активации замещени€ в мета -места ниже, чем в орто - и в пара -, поэтому они направл€ют электрофильные частицы ≈+ преимущественно в мета -положе≠ние. “акие заместители называютс€ мета -ориентирующими или заместител€ми второго рода.
ќсобенным образом в качестве заместителей ведут себ€ галогены. ќни, €вл€€сь электроноакцепторами, несколько замедл€ют процессы SE2-типа, но при этом направл€ют атакующие электрофилы ≈+ преимущественно в пара - и (в меньшей степени) в орто -положени€.
Ќафталин подвергаетс€ электрофильному замещению легче, чем бензол, так как оба возможных s -комплекса: a - и b - образуютс€ легче, чем соответствующий s -комплекс бензола:

| a-s -комплекс | b-s -комплекс | s -комплекс бензола |
Ћегкость образовани€ s-комплекса зависит от степени делокализации в нем положительного зар€да. ќб эффективности делокализации можно судить по величине суммы зар€дов на атомах, соседних с тем, который изменил свое валентное состо€ние от sр 2- до sр 3- в результате присоединени€ к нему электрофила ≈+. „ем больше эта сумма, тем меньше делокализован положительный зар€д, тем сильнее дестабилизирован s-комплекс (его ≈ пот на энергетической диаграмме выше), а значит и меньше реакционна€ способность ароматического соединени€. ћожно видеть, что соответствующие суммы SdÅ равны: у a-s -комплекса 1/11 + 4/11 = 5/11 = 0,454, у b-s -комплекса 1/2 + 1/8 = 5/8 = 0,625, у s -комплекса бензола 1/3 + 1/3 = 2/3 = 0,667. Ќайденные суммы соответствуют уменьшению реакционной способности в р€ду: a -положение нафталина > b -положение нафталина > бензол.
|
|
|
—тепень делокализации положительного зар€да по углеродным атомам колец s -комплексов, образующихс€ из ароматических соединений бензоидного типа, можно оценить, пользу€сь методом расчета, предложенным Ћонге-’иггинсом. Ётот метод изложен в указании [8] (см. список литературы в конце этого пособи€).






