
ѕриготовление нитрующей смеси. ¬ колбу внос€т 18,2 мл концентрированной азотной кислоты плотностью 1,4 г/см (0,27 моль HNO3)* и постепенно небольшими порци€ми при перемешивании приливают 22 мл концентрированной серной кислоты. ѕолученную смесь охлаждают до комнатной температуры.
ѕолучение нитротолуолов. ¬ трехгорлую колбу (2) (рис. 16), снабженную обратным воздушным холодильником (4) и термометром (5), помещают 27 мл толуола. ¬ самом начале нитровани€ вод€на€ бан€ (1), изображенна€ на рис. 16, не используетс€. ќткрыв пробку, приливают в колбу через горло (3) около 5 мл нитрующей смеси. ѕлотно закрывают пробку и вручную энергично встр€хивают содержимое колбы, однако так, чтобы реакционна€ масса как можно меньше попадала изнутри на резиновые пробки. ѕовтор€ют несколько раз операцию добавлени€ нитрующей смеси и энергичного встр€хивани€, посто€нно наблюда€ за показани€ми термометра. ≈сли термометр показывает температуру выше 60 ∞—, то колбу охлаждают до этой температуры (но не ниже) в бане с водой. ѕосле прибавлени€ всей нитрующей смеси колбу нагревают при 60 ∞— в течение 30 мин, периодически встр€хива€. ќпредел€ют конец реакции по пробе реакционной смеси: капл€ органического сло€ должна тонуть в воде. –еакционную смесь перенос€т в делительную воронку. ƒают жидкост€м расслоитьс€ и отдел€ют нижний слой отработанных кислот. «атем органический слой промывают последовательно водой, разбавленным (~10 %) раствором соды и снова водой. ѕосле последней промывки и отстаивани€ нижний слой сливают в сухую колбу, как можно тщательнее отдел€€ его от воды. органической жидкости прибавл€ют прокаленный хлористый кальций в таком количестве, чтобы он смог поглотить всю прошедшую вместе с органическим слоем воду, но при этом оставалс€ твердым. ƒл€ ускорени€ обезвоживани€ смесь нитротолуолов с хлористым кальцием полезно погреть на бане при встр€хивании. ќбезвоживание жидкости продолжают до тех пор, пока она станет прозрачной.
 –ис. 16.—хема установки дл€ нитровани€ толуола: 1 Ц бан€, 2 Ц реакционна€ колба, 3 Ц горло, через которое прибавл€етс€ нитрующа€ смесь, 4 Ц воздушный обратный холодильник, 5 Ц термометр
–ис. 16.—хема установки дл€ нитровани€ толуола: 1 Ц бан€, 2 Ц реакционна€ колба, 3 Ц горло, через которое прибавл€етс€ нитрующа€ смесь, 4 Ц воздушный обратный холодильник, 5 Ц термометр
|
—обирают установку дл€ простой перегонки с вод€ным холодильником и термометром до 250 ∞— (рис. 17). ‘ильтруют жидкость от хлористого кальци€ через складчатый фильтр в перегонную колбу.
Ќагрева€ колбу на сетке, начинают разгонку жидкостей. ƒо температуры паров 150 ∞— через рубашку холодильника пропускают слабый ток воды, после достижени€ 150 ∞— воду можно выключить. ¬начале собирают фракцию, перегон€ющуюс€ до 200 ∞—. ќна состоит главным образом из непрореагировавшего толуола. ќтогнанный толуол сливают в скл€нку дл€ отходов растворителей. ѕосле отгонки толуола в качестве приемника дл€ второй основной фракции подставл€ют сухую взвешенную колбу. “емпература паров быстро поднимаетс€ от 200 до 220 ∞—, при которой обычно начинает отгон€тьс€ основна€ масса смеси изомерных нитротолуолов. ѕо мере перегонки температура кипени€ по степенно повышаетс€. ѕерегонку ведут до температуры паров 237 ∞—. Ќельз€ отгон€ть жидкость из колбы досуха. ѕосле окончани€ перегонки приемник с нитротолуолами взвешивают. ¬ыход 75 %.
|
|
|

–ис. 17. ”становка дл€ простой перегонки: 1 Ц колба ¬юрца, 2 Ц термометр, 3 Ц пр€мой вод€ной холодильник, 4 Ц алонж, 5 Ц приемник
’роматографическое определение изомерного
состава нитротолуолов
ƒл€ определени€ изомерного состава продуктов нитровани€ толуола используют метод газо-жидкостной хроматографии. —месь нитротолуолов, полученную в результате перегонки, раствор€ют в четыреххлористом углероде. Ќебольшую пробу раствора (до 1 микролитра, 1 микролитр = 0,001 мл) с помощью микрошприца ввод€т в испаритель хроматографа, откуда она с током газа-носител€ (гели€) попадает в колонку прибора, где происходит разделение смеси на составл€ющие ее компоненты. –езультат разделени€ автоматически записываетс€ на хроматограмме, вид которой изображен на рис. 18.
ѕлощадь на хроматограмме, ограниченна€ кривой пика, соответствующего определенному изомеру(S x), при прочих равных услови€х пропорциональна его содержанию с x в пробе: S x = f x с x. оэффициент про порциональности f x в общем случае зависит от природы вещества, но дл€ изомеров он одинаков. »сход€ из этого, можно рассчи-

–ис. 18. ’роматограмма смеси изомерных нитротолуолов, содержащей следы непрореагировавшего толуола: а) расположение пиков компонентов на диаграммной бумаге, б) та же хроматограмма, представленна€ в виде зависимости величины электрического сигнала от времени прохождени€ пробы по колонке
| тать процентное содержание, например о- изомера в смеси по формуле: р орто = 100Ј S орто/(S орто + S мета + S пара). «десь Sорто, Sмета и Sпара Ц площади пиков на хроматограмме, соответствующих орто -, мета - и пара -нитро≠толуолам. Ќа рис. 19 иллюстрирует простой способ определени€ площади хроматографического пика (S) путем измерени€ его высоты (h) и полуширины (b Ц ширина пика на половине его высоты: S = b Ј h |  –ис. 19. ќпределение площади хроматографического пика
–ис. 19. ќпределение площади хроматографического пика
|
ѕо€снени€ к синтезу
–еакци€ нитровани€ ароматических углеводородов происходит на границе раздела между двум€ несмешивающимис€ жидкост€ми (углеводород Ц нитрующа€ смесь). ѕоэтому при проведении синтеза требуетс€ энергичное перемешивание. Ќитрование Ц экзотермическа€ реакци€, сопровождающа€с€ выделением большого количества тепла (D Ќ = -120 кƒж/моль). ѕовышение температуры ускор€ет такие нежелательные процессы, как образование полинитросоединений и окисление органических веществ азотной кислотой. ƒл€ поддержани€ оптимальной температуры вначале реакционную смесь необходимо эффективно охлаждать. ѕо мере расходовани€ реагентов и снижени€ их концентраций скорость нитровани€ уменьшаетс€, а следовательно, уменьшаетс€ и количество тепла, выдел€ющеес€ в единицу времени. ¬ этом случае теплоты реакции уже становитс€ недостаточно дл€ поддержани€ оптимальной температуры, поэтому дл€ завершени€ реакции смесь приходитс€ нагревать.
ѕлотность нитротолуолов больше единицы, а толуола Ц меньше единицы. —месь, в которой преобладают нитротолуолы, имеет плотность больше единицы, поэтому, чтобы убедитьс€ в степени завершенности реакции нитровани€, необходимо извлечь из колбы каплю органического сло€ и поместить ее в пробирку с водой. ≈сли капл€ тонет в воде, она состоит в основном из нитротолуолов. ¬ противном случае нагревание реакционной смеси следует продолжать.
|
|
|
Ётот способ определени€ конца реакции очень приблизителен. Ѕолее совершенным методом €вл€етс€ определение в органическом слое относительного содержани€ толуола и нитротолуолов с помощью газо-жидкостной хроматографии.
ѕлотность смеси нитротолуолов ниже плотности отработанной нитрующей смеси, т.е. смеси азотной и серной кислот в конце реакции, поэтому при разделении в делительной воронке органический слой располагаетс€ над кислотным.
ѕри последующих промывках водой и водным раствором соды слой, содержащий нитросоединени€, находитс€ внизу.
ѕобочными продуктами в реакции нитровани€ кроме динитросоединений €вл€ютс€ полинитрофенолы. √идроксигруппа у бензольного кольца образуетс€ в результате нуклеофильного замещени€ водорода в 5 положении 2,4-динитротолуола на группу -ќ-Nќ2 и последующего гидролиза соответствующего эфира азотной кислоты. ќбразовавшийс€ фенол тут же нитруетс€ с образованием тринитропроизводного.
ѕри нитровании толуола побочным продуктом €вл€етс€ тринитро- м -крезол (1-гидрокси-3-метил-2,4,6-тринитробензол). ѕрисутствие полинитрофенолов обнаруживаетс€ при промывке органического сло€ раствором соды. ¬ щелочной среде слабо-желта€ окраска раствора полинитрофенолов усиливаетс€, переход€ в оранжевую, в результате образовани€ нитрофенол€тов. »нтенсивный красно-оранжевый цвет содового раствора при промывке нитротолуолов в делительной воронке свидетельствует о большом содержании тринитро- м -крезола в реакционной смеси, что бывает при ее перегреве. ѕромывка продукта водным раствором соды служит, таким образом, дл€ удалени€ из него примесей как неорганических кислот, так и тринитро- м -крезола.
омпоненты органического сло€: непрореагировавший толуол, смесь изомерных нитротолуолов и динитротолуолы раздел€ют путем простой перегонки. ¬ данном случае это возможно, так как они имеют сильно различающиес€ температуры кипени€ (60 Ц 100 ∞—). ќднако следует иметь в виду, что даже в этой благопри€тной ситуации достичь полного разделени€ компонентов невозможно. ’роматограмма смеси нитротолуолов, выделенных с помощью перегонки, показывает, что в ней присутствует некоторое количество толуола (“ кип 111∞ —), хот€ фракци€ нитротолуолов была отобрана в интервале 220 Ц 238∞ —. »з сказанного €сно, что с помощью простой перегонки разделить изомерные нитротолуолы, разность температур кипени€ которых составл€ет 18 ∞—, невозможно. ƒл€ разделени€ смесей веществ, имеющих близкие температуры кипени€, примен€ютс€ ректификационные колонки.
онтрольные вопросы
1. ѕочему при проведении нитровани€ ароматических углеводородов необходимо энергичное перемешивание реакционной смеси?
2. акова роль серной кислоты в нитрующей смеси?
3. ѕочему при нитровании толуола преимущественно образуютс€ орто - и пара -нитротолуолы, а мета -изомера образуетс€ мало? ƒайте объ€снение с точки зрени€ легкости образовани€ соответствующих s -комплексов.
4. ак можно определить конец реакции нитровани€?
5. акой состав имеет реакционна€ смесь в конце реакции? акие побочные продукты образуютс€ при нитровании толуола до мононитросоединени€?
6. ак будет зависеть относительное количество 2,4-динитрото≠луола в реакционной смеси от таких факторов, как:
а) пор€док смешени€ реагентов (I Ц нитрующую смесь медленно приливают к толуолу; II Ц толуол медленно приливают к нитрующей смеси)?
б) температура реакционной смеси?
в) интенсивность перемешивани€?
7. ѕочему в 2,4-динитротолуоле нуклеофильному замещению на группу -ќ-Nќ2 подвергаетс€ водород преимущественно в положении 5?
8. ѕри нитровании толуола при 60 ∞— тринитротолуол практически не образуетс€, однако в смеси всегда присутствует небольшое количество тринитро- м -крезола. ак это можно объ€снить?
9. ак выдел€ют нитротолуолы из их смеси с другими органическими соединени€ми, присутствующими в реакционной массе?
10. »спользу€ данные о свойствах изомерных нитротолуолов, предложите способ выделени€ п -нитротолуола из их смеси.
11. акие меры безопасности необходимо соблюдать в процессе получени€ нитротолуолов?
|
|
|
2.2.3. м -ƒинитробензол

¬ выт€жном шкафу собирают установку, состо€щую из колбы на 100 мл (желательно с широким горлом) и термометра, укрепленного таким образом, чтобы его шарик был приближен ко дну колбы, но не касалс€ его (рис. 20). ƒолжна быть предусмотрена возможность нагревани€ колбы на сетке.
| —мешивают в колбе 8,3 мл нитробензола с 25 мл концентри≠рованной серной кислоты (d = 1,84 г/см3) и нагревают до 80 Ц 90 ∞—. √орелку выключают и небольшими порци€ми прибавл€ют 12,5 г тонко растертого нитрата натри€, след€ за тем, чтобы температура не поднималась выше 130 ∞—. —одержимое колбы посто€нно перемешивают, покачива€ установку вместе со штативом, на котором укреплена колба. Ќе должно наблюдатьс€ сильного выделени€ оксидов азота. ќбразующийс€ по реакции м -динитробензол всплывает в виде масл€нистого сло€. ѕосле добавки всего нитрата |  –ис. 20. —хема установки дл€ синтеза м -динитробензола
–ис. 20. —хема установки дл€ синтеза м -динитробензола
|
 –ис. 19. —хема установки дл€ синтеза м -динитробензола
–ис. 19. —хема установки дл€ синтеза м -динитробензола
|
включают горелку и продолжают нагревание при 130 ∞— еще 30 минут. «атем содержимому колбы дают охладитьс€ до 70 ∞— и при энергичном перемешивании выливают в стакан, в котором находитс€ приблизительно 100 г измельченого льда. м -ƒинитробензол выдел€етс€ в виде желтого осадка. ≈го отфильтровывают на воронке Ѕюхнера, промывают на фильтре водой, затем слабым (~10 %) раствором соды и снова водой до нейтральной реакции промывных вод. ’орошо отжимают кристаллы и сушат на воздухе. ѕолученный продукт взвешивают и определ€ют его температуру плавлени€.
ƒл€ очистки от примесей м -динитробензол перекристаллизовывают из небольшого количества спирта. ƒл€ этого неочищенный м -динитробензол помещают в колбу с обратным холодильником и прибавл€ют к нему 10 мл изопропилового спирта. ƒалее необходимый объем растворител€ подбирают опытным путем, и наблюда€ за растворением вещества при кип€чении растворител€. Ќагревают колбу на вод€ной бане и при необходимости, если нет полного растворени€, прибавл€ют небольшими порци€ми изопропиловый спирт через верх холодильника. ѕосле полного растворени€ осадка к прозрачному гор€чему раствору через верх холодильника прибавл€ют по капл€м воду до помутнени€ раствора. ƒобавл€ют в колбу несколько капель спирта до исчезновени€ мути и затем гор€чий однородный раствор, выключив предварительно горелку, переливают в сухой стаканчик. ƒают раствору постепенно охладитьс€ при размешивании его стекл€нной палочкой. ¬ыпавший м -динитробензол отфильтровывают на воронке Ѕюхнера, сушат до посто€нного веса на воздухе, определ€ют массу и температуру плавлени€ продукта.
¬ыход 70 %. “ пл 90 ∞—.
ѕо€снени€ к синтезу
Ќитробензол из-за электроноакцепторного вли€ни€ группы NO2 нитруетс€ в значительно более жестких услови€х, чем бензол. ѕон€тие Уболее жесткие услови€Ф означает, что необходимо брать более концентрированные кислоты и поддерживать более высокую температуру реакции. ћеньшее содержание воды приводит к более высокой кислотности реакционной смеси и, следовательно, к большей концентрации нитроний-катиона (Nќ2+). ƒл€ получени€ м -динитробензола можно использовать Удым€щуюФ азотную кислоту с плотностью 1,5 г/мл (примерно 98 % ЌNќ3). ќднако более удобным лабораторным способом синтеза €вл€етс€ нитрование нитробензола, растворенного в концентрированной Ќ2Sќ4, путем прибавлени€ к нагретому раствору размельченной натриевой или калиевой соли азотной кислоты. јзотна€ кислота образуетс€ непосредственно в реакционном сосуде по реакции:
NaNO3 + H2SO4 = NaHSO4 + HNO3
Ќитрование проходит практически в безводной среде. —ерна€ кислота в данном случае выполн€ет функции: 1) реагента дл€ образовани€ ЌNќ3 из NаNќ3, 2) кислотного катализатора, который способствует образованию Nќ2+, 3) растворител€. ѕреимущество такого способа Ц протекание реакции в гомогенной среде, т.к. и нитробензол, и нитрат натри€ растворимы в 95 % Ќ2Sќ4, а это обеспечивает большую скорость процесса по сравнению с гетерогенными услови€ми. Ќедостаток способа Ц большой расход серной кислоты.
|
|
|
ќсобое внимание необходимо обращать на соблюдение указанного в прописи температурного режима: при добавлении нитрата натри€ температура реакционной смеси ни в коем случае не должна превышать 130 ∞C. ѕри повышенной температуре усиливаетс€ окислительное действие азотной кислоты, в результате чего образуютс€ полинитрофенолы и продукты более глубокого окислени€ органического вещества (смола). “ринитробензол практически не образуетс€.
ѕроцессам окислени€ способствует ускор€юща€с€ при повышенной температуре реакци€ разложени€ азотной кислоты на воду, кислород и диоксид азота. ѕрисутствие примеси полинитрофенолов обнаруживаетс€ при обработке расплавленного неочищенного м -ди≠нитробензола щелочью или содой: в результате образовани€ окрашенных полинитрофенол€тов промывна€ жидкость окрашиваетс€ в оранжевый цвет.
м -ƒинитробензол значительно хуже растворим в концентрированной серной кислоте, чем исходный нитробензол, поэтому по мере образовани€ он выдел€етс€ в гор€чей реакционной смеси в виде масл€нистого сло€. ѕри охлаждении смеси, а также при выливании ее в размельченный лед м -динитробензол затвердевает. ƒл€ отмывани€ осадка от кислот, захваченных при отверждении, его промывают последовательно водой, раствором соды и вновь водой.
онтрольные вопросы
1. ѕочему синтез динитробензола приходитс€ проводить в более жестких услови€х, чем нитробензола?
2. ѕочему при нитровании нитробензола образуетс€ преимущественно мета -изомер, а орто - и пара- изомеров образуетс€ очень мало? ƒайте объ€снение с учетом различной легкости образовани€ соответствующих s -комплексов.
3. Ќапишите уравнение равновесной реакции образовани€ нитроний-катиона в смеси концентрированных азотной и серной кислот. ѕочему попадание воды в реакционную смесь, так же как и образование ее в ходе реакции, уменьшают концентрацию NO2Å?
4. —равните используемое в синтезе количество серной кислоты с теоретически необходимым по уравнению основной реакции. ѕочему в описанном синтезе м -динитробензола примен€етс€ значительный избыток серной кислоты?
5. –ассчитайте концентрацию серной кислоты в конце реакции. ѕочему реакционную массу после завершени€ реакции и охлаждени€ до 70 ∞— рекомендуетс€ выливать не в воду, а на размельченный лед?
6. Ќапишите реакцию термического разложени€ азотной кислоты. акой нежелательный процесс усиливаетс€ при этом?
7. ќсновной примесью в неочищенном м -динитробензоле €вл€етс€ непрореагировавший нитробензол. Ќайдите в справочнике [2] данные о растворимости этих двух веществ в этиловом спирте и на основании этих данных сделайте вывод об эффективности перекристаллизации из спирта м -динитробензола дл€ его очистки.
8. акие правила безопасности следует соблюдать при выполнении синтеза м -динитробензола?
Cульфанилова€ кислота

–абота выполн€етс€ под т€гой. ƒл€ синтеза примен€етс€ прибор, используемый при получении м -динитробензола (рис. 20 на стр. 95).
¬ колбу помещают 15 мл свежеперегнанного анилина и к нему небольшими порци€ми, чтобы смесь не перегревалась, добавл€ют 27 мл концентрированной серной кислоты (d = 1,84 г/см3). –аствор нагревают на сетке при 180 Ц 190 ∞C до тех пор, пока проба, растворенна€ в гор€чем водном растворе щелочи, не перестанет выдел€ть анилин (масл€ные капельки). —ульфирование идет 1,5 Ц 2 часа. ѕерегревание реакционной смеси выше 190 ∞— ведет к ее обугливанию.
ѕо окончании сульфировани€ охлажденную до 80 Ц 90 ∞— реакционную массу выливают при размешивании в 200 мл холодной воды. ѕри охлаждении сульфанилова€ кислота выпадает в осадок. ислоту отфильтровывают на воронке Ѕюхнера, дважды промывают небольшими порци€ми холодной воды и перекристаллизовывают из воды с добавлением активированного угл€. —пособ перекристаллизации описан в работе по получению ацетанилида (стр. 64). ¬ыход дигидрата сульфаниловой кислоты п -H2N-C6H4-SO3H. 2H2O 15 Ц 17 граммов.
ѕо€снени€ к синтезу
–еакции электрофильного замещени€ водорода в кольце ароматических аминов имеют р€д особенностей, обусловленных наличием у атома азота неподеленной электронной пары. — кислотами, которые используютс€ в качестве электрофильных реагентов, амины реагируют, прежде всего, как основани€ с образованием солей:
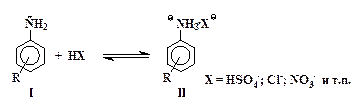
| (1) |
»з двух форм - свободного амина I и его соли II - перва€ содержит сильный электронодонорный заместитель -NH2, а втора€ Ц сильнейший электроноакцептор - группу -NH3+.
|
|
|
Ёлектрофильное замещение в сол€х типа II происходит значительно медленнее, чем в молекулах свободных аминов I. ќриентирующее действие амино- и аммонийной группы также различно: группа NH2 Ц сильный орто - пара -ориентант, а группа -NH3+ направл€ет электрофильные частицы в мета -положение.
¬ сильнокислой среде (в концентрированных кислотах: серной, сол€ной и т.п.) равновесие (1) почти полностью сдвинуто вправо при условии, что ароматическое €дро не содержит сильных электроно-акцепторных заместителей R. »з-за дезактивирующего вли€ни€ группы -NH3+ сульфирование анилина до сульфаниловой кислоты при комнатной температуре не происходит. ƒл€ сравнени€ можно указать на то, что при действии концентрированной серной кислоты на фенол последний легко превращаетс€ в смесь орто -, пара -сульфокислот и 2,4-дисульфокислоты фенола.
—ледует, однако, отметить, что даже в сильнокислых растворах очень активные электрофильные реагенты и окислители способны взаимодействовать со свободным амином, присутствующим в этих услови€х в ничтожной концентрации. Ќапример, концентрированна€ азотна€ кислота энергично окисл€ет анилин (в форме I) и в то же врем€ реагирует с его солью (форма II), образу€ некоторое количество мета -нитроанилина. ѕри действии концентрированной азотной кислоты на анилин образуетс€ много продуктов осмолени€ и следы мета -нитро≠анилина. ƒл€ получени€ из анилина п -нитроанилина, п -броманилина и т.п. приходитс€ прибегать к методу УзащитыФ аминогруппы, а точнее к ее временной дезактивации путем ацилировани€.
Ќапример, п -нитроанилин получают следующим образом:

| (2) |
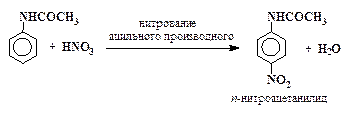
| (3) |

| (4) |
ѕревращени€ анилина в сульфаниловую кислоту включают в себ€ стадии (5 Ц 7), аналогичные превращени€м (2 Ц 4) с тем отличием, что в случае сульфировани€ анилина все последовательные реакции проход€т в одном сосуде и промежуточные вещества не выдел€ютс€.

| (5) |

| (6) |

| (7) |
Ѕольшинство сульфокислот очень хорошо раствор€етс€ в воде. ¬ отличие от них сульфанилова€ кислота, как и другие ароматические аминосульфокислоты, сравнительно малорастворима: в 100 мл воды при 20∞ — может растворитьс€ только около 1 г кислоты. јминосульфокислоты в кристаллическом состо€нии существуют в форме бипол€рных ионов, которые также называют внутренними сол€ми или цвиттер-ионами. ќбразование бипол€рного иона происходит в результате внутримолекул€рного взаимодействи€ аминогруппы, обладающей слабо-основными свойствами, с сульфогруппой, кислотные свойства которой по силе сопоставимы с серной кислотой:

ќрганические соединени€, образующие бипол€рные ионы, имеют очень прочные ионные кристаллические решетки. Ёнергии, выдел€ющейс€ при гидратации частиц VI, недостаточно дл€ компенсации энергетических затрат, необходимых дл€ разрушени€ кристаллической решетки сульфаниловой кислоты. Ёто и €вл€етс€ причиной малой растворимости сульфаниловой кислоты в воде.
онтрольные вопросы
1. Ќапишите уравнени€ всех промежуточных стадий при превращении анилина в сульфаниловую кислоту. ѕочему в отличие от фенола анилин при действии серной кислоты не образует сульфокислот при комнатной температуре?
2. Ќапишите уравнение реакции, на которой основано определение конца процесса превращени€ анилина в сульфаниловую кислоту.
3. ѕочему в отличие от большинства других сульфокислот (например, п -толуолсульфокислоты) сульфанилова€ кислота малорастворима в воде?
4. ѕочему малорастворима€ в воде сульфанилова€ кислота хорошо раствор€етс€ в водной щелочи?
5. акие меры предосторожности надо предпринимать в процессе синтеза сульфаниловой кислоты?






