Ёлектроотрицательные группы, присоединенные к углероду, способны в определенных услови€х замещатьс€ на другие атомы и группы. ¬ общем виде такие процессы могут быть представлены схемами (1, 2). Ќа первой показан процесс замещени€ у sp 3-гибридизо≠ванного (насыщенного) атома углерода:
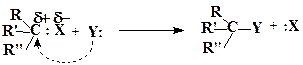
| (1) |
на второй Ц у карбонильного sp 2-гибридизованного:
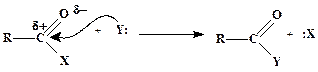
| (2) |
”ход€щие группы X унос€т с собой электронную пару, с помощью которой они были св€заны с углеродом, поэтому они отщепл€ютс€, как правило, в виде анионов. ќднако если в субстрате группа X была зар€жена положительно (например, в протонированном спирте Ќ2ќÅЦR), то она отщепл€етс€ в виде нейтральной молекулы (H2O).
„астицы, обладающие подвижной парой электронов и способные атаковать положительно зар€женный атом углерода, замеща€ наход€щиес€ у него электроотрицательные группы X, называютс€ нуклеофилами.
Ќуклеофильна€ частица Y об€зательно должна иметь подвижную, обычно неподеленную, электронную пару, котора€ необходима дл€ образовани€ новой ковалентной св€зи C-Y.
–еакции нуклеофильного замещени€ обозначаютс€ символами SN (от английского nucleophilic substitution).
Ќуклеофилами €вл€ютс€: Ќ2ќ:, Ќќ:─, RÖH, RO:─, RCOO:─, H2S:, HS:─,:SHR,:NH3,:NH2R,:NHR2, F:─, Cl:─, Br:─, I:─,:CN─,:NO2─ и т. д.
ак следует из приведенного списка, нуклеофилы часто (хот€ и не всегда) €вл€ютс€ отрицательно зар€женными частицами. ¬се нуклеофилы Ц основани€, однако нуклеофильность частицы и ее основность Ц не одно и то же. ѕод нуклеофильностью понимаетс€ способность взаимодействовать с положительно зар€женным атомом углерода, а под основностью Ц с протоном. ѕоэтому увеличение нуклеофильности далеко не всегда сопровождаетс€ ростом основности. “ак, бромид-анион Br─ по своему нуклеофильному действию почти равноценен OH─, но €вл€етс€ по сравнению с ним несравнимо более слабым основанием.
Ќуклеофильное замещение у sp3-гибридизованного атома углерода
¬ качестве уход€щих групп в процессах, проход€щих по схеме (1), чаще всего выступают галогены, фрагменты кислот
(-OSO3H, ‑ONO2), гидроксильна€ группа. √алогены по легкости замещени€ можно расположить в р€д:I > Br > Cl > > F.
¬ общем случае уход€ща€ группа X замещаетс€ тем труднее, чем слабее выражены кислотные свойства HX. ¬ случае спиртов (X = OH) гидроксид-анион Ц плоха€ уход€ща€ группа, так как его сопр€женной кислотой €вл€етс€ вода H-OH Ц очень слаба€ кислота. ƒл€ осуществлени€ нуклеофильного замещени€ спиртовой ќЌ-группы реакцию провод€т в среде сильной кислоты (чаще всего Ц серной). ¬ этих услови€х гидроксильна€ группа спирта протонируетс€ и превращаетс€ в хорошую уход€щую группу Ќ2ќ+ Ц (H3O+ Ц сильна€ кислота):
ROH + H2SO4  ROH2+ + HSO4- (3)
ROH2+ + HSO4- (3)
—пирты с серной кислотой образуют также сложные эфиры (алкилсер≠ные кислоты):
 (4)
(4)
| алкилсерные кислоты |
ћожно видеть, что как в стадии (3), так и в стадии (4) образуютс€ соединени€ с хорошими уход€щими группами. ќни и участвуют в дальнейших реакци€х нуклеофильного замещени€:
|
|
|
ROH2+ + Br-  RBr + H2O
RBr + H2O
ROSO3H + Br-  RBr + HSO4-
RBr + HSO4-
ћеханизмы реакций нуклеофильного замещени€ разнообразны. ѕри замещении у sp 3-гибридизованного атома углерода наиболее характерны мономолекул€рный SN1:
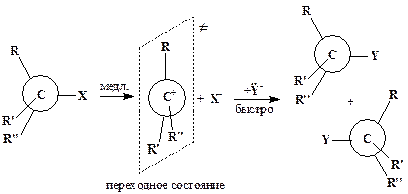
и бимолекул€рный SN2 механизмы:
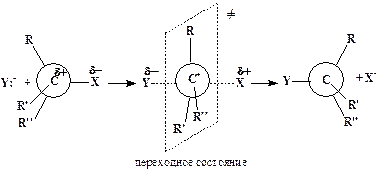
÷ифры 1 и 2 в этих символах обозначают число частиц, взаимодействие которых приводит к переходному состо€нию (состо€ние с максимальной величиной потенциальной энергии системы). ≈сли процесс состоит из нескольких последовательных элементарных стадий, то молекул€рность определ€етс€ самой медленной реакцией.
ћожно видеть, что процесс SN1 включает две элементарные реакции, причем медленна€ стади€ представл€ет собой мономолекул€рный разрыв св€зи —-’. ѕереходное состо€ние SN2-типа достигаетс€ при столкновении двух частиц (Y- и R3CX), следовательно, этот процесс бимолекул€рный.
—корости реакций, проход€щих по SN1-механизму, завис€т только от концентрации соединени€ RX:
v = k. c RX
(v Ц скорость реакции, k Ц константа скорости, c RXЦ концентраци€ субстрата), в то врем€ как скорости SN2-процессов увеличиваютс€ пр€мо пропорционально концентраци€м и субстрата, и нуклеофильного реагента (с Y):
v = k. c RX. с Y
ћолекул€рность процессов нуклеофильного замещени€ (SN1 или SN2) зависит от многих факторов: природы субстрата, растворител€, активности нуклеофила.
—убстраты, способные образовывать относительно устойчивые карбокатионы в пол€рных растворител€х (вода, серна€ кислота, муравьина€ кислота и т. п.), реагируют по SN1-механизму. ним относ€тс€ соединени€, в которых уход€щие группы наход€тс€ у третичных углеродных атомов или у атомов в аллильном или бензильном положени€х. Ќиже представлено несколько примеров таких соединений:
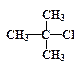
| —Ќ2=—Ќ-—Ќ2-Cl | 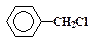
|
| трет -бутилхлорид, | хлористый аллил, | хлористый бензил. |
¬ первичных галогеналканах (например, в CH3CH2CH2Cl) замещение преимущественно проходит по механизму SN2.
¬торичные алкилгалогениды типа бромистого изопропила CH3CH(Br)CH3 реагируют одновременно по обоим механизмам, часть молекул Ц по SN1-, а часть Ц по SN2- механизму.
”скорение нуклеофильного замещени€ OH-группы в спиртах в присутствии сильных кислот обусловлено кислотным катализом. –еакции нуклеофильного замещени€, катализируемые кислотами, также могут протекать по мономолекул€рному и бимолекул€рному механизмам. ћономолекул€рный описываетс€ схемой:
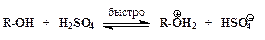
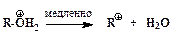
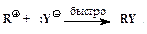
ѕоследовательность элементарных реакций бимолекул€рного замещени€ спиртовой гидроксильной группы имеет вид:
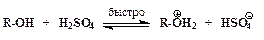
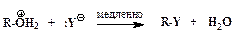
–еакции нуклеофильного замещени€ спиртов обратимы. ƒл€ того чтобы сместить равновесие в сторону алкилгалогенида в качестве реагента примен€ют газообразные галогеноводороды, либо реакцию провод€т в среде серной кислоты, св€зывающей воду, например:
—2H5OH + HCl(газ)  —2H5Cl + H≠2O
—2H5Cl + H≠2O
Ќуклеофильное замещение у sp2-гибридизованного
карбонильного углерода
Ётот вид замещени€ имеет место при взаимодействи€х:
а) карбоновых кислот со спиртами (реакции этерификации),
б) практически всех функциональных производных карбоновых кислот Ц сложных эфиров, ангидридов, галогенангидридов, амидов и т.п. Ц с водой (реакции гидролиза производных карбоновых кислот),
в) галогенангидридов и ангидридов карбоновых кислот с аммиаком, фенолами, и т. п. (реакции ацилировани€ соответствующих классов соединений).
|
|
|
¬се эти взаимодействи€ в общем виде описываютс€ схемой (2). Ќапример, уравнение ацилировани€ анилина с помощью уксусного ангидрида (см. основную реакцию синтеза ацетанилида по методу ј, стр. 63) получаетс€ из схемы (2) при R = CH3, X = OCOCH3, Y = C6H5NH2.
–еакционна€ способность перечисленных соединений чрезвычайно сильно зависит от природы заместител€ ’: чем выше электронодонорные свойства ’, тем ниже положительный зар€д на карбонильном атоме углерода и тем медленнее протекает реакци€. Ќапример, хлорангидрид уксусной кислоты —Ќ3—ќ-Cl с водой реагирует едва ли не со взрывом, тогда как диметилацетамид —Ќ3CO-N(CH3)2 медленно гидролизуетс€ лишь при кип€чении с водными растворами кислот (серной, сол€ной и т.п.).
арбоновые кислоты (RCO-OH), их сложные эфиры (RCO-OR¢) и амиды кислот (RCO-NH2, RCO-NHR¢, RCO-NHR¢2) характеризуютс€ относительно низкой реакционной способностью, так как группы -OH, -OR, -NH2, -NHR и -NR2 сопр€жены с соседней двойной св€зью —=ќ и про€вл€ют электронодонорные свойства. ѕоэтому дл€ этих соединений процессы нуклеофильного замещени€ у sp 2-гибридизован≠ного атома углерода осуществл€ют каталитически при содействии сильных кислот.
–оль кислоты и в этом случае заключаетс€ в протонировании карбонильного атома кислорода, имеющего следствием рост положительного зар€да на соседнем углеродном атоме:
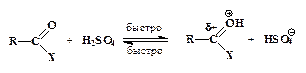
ƒалее происходит присоединение нуклеофила к карбонильному атому углерода с образованием промежуточного продукта (интермедиата):
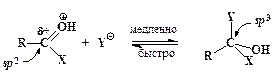
интермедиат
Ёто лимитирующа€, сама€ медленна€ стади€ процесса. “аким образом, реакци€ замещени€ в целом классифицируетс€ как бимолекул€рна€. јтакуемый атом углерода в процессе образовани€ интермедиата измен€ет свое валентное состо€ние от sp 2- до sp 3-, следовательно углы между s-св€з€ми, которые образует этот атом, уменьшаютс€ от 120∞ до ~109∞ (заместител€м вокруг этого атома становитс€ УтеснееФ). ѕоэтому на скорость процессов нуклеофильного замещени€ у sp 2-гибридизован≠ного атома углерода значительное вли€ние оказывают величины объемов групп R, X и Y. „ем они больше, тем медленнее при прочих равных услови€х лимитирующа€ стади€ образовани€ интермедиата и, следовательно, медленнее проходит весь процесс замещени€.
»нтермедиат неустойчив и быстро отщепл€ет либо HX, превраща€сь таким образом в продукт замещени€, либо HY, что возвращает его в начальное состо€ние.
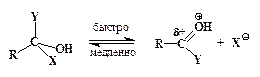
ѕроцесс завершаетс€ отщеплением Ќ+ от карбонильной группы:
–еакции нуклеофильного замещени€ у карбонильного атома, катализируемые сильными кислотами, обратимы. ¬ажно отметить, что пр€ма€ и обратна€ реакции имеют одни и те же промежуточные соединени€. Ётот частный пример иллюстрирует общий дл€ всех обратимых реакций принцип микроскопической обратимости химических процессов. Ќиже приведен пример, конкретизирующий данную схему и показывающий единый механизм обратимого процесса этерификации и гидролиза сложного эфира.
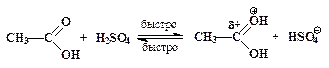
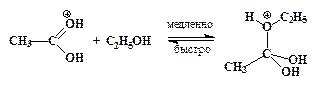
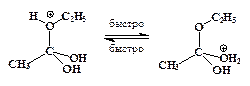
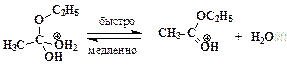
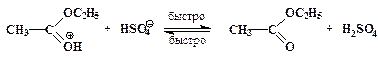
√идролиз производных карбоновых кислот (сложных эфиров, амидов, ангидридов, галогенангидридов) проходит не только в кислой, но также и в щелочной среде при участии гидроксид-анионов. ≈стественно, карбоновые кислоты в щелочной среде образуютс€ в виде карбоксилат-ионов RCOO-, которые превращают в недиссоциированную форму RCOOH действием сильных кислот. ѕримером щелочного гидролиза производных карбоновых кислот может служить реакци€ расщеплени€ ацетанилида:
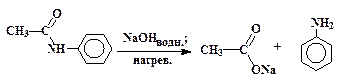
| ацетанилид или фениламид уксусной кислоты | ацетат натри€ | анилин |
ћеханизм щелочного гидролиза функциональных производных карбоновых кислот показан на следующей схеме:
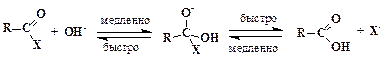
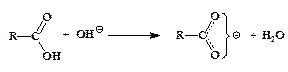
ƒве первые реакции равновесны, однако треть€ в услови€х избытка щелочи оказываетс€ практически необратимой. ѕричиной этого €вл€етс€ высока€ устойчивость карбоксилатного иона, обусловленна€ делокализацией отрицательного зар€да, в равной мере принадлежащего обоим атомам кислорода.
Ѕолее подробные сведени€ об особенност€х протекани€ и механизмах нуклеофильных реакций замещени€ представлены в учебниках по органической химии, например, в [9].
|
|
|
онтрольные вопросы
1. акие реагенты называютс€ нуклеофильными? ѕриведите типичные примеры нуклеофильных реагентов.
2. Ќапишите уравнени€ типичных реакций нуклеофильного замещени€ алкилгалогенидов.
3. »зобразите схемы реакций нуклеофильного замещени€ алкилгалогенидов SN1- и SN2-типа.
4. ¬ чем особенность реакций нуклеофильного замещени€ спиртов? ѕокажите механизм реакции превращени€ 1-пропанола в 1-бром≠пропан.
5. Ќапишите уравнени€ реакций, иллюстрирующих механизм образовани€ трет -бутилхлорида из трет- бутанола.
6. акие производные карбоновых кислот вступают в реакции нуклеофильного замещени€? акое вли€ние оказывает природа заместителей на реакционную способность функциональных производных карбоновых кислот?
7. Ќа примере хлористого бензоила —6Ќ5—ќCl покажите основные типы нуклеофильных реакций замещени€.
8. »зобразите механизм щелочного гидролиза бутилового эфира уксусной кислоты (бутилацетата) —Ќ3—ќќ—4Ќ9.
9. »зобразите механизм кислотного гидролиза N,N-диметилфор≠мамида.
Ѕромистый изопропил
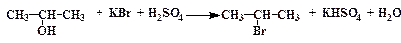
—обирают установку, изображенную на рис. 10. ¬ приемник наливают столько воды, чтобы конец алонжа касалс€ ее поверхности. ¬ колбу, котора€ будет служить реакционным сосудом, наливают 18 мл свежеперегнанного изопропилового спирта (см. примечание 1), 12 мл воды, а затем осторожно при размешивании и охлаждении 5 мл концентрированной серной кислоты.
—месь охлаждают до 10 Ц 15 ∞— холодной водой и при перемешивании добавл€ют 17 г бромистого кали€, тонко измельченного в ступке. –еакционную смесь нагревают на сетке. ѕары бромистого изопропила вместе с некоторым количеством спирта, воды и диизопропилового эфира, образующегос€ в качестве побочного продукта, проход€т через дефлегматор и конденсируютс€ в холодильнике. ѕри слишком энергичном нагревании в приемник может перейти также и часть Ќ¬r. Ѕромистый изопропил летуч, поэтому его собирают под слоем воды в сосуде, частично заполненном водой.
Ќагрев смеси продолжают до тех пор, пока в приемник не перестанут поступать масл€нистые капли, опускающиес€ на дно. “емпература паров на выходе из дефлегматора в конце реакции достигает 90 Ц 95 ∞—.
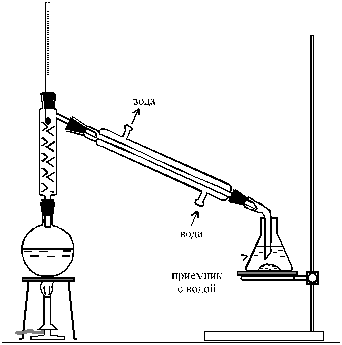
–ис. 9. ”становка дл€ получени€ бромистого изопропила
—одержимое приемника перенос€т в делительную воронку и как можно тщательнее отдел€ют нижний слой от воды, собира€ его в сухую колбочку или стаканчик (см. примечание 2). ƒл€ удалени€ небольшого остатка воды, захваченного органическим слоем, его УосушаютФ с помощью безводного хлористого кальци€. „ерез 20 Ц 30 мин после внесени€ безводного —а—l2 жидкость над ним становитс€ прозрачной, что указывает на почти полное св€зывание воды.
ƒл€ перегонки бромистого изопропила используют ту же установку, в которой проводили синтез. олбу, дефлегматор и приемник перед перегонкой высушивают. ѕриемник взвешивают. ќтдел€ют бромистый изопропил от твердого осадка —аCl2 декантацией (сливанием через край) в перегонную колбу. ћедленно перегон€ют бромистый изопропил, отбира€ фракцию с температурой кипени€ до 60 ∞—. —нова взвешивают приемник и по разности весов определ€ют массу полученного продукта. »змер€ют его показатель преломлени€. ƒл€ чистого бромистого изопропила n D20 = 1,4251, “ кип = 59 ∞—. ¬ыход Ц 80 %.
ѕримечани€:
1. ≈сли использовать не свежеперегнанный изопропиловый спирт, то в р€де случаев реакционна€ смесь при нагревании начинает сильно пенитьс€.
»зопропиловый спирт можно перегнать, использу€ установку, предназначенную дл€ синтеза (рис. 10), только перегонную колбу следует нагревать не на сетке, а на вод€ной бане. ƒл€ перегонки следует вз€ть 25 мл спирта. ѕервые 2 мл погона собирают в отдельный сосуд. ‘ракцию, перегон€ющуюс€ при 80 Ц 81 ∞C, далее используют дл€ проведени€ реакции. ¬ перегонной колбе должно остатьс€ 1 Ц 2 мл жидкости. ќстаток соедин€ют с первой фракцией и сливают в специально предназначенный дл€ этой цели сосуд. ≈сли эту же колбу, из которой перегон€ли спирт, предполагаетс€ использовать в качестве реакционного сосуда, то после проведени€ перегонки ее следует ополоснуть водой.
|
|
|
—ледует иметь в виду и учитывать при расчетах то обсто€тельство, что обычный изопропиловый спирт представл€ет собой азеотропную (т.е. нераздельнокип€щую) смесь 2-пропанола (88,0 %) и воды (12 %). “емпература кипени€ этого азеотропа (80,4 ∞C) ниже, чем чистого 2-пропанола (82 ∞—).
2. ѕолученный продукт содержит некоторое количество диизопропилового эфира (“ кип 68 ∞—, n D20 1,368). ≈го можно удалить путем обработки органического сло€, тщательно отделенного от воды, концентрированной серной кислотой. ƒл€ этого органический слой переливают снова в делительную воронку, добавл€ют 5 мл концентрированной серной кислоты и встр€хивают содержимое воронки (не переворачива€ ее и убедившись заранее, что кран воронки при встр€хивании не вылетит). ƒиизопропиловый эфир при этом переходит в сернокислотный слой, который отдел€ют, а оставшийс€ в делительной воронке бромистый изопропил промывают водой. ѕродукт тщательно отдел€ют от воды, высушивают безводным хлористым кальцием и перегон€ют.






