САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Загальна характеристика елементів IБ та IIБ підгруп.
2.Хімічні властивості солей елементів IБ та IIБ підгруп, їх оксидаційно-відновні властивості.
3.Добування і властивості комплексних сполук елементів IБ та IIБ підгруп.
4.Сполуки Аргентуму, їх кислотно-основні та оксидаційно-відновні характеристики.
5.Кадмій і його сполуки в порівнянні з аналогічними сполуками Цинку.
6.При дії розчину натрію гідроксиду на 6 г сплаву алюмінію та міді виділилось 3,7 дм3 газу, виміряного при н.у. Визначіть масову частку міді в сплаві.
7.При розчиненні у сульфатній кислоті 5,24 г суміші купруму (II) оксиду і цинку оксиду утворилось 10,446 г безводних купруму (II) сульфату і цинку сульфату. Визначте склад суміші.
8.Під час аналізу суміші заліза, золота й міді спочатку 12 г її обробили концентрованою нітратною кислотою, отримавши 5,6 дм3 газу бурого кольору. Потім таку ж наважку суміші обробили розчином хлоридної кислоти, отримавши 1,12 дм3 водню. Встановіть масову частку золота в суміші.
9.Взаємодія міді та срібла з повітрям (позеленіння мідних та почорніння срібних виробів).
10.Розчинення золота в “царській воді”. Написати рівняння реакції.
11.Скласти формули комплексних йонів для Cu2+, Au3+ з координаційним числом 4 та лігандами: NH3, H2O, Cl-, CN-. Дописати зовнішню координаційну сферу і дати назву комплексним сполукам.
12.Як одержати із сулеми меркурію (II) оксид? Написати рівняння реакції.
13.Як розташовані Zn, Cd, Hg в ряді стандартних електродних потенціалів металів? Написати рівняння реакцій взаємодії цих металів з розведеними і концентрованими розчинами хлоридної, сульфатної та нітратної кислот.
14.Написати формули сполук підгруп Купруму та Цинку, які мають застосування в медицині.
15.Одержання і застосування в фармацевтичному аналізі реактиву Несслера.
КОНТРОЛЬНІ ПИТАННЯ
1.Здатність Аргентуму до комплексоутворення, комплексні сполуки з галогенідами, аміаком, тіосульфат-йоном.
2.Хімічні основи застосування сполук Аргентуму як лікарських препаратів і у фармацевтичному аналізі.
3.Аурум, хімічні властивості простої речовини.
4.Сполуки Ауруму (I) та Ауруму (III), їх кислотно-основні та оксидаційно-відновні характеристики, здатність до комплексоутворення.
5.Бактерицидні властивості йону Аргентуму.
6.Хімічні основи застосування сполук Ауруму в медицині і фармації.
7.Меркурій, відмінні від Цинку і Кадмію властивості: понижена хімічна активність простої речовини, ковалентність зв’язків.
8.Оксидація Меркурію сіркою та нітратною кислотою.
9.Хімізм токсичної дії сполук Кадмію та Меркурію.
10.Хімічні основи застосування сполук Меркурію в медицині і фармації.
11.Здатність Меркурію (I) та Меркурію (II) до комплексоутворення.
12.Препарати срібла, золота, ртуті, що застосовуються в медичній практиці.
13.У розчин, що містить 4,12 г двовалентного металу у вигляді сульфату, занурили цинкову пластинку. Після повного виділення металу маса пластинки збільшилася на 0,94 г. Визначте метал.
14.Який об’єм розчину з масовою часткою нітратної кислоти 10% (ρ=1,05 г/см3), необхідний для розчинення міді масою 2,5 г?
САМОСТІЙНА АУДИТОРНА РОБОТА
Відповідати на запитання з використанням записів на дошці та виконати тестові завдання з теми “d-Елементи ІБ та ІІБ груп. Купрум, Аргентум, Аурум. Цинк, Кадмій, Меркурій” за варіантом, запропонованим викладачем.
ЛІТЕРАТУРА
1.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
2.Коровин Н.В. Общая химия. –М.: Высшая школа, 1998. –559 с.
3.Угай Я.А. Общая и неорганическая химия. –М.: Высшая школа, 1997. –527 с.
4.Конспект лекцій.
5.Практикум з загальної та неорганічної хімії: Посібник // Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. –Х.: Основа, 1998. –119 с.
6.Неорганическая химия.: Учебное пособие для студ. фармац. спец. вузов (Практикум) // А.К.Сухомлинов, Н.В.Боровская, П.Я.Пустовар и др. –Киев: Высшая школа, 1983. –167 с.
7.Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. К.: Вища школа, 1991. –430 с.
8.Романова Н.В. Загальна та неорганічна хімія. К.: Вища школа, 1998. –480 с.
9.Ахметов Н.С. Общая и неорганическая химия.: Учебное пособие для студ. хим.-техн.спец. вузов. –М.: Высшая школа, 1998. –743 с.
10.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. –М.: Высшая школа, 1993. –592 с.
11.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії / За ред. В.С.Телегуса: Підручник. –Львів: Світ, 2000. –424 с.
12.Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. К.: Либідь, 1996. –151 с.
13.Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін. К.: Школяр, 1997. –48 с.
14.Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. –К.: ІЗМН, 1996. –256 с.
15.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990. –352 с.
16.Яцимирський К.Б., Яцимирський В.К. Хімічний зв’язок. К.: Вища школа, 1993. –309 с.
17.Фримантл М. Химия в действии: В 2-х ч. / Пер. с англ. –М.: Мир, 1991. –Ч.1.-528 с.; Ч.2. –622 с.
18.Загальна та неорганічна хімія: Підруч. для студ. вищ. навч. закл. (Ч.2) // О.М.Степаненко, Л.Г.Рейтер, В.М.Ледовських, С.В.Іванов. –К.: Пед. Преса, 2000. -784 с.
19.Оганесян Э.Т. Неорганическая химия для фармацевтических вузов. –М.: Высшая школа, 1983. –523 с.
20.Перепелиця О.П. Властивості та екологічний вплив хімічних елементів: Довідник. –К.: Вентурі, 1997. –192 с.
ЗАНЯТТЯ №39
ТЕМА: Загальна характеристика s- та d-елементів. Гідроген та його сполуки. Лужні та лужноземельні метали. Лабораторна робота.
АКТУАЛЬНІСТЬ: Гідроген, лужні та лужноземельні метали у складі різних сполук входять до складу різних лікарських препаратів, які широко використовуються в фармацевтичній практиці.
НАВЧАЛЬНІ ЦІЛІ: Ознайомлення та вивчення властивостей Гідрогену, лужних та лужноземельних металів.
ЗНАТИ: -ізотопи Гідрогену;
-хімічні та фізичні властивості водню, лужних та лужноземельних
металів;
-структуру зовнішнього електронного рівня елементів IА та IIА
підгруп;
-хімічні властивості гілрогену пероксиду.
ВМІТИ: -теоретично обгрунтувати можливі типи молекул Гідрогену;
-урівнювати оксидаційно-відновні реакції за участю елементів IА
та IIА підгруп;
-проводити порівняльну характеристику фізико-хімічних
властивостей елементів на основі електронної будови їх атомів.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Напишіть усі теоретично можливі типи молекул Гідрогену, різні за ізотопним складом.
2.Наведіть приклади сполук, у яких Гідроген поводить себе, як типовий галоген.
3.Добування металів IА та IIА підгруп, їх зберігання та застосування.
4.Біологічна роль елементів IА та IIА підгруп.
5.Оксидаційно-відновні властивості гідрогену пероксиду.
6.Хімічні та фізичні властивості води. Важка вода.
7.Яка маса калію карбонату міститься в 400 см3 0,2н розчину?
8.Через 40 г розчину з масовою часткою натрію гідроксиду 10% пропустили 2,24 дм3 вуглекислого газу (н.у.). Яка сіль та якої маси утворилася при цьому?
9.За допомогою відповідних рівнянь реакцій здійсніть перетворення:
Na2CO3 → NaHCO3 → Na2CO3 → BaCO3 → CO2 → CaCO3 → Ca(HCO3)2.
10.На нейтралізацію розчину, утвореного при взаємодії кальцію гідриду з водою, використано 104 см3 розчину хлоридної кислоти з масовою часткою 10% (ρ=1,049 г/см3). Обчисліть масу кальцію гідриду та об’єм водню, що виділився (н.у.).
11.Що таке гіпс? Як відбувається його термічний розклад? Де застосовують один із продуктів розкладу та яка властивість речовини використовується при цьому?
12.Напишіть рівняння хімічних реакцій:
а) KO3 + KI + H2SO4 →
б) Na2O2 + K2Cr2O7 + H2SO4 →
в) K2O2 + H2S →
г) Na2O2 + N2H4 + H2SO4 →
д) Na2O2 + KMnO4 + H2SO4 →
е) Na2O2 + H2SO4 →
13.Обчисліть об’єм 2н розчину хлоридної кислоти, необхідний для нейтралізації розчину, що містить 20,2 г натрію гідроксиду.
14.Визначити рН розчину, в 1 л якого міститься 0,2 г натрію гідроксиду. Дисоціацію лугу вважати повною.
15.Яка маса гідрогену хлориду міститься в 0,25 дм3 10,52% розчину хлоридної кислоти з густиною 1,05 г/см3.
16.Обчисліть молярність 40% розчину натрію гідроксиду, питома густина якого дорівнює 1,45 г/см3.
17.При розчиненні 1 г вапняку у хлоридній кислоті одержано 168 см3 газу (н.у). Визначте масову частку в % кальцій карбонату у вапняку, що містить некарбонатні домішки.
18.Обчисліть масову частку KOH (%) в 2М розчині, питома густина якого дорівнює 1,14 г/см3.
КОНТРОЛЬНІ ПИТАННЯ
1.Перечисліть технічні та лабораторні методи одержання водню?
2.Чому атомарний водень значно активніший від звичайного?
3.Чому Гідроген займає в періодичній системі елементів двоїсте положення?
4.На основі яких властивостей водень можна вважати універсальним джерелом енергії?
5.Будова молекули гідрогену пероксиду та його добування.
6.Застосування в медицині гідрогену пероксиду.
7.Вода, поширення в природі. Твердість води, способи її усунення.
8.Оксиди, гідроксиди, гідриди, карбіди, сульфіди, нітриди, пероксиди елементів IА та IIА підгруп. Структура. Добування. Взаємодія з водою.
9.Солі елементів IА та IIА підгруп. Застосування.
10.Методи добування соди. Застосування в медицині.
11.Вкажіть суму молярних мас сполук, що утворюються при окисненні на повітрі натрію і калію.
12.Обчисліть масову частку калій сульфату в 0,5М його розчині з густиною 1,11 г/см3.
13.Визначте рН 0,02М розчину КОН за умови, що a=1.
14.У циліндр з водою опустили 5 г кальцію. Який об'єм газу (н.у.) при цьому утвориться?
15.Вода, яка містить лише Mg(HCO3)2, має твердість 3,5 моль/м3. Яка маса магнію гідрокарбонату міститься в 200 дм3 такої води?
16.Чому дорівнює карбонатна твердість води, якщо в 1 дм3 її міститься 0,292 г Mg(HCO3)2 і 0,2025 г Ca(HCO3)2?
16.Чому дорівнює твердість води, якщо для її усунення до 50 дм3 води необхідно додати 21,2 г натрію карбонату?
17.Крізь розчин, що містить 22,4 г калій гідроксиду, пропустили 9,9 г вуглекислого газу. Які утворилися солі та яка маса кожної з них?
18.При повному термічному розкладі кальцій карбонату, що містив домішку кварцового піску, із 20 г речовини утворилося 12 г залишку. Визначте масову частку домішки у кальцій карбонаті.
19.Після прожарювання 8 г суміші кальцій карбонату та барій карбонату утворився залишок оксидів масою 5 г. Якою була масова частка кальцій карбонату у вихідній суміші?
20.Визначте масу натрію, яку треба розчинити в 1 дм3 води, щоб добути розчин лугу з масовою часткою 2%.
21.Скільки грамів кристалогідрату BaCl2•2H2O та води треба взяти для приготування 200 г 5,7%-го розчину барій хлориду?
САМОСТІЙНА АУДИТОРНА РОБОТА
1.Виконання дослідів, описаних в даних методичних вказівках.
2.Обговорення результатів та оформлення висновків.
3.Оформлення та захист протоколу.
4.Відповіді на запитання, запропоновані викладачем, з використанням записів на дошці.
5.Розв'язування розрахункових задач, запропонованих викладачем.
6.Урівнювання рівнянь реакцій, запропонованих викладачем.
Експериментальна частина
Завдання 1. Одержання водню з води за допомогою кальцію
Покладіть у пробірку 2-3 невеликі кусочки кальцію, налийте 4-5 см 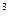 дистильованої води, закрийте корком з відтягнутою скляною трубкою і закріпіть її в затискачі штатива. Зверніть увагу на перебіг реакції.
дистильованої води, закрийте корком з відтягнутою скляною трубкою і закріпіть її в затискачі штатива. Зверніть увагу на перебіг реакції.
Через 2-3 хв. перевірте чистоту водню. Для цього надіньте на газовідвідну трубку, перевернену отвором вниз суху пробірку і зберіть у пробірці водень. Через 1-2 хв., не перевертаючи, зніміть пробірку і закривши отвір великим пальцем піднесіть її до полум'я пальника, а потім відвівши палець від отвору, підпаліть водень. Якщо при цьому полум'я проскакує всередину пробірки з вибухом, то з приладу повітря ще не витіснилося. Проробіть те саме кілька разів, поки водень не буде загорятися спокійно (з глухим, слабким звуком). Коли повітря повністю витісниться з приладу, запаліть водень при виході його з трубки. Зверніть увагу на блідо-блакитне полум'я водню. Над полум'ям потримайте круглодонну колбочку, наповнену холодною водою. Зверніть увагу на утворення на стінці колби крапельок води. Доведіть наявність лугу в пробірці за допомогою червоного лакмусового папірця. Напишіть рівняння реакцій. Прилад збережіть зібраним для дослідів з воднем.






