ЋјЅќ–ј“ќ–Ќ»… ѕ–ј “» ”ћ
Ќавчальний пос≥бник
ƒн≥пропетровськ, 2011
–екомендовано до друку науково-методичною радою агроногм≥чного факультету ƒн≥пропетровського державного аграрного ун≥верситету (протокол є 1 в≥д 1 вересн€ 2011 р.)
–ецензенти:
| ≤.≤. ярчук,доктор c≥льськогосподарських наук, професор (ƒн≥пропетровський державний аграрний ун≥верситет) | |
| ќ.…. √еллер,кандидат c≥льськогосподарських наук, доцент (ƒн≥пропетровський державний аграрний ун≥верситет) | |
„игв≥нцева ќ.ѕ., √оловТ€тинська ¬.¬.
Ќеорган≥чна х≥м≥€. ѕрактикум. Ќавчальний пос≥бник Ц ƒн≥пропетровськ, 2011. Ц 80 с.
Ќавчальний пос≥бник включаЇ теоретичну та експериментальну частини основних розд≥л≥в неорган≥чноњ х≥м≥њ. ѕризначений дл€ початкового систематичного вивченн€ неорган≥чноњ х≥м≥њ ≥ може слугувати навчальним пос≥бником дл€ студент≥в агроном≥чних спец≥альностей вищих учбових заклад≥в аграрного проф≥лю III-IV р≥вн≥в акредитац≥њ.
Ќавчальне виданн€
„»√¬≤Ќ÷≈¬ј ќльга ѕавл≥вна
√ќЋќ¬Тя“»Ќ—№ ј ¬≥ктор≥€ ¬≥кторовна
Ќ≈ќ–√јЌ≤„Ќј ’≤ћ≤я. ѕ–ј “» ”ћ
Ќавчальний пос≥бник
ѕ≥дписано до друку 29.10.11. ‘ормат 60 ´ 84 
ѕап≥р офсетний. √арн≥тура л≥тературна. ƒрук офсетний. ”мовн. друк.арк. 3,3
“ираж 500 прим. «ам. є 18.
¬—“”ѕ
ƒисципл≥на ЂЌеорган≥чна х≥м≥€ї складаЇтьс€ ≥з трьох частин, повТ€за-них м≥ж собою загальним п≥дходом та методолог≥Їю. ѕерша частина м≥стить у соб≥ матер≥ал стосовно основних пон€ть ≥ закон≥в неорган≥чноњ х≥м≥њ, а розгл€даЇ загальн≥ законом≥рност≥ прот≥канн€ х≥м≥чних процес≥в у розчинах. ƒруга частина дисципл≥ни м≥стить теоретичний матер≥ал в≥дносно умов прот≥канн€ окисно-в≥дновних процес≥в та властивостей комплексних сполук. ” трет≥й частин≥ розгл€нут≥ властивост≥ основних х≥м≥чних елемент≥в-органоген≥в та б≥ометал≥в, що в≥д≥грають важливу роль у розвитку системи грунт Ц рослина. ¬ивченн€ дисципл≥ни передбачаЇ засвоЇнн€ основних пон€ть ≥ закон≥в х≥м≥њ, розвиток сучасних погл€д≥в на будову атома ≥ речовини, законом≥рност≥ переб≥гу х≥м≥чних реакц≥й, основн≥ положенн€ сучасних теор≥й розчин≥в, електрол≥тичноњ дисоц≥ац≥њ, способ≥в вираженн€ складу розчин≥в; основних прийом≥в виконанн€ х≥м≥чних досл≥д≥в та математичноњ обробки одержаних результат≥в.
Ќавчальний пос≥бник ЂЌеорган≥чна х≥м≥€. ѕрактикумї, призначений дл€ студент≥в денного в≥дд≥ленн€ спец≥альност≥ Ђјгроном≥€ї ≥ складений у в≥дпов≥дност≥ з типовою програмою дисципл≥ни.
ожний розд≥л практикуму розпочинаЇтьс€ ≥з теоретичного матер≥алу, у €кому максимально стисло ≥ в доступн≥й форм≥ викладен≥ основн≥ теоретичн≥ положенн€ неорган≥чноњ х≥м≥њ. ƒл€ б≥льш повного вивченн€ дисципл≥ни, що базуЇтьс€ на експериментальних досл≥дженн€х, дуже важливим Ї виконанн€ лабораторного практикуму. ќбдумуванн€ плану досл≥ду, його постановка ≥ здобуванн€ результат≥в експерименту виховують у студента досл≥дницьк≥ навички, звичку до пошук≥в практичних п≥дтверджень набутих теоретичних положень, розвиваЇ њх х≥м≥чне мисленн€. “ому дл€ закр≥пленн€ теоретичних знань та отриманн€ практичних навичок ≥ техн≥ки х≥м≥чного експерименту в кожному розд≥л≥ пос≥бника запропонован≥ лабораторн≥ роботи. онтрольн≥ запитанн€ дл€ самоконтролю, наведен≥ в к≥нц≥ кожного розд≥лу, дозвол€ть студенту перев≥рити св≥й р≥вень знань ≥з дисципл≥ни, а ƒодатки можуть бути корисними дл€ виконанн€ цих контрольних завдань.
|
|
|
ЋјЅќ–ј“ќ–Ќј –ќЅќ“ј є 1
ќ—Ќќ¬Ќ≤ Ћј—» Ќ≈ќ–√јЌ≤„Ќ»’ —ѕќЋ”
“еоретична частина
ќксиди
ќксидами називають сполуки елемент≥в з ќксигеном. ¬они бувають солетворними (здатними утворювати сол≥) i несолетворними. —олетворн≥ оксиди можуть бути основними, кислотними та амфотерними. Ќесолетворними оксидами Ї Nќ,—ќта ≥н.
ќсновними називають оксиди, €к≥ утворюють сол≥ п≥д час взаЇмод≥њ з кислотами або кислотними оксидами i не взаЇмод≥ють з основами або основними оксидами.
ќсновним оксидам в≥дпов≥дають основи. Ќаприклад:
2ќ Ц ќЌ
—аќ Ц —а(ќЌ)2
FeO Ц Fe(OH)2
Xiмiчнi властивост≥
ќснов≥ оксиди взаЇмод≥ють:
Ц з водою
—аќ + Ќ2ќ → —а(ќЌ)2
Ц з кислотами
—аќ + H2SO4 → CaSO4 + H2O
Ц з кислотними оксидами
¬аќ + —ќ2 → ¬а—ќ3
Ц з амфотерними оксидами
—аќ + ZnO → CaZnO2.
ислотними називають оксиди, €к≥ утворюють сол≥ п≥д час взаЇмод≥њ з основами або основними оксидами i не взаЇмод≥ють з кислотами або кислотними оксидами.
ислотним оксидам в≥дпов≥дають кислоти. Ќаприклад:
—ќ2 Ц Ќ2—ќ3
–2ќ5 Ц Ќ3–ќ4
Xiмiчнi властивост≥
ислотн≥ оксиди взаЇмод≥ють:
Ц з водою
—ќ2 + Ќ2ќ → Ќ2—ќ3
Ц з основами
Sќ3 + 2NaOH → Na2SO4 + Ќ2ќ
Ц з основними оксидами
—ќ2 + —аќ → —а—ќ3
Ц з амфотерними оксидами
–2ќ5 + јl2ќ3 → 2јl–ќ4
јмфотерними називають оксиди метал≥в, €к≥ утворюють сол≥ п≥д час взаЇмод≥њ €к з кислотами або кислотними оксидами, так i з основами чи основними оксидами.
Xiмiчнi властивост≥
јмфотерн≥ оксиди взаЇмод≥ють:
Ц з кислотами (та кислотними оксидами)
ZnO + 2Ќ—1 → ZnCl2 + Ќ2ќ
Ц з основами (та основними оксидами)
ZnO + 2NaOH → Na2Znќ2 + Ќ2ќ.
Ќоменклатура оксид≥в
| «агальна формула i валентн≥сть елемента | Ќазва оксиду |
| ≈2ќ; N2ќ | Ќ≥троген (I) оксид |
| ≈ќ;—ќ | арбон (II) оксид |
| ≈2ќ3; Fe2O3 | ‘ерум (III) оксид |
| ≈ќ2;—ќ2 | арбон (IV) оксид |
| ≈2ќ5; –2ќ5 | ‘осфор (V) оксид |
| ≈ќ3; SO3 | —ульфур (VI) оксид |
| ≈2ќ7; —12ќ7 | ’лор (VII) оксид |
| ≈ќ4; OsO4 | ќсм≥й (VIII) оксид |
ќснови
ќсновами називають сполуки, до складу €ких вход€ть кат≥они металу та г≥дроксильн≥ групи. ≤нша назва основ Ц г≥дроксиди. –озчинн≥ у вод≥ основи називають лугами.
Xiмiчнi властивост≥
ќснови взаЇмод≥ють:
Ц з кислотами (реакц≥€ нейтрал≥зац≥њ)
NaOH + Ќ—l → NaCl + Ќ2ќ
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Ц з кислотними оксидами
2NaOH + —ќ2 → Na2CO3 + Ќ2ќ
—а(ќЌ)2 + —ќ2 → —а—ќ3 + Ќ2ќ
Ц з розчинами середн≥х i кислих солей (т≥льки луги)
2 ќЌ + CuCl2 → Cu(OH)2↓ + 2KC1
NaOH + NaHCO3 → Na2CO3 + Ќ2ќ
Ц основи розкладаютьс€ п≥д час нагр≥ванн€
Cu(OH)2  CuO + Ќ2ќ
CuO + Ќ2ќ
2Fe(OH)3  Fe2O3 + «Ќ2ќ
Fe2O3 + «Ќ2ќ
јмфотерн≥ г≥дроксиди
јмфотерн≥ г≥дроксиди одночасно можна розгл€дати i €к кислоти, i €к основи, тобто так≥ сполуки, в €ких √≥дроген може зам≥щуватись на атоми металу, а г≥дроксильна група Ц на кислотний залишок. Ќаприклад:
Zn(OH)2, ј1(ќЌ)3, Cr(OH)3, Sn(OH)4, Pb(OH)2тощо
|
|
|
јмфотерн≥ г≥дроксиди з кислотами реагують €к основи, а з основами Ц €к кислоти
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2NaOH → Na2Znќ2 + 2H2O
јмфотерн≥ г≥дроксиди добувають взаЇмод≥Їю розчину сол≥ металу з певною к≥льк≥стю лугу
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
A12(SO4)3 + 6KOH → 2A1(OH)3 + 3K2SO4
ислоти
ислотами називають сполуки, що м≥ст€ть атоми √≥дрогену, здатн≥ зам≥щуватись на атоми метал≥в з утворенн€м солей.
≥льк≥стю атом≥в √≥дрогену, здатних зам≥щуватис€ на атоми метал≥в, визначаЇтьс€ основн≥сть кислоти.
–озр≥зн€ють безоксигенов≥ та оксигеновм≥сн≥ кислоти.
Ѕезоксигенов≥ кислоти:
HFЦфлуоридна, або флуороводнева (плавикова) кислота;
Ќ—l Ц хлоридна, або хлороводнева кислота;
Ќ¬г Ц бром≥дна, або бромоводнева кислота;
HJ Ц йодидна, або йодоводнева кислота;
HCN Ц ц≥ан≥дна (синильна) кислота;
H2S Ц сульф≥дна або с≥рководнева кислота.
ќксигеновм≥сн≥ кислоти:
H2SO4 Ц сульфатна кислота (с≥рчана кислота);
H2SO3 Ц сульф≥тна кислота;
HNO3 Ц н≥тратна кислота (азотна кислота);
HNO2 Ц н≥тритна кислота;
Ќ3–ќ4 Ц ортофосфатна кислота;
ЌClO4 Ц перхлоратна кислота;
Ќ—lќ3 Ц хлоратна кислота;
Ќ—lќ2 Ц хлоритна кислота;
Ќ—lO Ц г≥похлоритна кислота;
Ќ3¬ќ3 Ц ортоборатна кислота;
H2Siќ3 Ц сил≥катна кислота.
’≥м≥чн≥ властивост≥
ислоти взаЇмод≥ють:
Ц з металами зг≥дно з р€дом електрох≥м≥чних потенц≥ал≥в метал≥в
Zn + Ќ2Sќ4 (розв.) → ZnSќ4 + Ќ2↑
—u + Ќ2Sќ4 (pозв.) ≠
—u + 2Ќ2Sќ4(конц.) → —uSќ4 + Sќ2↑+ 2Ќ2ќ
Ц з основними та амфотерними оксидами
—uќ + Ќ2Sќ4 → —uSќ4 + Ќ2ќ
Snќ + 2Ќ—l → Sn—l2 + Ќ2O
Ц з основами (реакц≥€ нейтрал≥зац≥њ)
—u(ќЌ)2 + 2Ќ—l → —u—12 + 2Ќ2ќ
2 ќЌ + Ќ2Sќ4 → 2Sќ4 + 2Ќ2ќ
Ц ≥з сол€ми, €кщо в результат≥ вид≥л€Їтьс€ газ або випадаЇ осад
Na2—ќ3 + 2Ќ—l → 2Na—l + —ќ2↑ + Ќ2ќ
¬а—l2 + Ќ2Sќ4 → ¬аSO4↓ + 2Ќ—l
—ол≥
—ол€ми називають продукт зам≥щенн€ атом≥в √≥дрогену у кислот≥ на атоми металу або г≥дроксильних груп у г≥дроксидах метал≥в на кислотн≥ залишки.
—ол≥ бувають середн≥, кисл≥ та основн≥.
—ередн≥ coлi Ї продуктом повного зам≥щенн€ атом≥в √≥дрогену кислоти на атоми металу NaCl, ZnSO4, Cu(NO3)2.
Ќазви середн≥х солей поход€ть в≥д назв кислот i метал≥в, з €ких утворен≥ сол≥: магн≥й сульфат MgSO4, натр≥й фосфат Na3PO4.
исл≥ сол≥ можна розгл€дати €к продукт неповного зам≥щенн€ атом≥в √≥дрогену кислоти на атоми металу. исл≥ сол≥, €к правило, утворюютьс€ в раз≥ надлишку кислоти i можуть бути перетворен≥ на середн≥ сол≥ д≥Їю основи:
—а(Ќ—ќ3)2 + —а(ќЌ)2 → 2—а—ќ3 + 2Ќ2ќ
Ќазви кислих солей поход€ть в≥д назв середн≥х солей з додаванн€м слова гiдpoген- або дигiдpoген-: кальц≥й г≥дрогенкарбонат, натр≥й диг≥дрогенфосфат —а(Ќ—ќ3)2, NaH2PO4
ѕодв≥йними сол€ми називають coлi, утворен≥ р≥зними кат≥онами i одним ≥ тим самим ан≥оном.
ѕрикладом може бути кристалог≥драт кал≥й-алюм≥н≥й сульфат Ц алюмокал≥Ївий галун, розгорнута формула €кого K2SO4 ∙ A12(SO4)3 ∙ 24H2O i скорочена KA1(SO4)2 ∙ 12Ќ2ќ. ”творенн€ подв≥йних сульфат≥в (галун≥в) Ї характерним дл€ низки тривалентних метал≥в (Al, Cr, Fe, V тощо).
3м≥шаними називаютьс€ coлi, yтвopeнi одним ≥ тим самим кат≥он-≥ном, але р≥зними ан≥онами.
Ќаприклад, Ba(Cl)NO3 Ц бар≥й хлорид-н≥трат, CaCl(OC1) Ц кальц≥й хлорид-г≥похлорит.
Xiмiчнi властивост≥
Cол≥ взаЇмод≥ють:
Ц з металами, зг≥дно з р€дом електрох≥м≥чних потенц≥ал≥в метал≥в
Zn + CuSO4 → ZnSO4 + Cu
Cu + ZnCl2 ≠
Ц з основами, €кщо внасл≥док реакц≥њ випадаЇ осад або вид≥л€Їтьс€ газ
FeCl3 + « ќЌ → Fe(OH)3↓ + 3KCl
2NH4Cl + —а(ќЌ)2 → —а—l2 + 2NH3↑ +2H2O
Ц з кислотами, €кщо внасл≥док реакц≥њ випадаЇ осад або вид≥л€Їтьс€ газ
FeS + H2SO4 → FeSO4 + H2S ↑
¬а—l2 + H2SO4 → BaSO4 ↓ + 2HCl
Ц з сол€ми, €кщо внасл≥док реакц≥њ випадаЇ осад
NaCl + AgNO3 → NaNO3 + AgCl ↓
¬а—12 + CuSO4 → CuCl2 + BaSO4 ↓
√енетичний зв'€зок м≥ж класами неорган≥чних сполук можна зобразити схемою:
|
|
|


1) Ca + O2 → 2CaO
2) CaO + H2O → Ca(OH)2
3) S + O2 → SO2
4) SO2 + H2O → H2SO3
5) Ca + S → CaS
6) CaO + SO2 → CaSO3
7) CaO + H2SO3 → CaSO3 + H2O
8) Ca(OH)2 + SO2 → CaSO3 + H2O
9) Ca(OH)2 + H2SO3 → CaSO3 + 2H2O
≈кспериментальна частина
ƒосл≥д 1.2.1. ¬заЇмод≥€ оксид≥в з водою
¬нести у проб≥рку небагато —аќ, —uќ, Znќ. ƒолити у кожну проб≥рку 3-4 крапл≥ дистильованоњ води ≥ збовтати. як≥ оксиди взаЇ≠мод≥ють з водою? Ќаписати р≥вн€нн€ реакц≥й.
ƒосл≥д 1.2.2. ќдержанн€ малорозчинних у вод≥ г≥дроксид≥в
ѕом≥стити у проб≥рки номер 1, 2, 3, 4 по 4-5 крапель розчин≥в Fе—l3, —uSќ4, ћn—l2 та NiSќ4 ≥ додати в кожну проб≥рку по 2-3 крапл≥ будь-€кого лугу. ўо при цьому в≥дбуваЇтьс€? «вернути увагу на кол≥р осад≥в. Ќаписати р≥вн€нн€ реакц≥й. ƒо осад≥в у проб≥рках є 3 ≥ є 4 додати роз≠чин Ќ2Sќ4. ўо в≥дбуваЇтьс€? Ќаписати р≥вн€нн€ реакц≥й.
ƒосл≥д 1.2.3. ќдержанн€ амфотерних г≥дроксид≥в
” проб≥рки пом≥стити по 6-8 крапель розчин≥в солей алюм≥н≥ю, цинку ≥ хрому (Ў). ” кожну проб≥рку додати 2-4 крапл≥ розчину лугу. ўо при цьому утворюЇтьс€? Ќаписати р≥вн€нн€ реакц≥й. ож≠ний ≥з одержаних осад≥в розд≥лити на дв≥ частини. ƒо одн≥Їњ частини додати розчин ЌNќ3, до другоњ Ц надлишок розчину лугу. ўо при цьому в≥дбуваЇтьс€? Ќаписати р≥вн€нн€ реакц≥й.
ƒосл≥д 1.2.4. ¬заЇмод≥€ основних оксид≥в з кислотами
” проб≥рку пом≥стити небагато —uќ, додати 3-4 крапл≥ розчи≠ну Ќ—l ≥ п≥д≥гр≥ти. ўо в≥дбуваЇтьс€? Ќаписати р≥вн€нн€ реакц≥й.
ƒосл≥д 1.2.5. ¬заЇмод≥€ сол≥ з с≥ллю
” проб≥рку до 3-5 крапель розчину ¬а—l2 додати 2-3 крапл≥ розчину Nа2Sќ4. ўо в≥дбуваЇтьс€? ” проб≥рку з 2-3 крапл€ми розчи≠ну јgNќ3 додати 1-2 крапл≥ —l. ўо в≥дбуваЇтьс€? Ќаписати р≥вн€нн€ реакц≥й. јналог≥чним способом одержати —а—ќ3.
1.3. онтрольн≥ запитанн€
| 1. | як≥ з наведених оксид≥в можуть реагувати один з одним: CaO; SO3; CO2; ZnO; Na2O; P2O5. —клад≥ть в≥дпов≥дн≥ р≥вн€нн€ реакц≥й. |
| 2. | Ќаписати формули кислотних оксид≥в, що в≥дпов≥дають наступним кислотам: H3BO3: H4P2O7; H2CO3; HNO2; H2SO3. |
| 3. | —класти р≥вн€нн€ реакц≥й утворенн€ магн≥й сульфату, виход€чи ≥з: а) магн≥ю; б) оксиду магн≥ю; в) магн≥ю г≥дроксиду; г) магн≥й карбонату. |
| 4. | « €кими ≥з вказаних речовин буде взаЇмод≥€ти цинк г≥дроксид: а) сульфур (lV) оксид; б) н≥тратна кислота; в) кальц≥й г≥дроксид; г) карбон (lV) оксид. |
| 5. | « €кими ≥з перел≥чених речовин буде реагувати хлоридна кислота: а) Na2SO3; б) Zn(OH)2; в) CaO; д) H3PO4; ж) NH3. |
| 6. | «д≥йсн≥ть перетворенн€: CO2 → Ca(HCO3)2 → CaCO3 → CaCl2. Ќазв≥ть утворен≥ сполуки. |
| 7. | —клад≥ть р≥вн€нн€ реакц≥й утворенн€ середн≥х солей м≥ж: а) натр≥й сил≥катом ≥ н≥тратною кислотою; б) кал≥й г≥дросульфатом ≥ кал≥й г≥дроксидом. |
| 8. | —класти р≥вн€нн€ реакц≥й взаЇмод≥њ: а) н≥троген (V) оксиду з кал≥й оксидом; б) фосфор (III) оксиду з натр≥й оксидом. |
| 9. | ≤з в≥дпов≥дноњ кислоти та основи утворити наступн≥ сол≥: HS; NaHSO3; (FeOH)2SO4; Ca(NO2)2. |
| 10. | Ќазв≥ть сол≥ та вкаж≥ть њх тип: Ca(NO3)2; Mg(OH)Cl; KHSO3; Al2(SO4)3. |
| 11. | —класти граф≥чн≥ формули солей: MgSO3; Na3PO3; Ba(NO2)2; CuS; KH2PO4. |
| 12. | ƒовести за допомогою в≥дпов≥дних р≥вн€нь реакц≥й амфотерний характер оксид≥в ZnO та Al2O3. |
| 13. | Ќазв≥ть оксиди, та вкаж≥ть њх тип та склад≥ть граф≥чн≥ формули K2O; SO3; Fе2O3; P2O5; ZnO. |
| 14. | «аписати реакц≥њ, за допомогою €ких можна зд≥йснити перетворенн€: AlCl3 Ѓ Al(OH)3 Ѓ KAlO2 Ѓ Al(OH)3 Ѓ Al2O3. |
ЋјЅќ–ј“ќ–Ќј –ќЅќ“ј є 2
ќ—Ќќ¬Ќ≤ «ј ќЌ» ’≤ћ≤„Ќ»’ ѕ≈–≈“¬ќ–≈Ќ№
“еоретична частина
ѕ≥д швидк≥стю х≥м≥чних реакц≥й розум≥ють зм≥ну концентрац≥њ oдн≥Їњ з реагуючих речовин за одиницю часу при пост≥йному тиску та температур≥.
|
|
|
онцентрац≥ю виражають у моль/л, а час Ц у секундах або хвилинах. –озгл€немо у загальному вигл€д≥ швидк≥сть реакц≥њ, що в≥дбуваЇтьс€ при пост≥йних температур≥ i тиску за р≥вн€нн€м:
ј + ¬ → — + D.
ѕо мiр≥ витрачанн€ речовини ј швидк≥сть реакц≥њ зменшуЇтьс€. «в≥дки випливаЇ, що швидк≥сть реакц≥њ можна визначити лише дл€ де€кого пром≥жку часу. ќск≥льки, концентрац≥€ речовини ј у момент часу t1 вим≥-рюЇтьс€ величиною c1,а у момент t2 Ц величиною с2, то за пром≥жок часу Δt= t2 - t1, зм≥на концентрац≥њ речовин буде становити Δс = с2 Ц с1,зв≥дки можна визначити середню швидк≥сть реакц≥њ (υ):

«нак Ђм≥нусї ставитьс€ тому, що, незважаючи на зменшенн€ концентрац≥њ речовини A i, отже, на в≥д`Їмне значени€ р≥зниц≥ с2 Ц c1 швидк≥сть реакц≥њ може бути т≥льки додатньою величиною. ћожна також стежити за зм≥ною концентрац≥њ одного з продукт≥в реакц≥њ Ц речовин — або D; вона п≥д час реакц≥њ буде зб≥льшуватись, i тому у прав≥й частин≥ р≥вн€нн€ необх≥дно ставити знак Ђплюсї.
ќск≥льки, швидк≥сть реакц≥њ весь час зм≥нюЇтьс€, тод≥ у х≥м≥чн≥й к≥нетиц≥ розгл€дають т≥льки д≥йсну швидк≥сть реакц≥њ υ, тобто швидк≥сть у даний момент часу, коли Δt → 0, а саме
 , де d Ц диференц≥ал.
, де d Ц диференц≥ал.
‘актори, що впливають на швидк≥сть реакц≥њ
Ўвидк≥сть х≥м≥чноњ реакц≥њ залежить в≥д природи реагуючих речовин, а також в≥д умов переб≥гу реакц≥њ: концентрац≥њ с, температури t, на€вност≥ катализатора, а також в≥д де€ких ≥нших фактор≥в (наприклад, в≥д тиску Ц дл€ газових реакц≥й, в≥д ступен€ подр≥бненн€ Ц дл€ твердих речовин, в≥драд≥оактивного випром≥нюванн€ тощо).
¬плив концентрац≥њ реагуючих речовин виражаЇтьс€ законом д≥ючих мас (√ульдберг, ¬ааге, 1864-1867 pp.): за сталоњ температури швидк≥сть x≥м≥чноњ реакц≥њ пр€мо пропорц≥йна добутку концентрац≥й реагуючих речовин.
ƒл€ реакц≥њ mј + n¬ → p— + gD закон д≥ючих мас виражаЇтьс€ р≥вн€нн€м:
ν = k ∙ 
де сјi с¬ Ц концентрац≥њ речовин, моль/л; k Ц коеф≥ц≥Їнт пропорц≥йност≥, що називаЇтьс€ константою швидкост≥ реакц≥њ.
÷е р≥вн€нн€ називаЇтьс€ к≥нетичним р≥вн€нн€м реакц≥њ. ≤з нього неважко встановити ф≥зичний зм≥ст константи швидкост≥. ¬она чисельно дор≥внюЇ швидкост≥ реакц≥њ, коли концентрац≥њ кожноњ з реагуючих речовин становл€ть 1 моль/л. онстанта швидкост≥ залежитъ в≥д природи реагуючих речовин, в≥д температури, тиску, але не залежитъ в≥д њx концен-трац≥њ.
«акон д≥ючих мас застосовуЇтьс€ лише до газопод≥бних i розчинених речовин, в≥н не розповсюджуЇтьс€ на реагуюч≥ речовини у твердому стан≥, оск≥льки њх концентрац≥њ Ї стаб≥льними i вони реагують лише на поверхн≥.
«алежн≥сть швидкост≥ реакц≥њ в≥д температури визначаЇтьс€ (наближено) правилом ¬ант-√оффа: з п≥двищенн€м температури на кожн≥ 10 градус≥в швидк≥сть б≥льшост≥ реакц≥й зростаЇ у 2-4 рази.
ћатематично ц€ залежн≥сть виражаЇтьс€ сп≥вв≥дношенн€м:
 ,
,
де 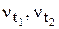 Ц швидкост≥ реакц≥њ за початковоњ Ц t1 ≥к≥нцевоњ t2 температурах;
Ц швидкост≥ реакц≥њ за початковоњ Ц t1 ≥к≥нцевоњ t2 температурах;
γ Ц температурний коеф≥ц≥Їнт швидкост≥ peaкц≥њ, €кий показуЇ, у ск≥льки раз≥в зб≥льшуЇтьс€ швидк≥сть реакц≥њ з п≥двищенн€м температури реагуючих речовин на 10 градусов (γ = 2 - 4).
“емпература впливаЇ на швидк≥сть х≥м≥чноњ реакц≥њ, зб≥льшуючи константу швидкост≥.
≈нерг≥€ активац≥њ
3 п≥двищенн€м температури число активних молекул значно зростаЇ, внасл≥док чого зб≥льшуЇтьс€ швидк≥сть реакц≥њ. ÷е по€снюЇтьс€ зб≥льшен-н€м к≥лькост≥ так званих Ђактивних молекулї, тобто молекул, що мають енерг≥ю, достатню дл€ зд≥йсненн€ даноњ реакц≥њ при њх з≥ткненн≥.
≈нерг≥€, €ку потр≥бно надати молекулам (частинкам) реагуючих речовин, щоб перетворити њх на активн≥, називаЇтьс€ енерг≥Їю активац≥њ.
ѓњ визначають експериментально i позначають л≥терою ≈аi виражають у кƒж/моль.≈нерг≥€ активац≥њ залежить в≥д природи реагуючих речовин i Ї характеристикою кожноњ реакц≥њ.
ƒл€ того, щоб реакц≥€ м≥ж молекулами була можливою, молекули повинн≥ мати надлишкову енерг≥ю, що б≥льша за середню на величину, р≥вну енерг≥њ активац≥њ.
ѕон€тт€ про катал≥з i катал≥затори
атал≥зом називають зм≥ну швидкост≥ х≥м≥чних реакц≥й в присут-нocтi речовин, €к≥ сам≥ п≥сл€ реакц≥њ залишаютьс€ х≥м≥чно незм≥неними. «азвичай катал≥заторами називаютье€ лише прискорювач≥ реац≥њ, а ≥нг≥б≥торами Ц упов≥льнювач≥.
якщокатал≥затор i peaгуюч≥ речовини перебувають у одн≥й фаз≥, тод≥ катал≥з називають гомогенним, €кщо у piзниx фазах Ц гетерогенним. ƒ≥€ катал≥затор≥в: 1) не зм≥нюЇ теплового ефекту реакц≥њ; 2) знижуЇ енерг≥ю активац≥њ €к пр€моњ, так i зворотноњ реакц≥њ на одну й ту саму вели≠чину Δ≈, тому не порушуЇ р≥вноваги; 3) зб≥льшуючи однаковою м≥рою швидк≥сть пр€моњ i зворотноњ реакц≥й, скорочуЇ час дос€гненн€ piвноваги; 4) Ї виб≥рковою, що визначаЇтьс€ природою катал≥затора i умовами його застосуванн€.
|
|
|
’≥м≥чн≥ реакц≥њ, що в≥дбуваютьс€ за участю катал≥затор≥в, називаютьс€ катал≥тичними. –озр≥зн€ють гомогенний (однор≥дний) ≥ гетерогенний (неоднор≥дний) катал≥з.
ƒл€ гомогенного катал≥зу встановлено, що швидк≥сть х≥м≥чноњ реакц≥њ пропорц≥йна концентрац≥њ катал≥затора.
ћехан≥зм гомогенного катал≥зу звичайно по€снюють за допомогою теор≥њ пром≥жних сполук. ” в≥дпов≥дност≥ з ц≥Їю теор≥Їю катал≥затор ( ) спочатку утворюЇ з одн≥Їю ≥з вих≥дних речовин пром≥жну сполуку (ј ). ÷€ сполука реагуЇ з ≥ншою вих≥дною речовиною з в≥дновленн€м катал≥затора. —хематично це можна зобразити таким чином:
ј + Ѕ Ѓ јЅ (реакц≥€ прот≥каЇ пов≥льно) (а)
атал≥затор розбиваЇ процес на дв≥ стад≥њ:
ј + Ѓ ј (реакц≥€ прот≥каЇ швидко) (б)
ј + Ѕ Ѓ јЅ + (реакц≥€ прот≥каЇ швидко). (в)
Ўвидкост≥ реакц≥й (б) ≥ (в) у багато раз≥в б≥льш≥ в≥д швидкостей процесу (а), оск≥льки стад≥њ (б) ≥ (в) характеризуютьс€ меншою енерг≥Їю активац≥њ. “аким чином, причина зб≥льшенн€ швидкост≥ реакц≥њ в присутност≥ катал≥затора пол€гаЇ у зменшенн≥ енерг≥њ активац≥њ ц≥Їњ реакц≥њ.
” в≥дпов≥дност≥ з ц≥Їю теор≥Їю процес окисненн€ SO2 до SO3 за участю катал≥затора Ц н≥троген (≤≤) оксиду можна схематично зобразити таким чином:
SO2 +  ќ2 Ѓ SO3;
ќ2 Ѓ SO3;
ј + Ѕ Ѓ јЅ.
–еакц≥€ прот≥каЇ пов≥льно. ѕри введенн≥ катал≥затора в≥дбуваЇтьс€ утворенн€ пром≥жноњ сполуки:
NO +  ќ2 Ѓ NO2; ќ2 Ѓ NO2;
| SO2 + NO2 Ѓ SO3 + NO; |
| + Ѕ Ѓ Ѕ; | ј + Ѕ Ѓ јЅ + . |
ѕ≥дчас гетерогенного катал≥зу peaгуюч≥ речовини i катал≥затор утворюють систему з р≥зних фаз. ћ≥жкатал≥затором i реагуючими речовинами ≥снуЇ поверхн€ под≥лу. «азвичай, катал≥затор Ц тверда речовина,а реагують м≥ж собою речовини Ц гази або р≥дини. ѕоверхн€ катал≥затopa Ї неоднор≥дною. Ќа н≥й Ї так зван≥ активн≥ центри, на €ких в основному i в≥дбуваютьс€ катал≥тичн≥ реакц≥њ.
Ќеоборотн≥ та оборотн≥ реакц≥њ
–еакц≥њ, €к≥ в≥дбуваютъс€ лише в одному напр€мку i завершуютьс€ повним перетворенн€м вих≥дних реагуючих речовин у к≥нцев≥ речовини, називаютьс€ необоротними.
Ѕ≥льш≥стъ реакц≥й Ї оборотними. ќборотними називаютьс€ так≥, реакц≥њ, €к≥ одночасно в≥дбуваютьс€ у двох взаЇмно протилежних напр€мках.
” р≥вн€нн€х оборотних реакц≥й м≥ж л≥вою та правою частинами ставл€ть дв≥ стр≥лки, спр€мован≥ у протилежн≥ боки, наприклад:






