ѕоклад≥ть в одну проб≥рку к≥лька гранул цинку, а в другу - к≥лька шматочк≥в зал≥за. ƒодайте в кожну проб≥рку по 1-2 см 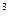 розведеноњ хлоридноњ кислоти ≥ спостер≥гайте переб≥г реакц≥й. ѕереконайтес€, що з проб≥рки вид≥л€Їтьс€ чистий водень (див. досл≥д 1). ѕророб≥ть той самий досл≥д з розведеною сульфатною кислотою зам≥сть хлоридноњ. Ќапиш≥ть р≥вн€нн€ реакц≥й.
розведеноњ хлоридноњ кислоти ≥ спостер≥гайте переб≥г реакц≥й. ѕереконайтес€, що з проб≥рки вид≥л€Їтьс€ чистий водень (див. досл≥д 1). ѕророб≥ть той самий досл≥д з розведеною сульфатною кислотою зам≥сть хлоридноњ. Ќапиш≥ть р≥вн€нн€ реакц≥й.
«авданн€ 3. ќдержанн€ водню з розчину лугу
ѕоклад≥ть у проб≥рку к≥лька кусочк≥в алюм≥н≥Ївих ошурок, додайте розчину NаќЌ, закр≥п≥ть проб≥рку в затискач≥ штатива, закрийте њњ корком з в≥дт€гнутою трубкою ≥ спостер≥гайте переб≥г реакц≥њ. —початку реакц≥€ в≥дбуваЇтьс€ пов≥льно, а пот≥м досить бурхливо. ƒовед≥ть, що в результат≥ реакц≥њ вид≥л€Їтьс€ водень. Ќапиш≥ть р≥вн€нн€ реакц≥њ.
«авданн€ 4. ¬≥дновн≥ властивост≥ водню в момент вид≥ленн€
Ќалийте в дв≥ проб≥рки по 1-2 см 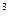 розведеноњ сульфатноњ кислоти ≥ долийте дек≥лька крапель розчину кал≥ю перманганату. ƒодайте в одну з проб≥рок кусочок цинку, а в другу - пропуст≥ть водень, зануривши к≥нець газов≥дв≥дноњ трубки в розчин. «верн≥ть увагу на те, що обезбарвленн€ розчин≥в в обох проб≥рках в≥дбуваЇтьс€ з р≥зною швидк≥стю. Ќапиш≥ть р≥вн€нн€ реакц≥њ, знаючи, що манган в≥дновлютьс€ до двовалентного.
розведеноњ сульфатноњ кислоти ≥ долийте дек≥лька крапель розчину кал≥ю перманганату. ƒодайте в одну з проб≥рок кусочок цинку, а в другу - пропуст≥ть водень, зануривши к≥нець газов≥дв≥дноњ трубки в розчин. «верн≥ть увагу на те, що обезбарвленн€ розчин≥в в обох проб≥рках в≥дбуваЇтьс€ з р≥зною швидк≥стю. Ќапиш≥ть р≥вн€нн€ реакц≥њ, знаючи, що манган в≥дновлютьс€ до двовалентного.
«авданн€ 5. ¬ивченн€ взаЇмод≥њ лужних та лужноземельних
метал≥в з водою
” три проб≥рки налийте 1-2 см 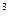 води ≥ пом≥ст≥ть кусочки очищених: а)метал≥чного натр≥ю; б)метал≥чного магн≥ю; в)метал≥чного кальц≥ю. —постер≥гайте вид≥ленн€ газу. “≥ проб≥рки, де реакц≥€ прот≥каЇ недостатньо ≥нтенсивно, п≥д≥гр≥йте. ѕ≥сл€ зак≥нченн€ реакц≥њ реакц≥йну сум≥ш охолод≥ть ≥ добавте дек≥лька крапель фенолфталењну. ўо ви спостер≥гаЇте? Ќапиш≥ть р≥вн€нн€ реакц≥њ. ¬изнач≥ть оксидник ≥ в≥дновник
води ≥ пом≥ст≥ть кусочки очищених: а)метал≥чного натр≥ю; б)метал≥чного магн≥ю; в)метал≥чного кальц≥ю. —постер≥гайте вид≥ленн€ газу. “≥ проб≥рки, де реакц≥€ прот≥каЇ недостатньо ≥нтенсивно, п≥д≥гр≥йте. ѕ≥сл€ зак≥нченн€ реакц≥њ реакц≥йну сум≥ш охолод≥ть ≥ добавте дек≥лька крапель фенолфталењну. ўо ви спостер≥гаЇте? Ќапиш≥ть р≥вн€нн€ реакц≥њ. ¬изнач≥ть оксидник ≥ в≥дновник
«авданн€ 6. «абарвленн€ полум'€ йонами лужних та
лужноземельних метал≥в
¬нес≥ть дротинку з нержав≥ючоњ стал≥ з петлею на к≥нц≥ в полум'€ пальника ≥ прожарте њњ до припиненн€ забарвленн€ полум'€. ќхолоджену дротинку змоч≥ть у розчин≥ в≥дпов≥дноњ сол≥ або занурте в кристали ц≥Їњ сол≥ ≥ внес≥ть у полум'€ пальника. ¬≥дм≥тьте кол≥р полум'€ ≥ занес≥ть його в таблицю. ƒротинку прожарюйте, доки забарвленн€ не зникне, п≥сл€ чого провед≥ть досл≥д з наступною с≥ллю.
“аблиц€
ол≥р полум'€, викликаний йонами лужних та лужноземельних метал≥в.
| …они лужних метал≥в | …они лужноземельних метал≥в | ||
| …он | ол≥р полумТ€ | …он | ол≥р полумТ€ |
| Li+ | 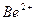
| ||
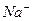
| 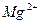
| ||
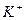
| 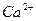
| ||
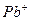
| 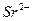
| ||
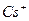
| 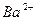
|
«роб≥ть в≥дпов≥дн≥ висновки.
«авданн€ 7. ”творенн€ та усуненн€ карбонатноњ твердост≥ води
” проб≥рку до половини њњ об'Їму налийте вапн€ноњ води ≥ опуст≥ть в нењ газов≥дв≥дну трубку в≥д апарата ≥ппа, зар€дженого мармуром ≥ хлоридною кислотою. ѕропускайте в розчин несильний струм≥нь газу ≥ сл≥дкуйте, щоб розчин не викидало цим струменем ≥з проб≥рки. ¬≥дм≥тьте по€ву осаду кальц≥ю карбонату. ѕродовжуйте пропускати —ќ2 до повного розчиненн€ осаду, €кий супроводжуЇтьс€ утворенн€м кальц≥ю г≥дрокарбонату —а(Ќ—ќ3)2. Ќапиш≥ть р≥вн€нн€ реакц≥њ. як називаЇтьс€ вода, що м≥стить кальц≥ю г≥дрокарбонат?
|
|
|
ќтриманий розчин розд≥л≥ть на дв≥ проб≥рки:
Ј ѕоловину отриманого розчину обережно нагр≥йте до кип≥нн€ ≥ утворенн€ осаду кальц≥ю карбонату. Ќапиш≥ть р≥вн€нн€ реакц≥њ розкладу —а(Ќ—ќ3)2 при кип'€т≥нн≥.
Ј ƒо другоњ половини розчину добавте дек≥лька крапель розчину NаќЌ до утворенн€ осаду —а—O3. Ќапиш≥ть р≥вн€нн€ реакц≥њ.
Ћ≤“≈–ј“”–ј
1.ƒержавна ‘армакопе€ ”крањни / ƒерж. п≥дприЇмство УЌауково-експертний фармакопейний центр.Ф Ц1-е вид. Ц’арк≥в: –≤–≈√, 2001. Ц556 с.
2. оровин Ќ.¬. ќбща€ хими€. Цћ.: ¬ысша€ школа, 1998. Ц559 с.
3.”гай я.ј. ќбща€ и неорганическа€ хими€. Цћ.: ¬ысша€ школа, 1997. Ц527 с.
4. онспект лекц≥й.
5.ѕрактикум з загальноњ та неорган≥чноњ х≥м≥њ: ѕос≥бник // ™.я.Ћев≥т≥н, –.√. люЇва, ј.ћ.Ѕризицька та ≥н. Ц’.: ќснова, 1998. Ц119 с.
6.Ќеорганическа€ хими€.: ”чебное пособие дл€ студ. фармац. спец. вузов (ѕрактикум) // ј. .—ухомлинов, Ќ.¬.Ѕоровска€, ѕ.я.ѕустовар и др. Ц иев: ¬ысша€ школа, 1983. Ц167 с.
7.√ригорТЇва ¬.¬., —ам≥йленко ¬.ћ., —ич ј.ћ. «агальна х≥м≥€. .: ¬ища школа, 1991. Ц430 с.
8.–оманова Ќ.¬. «агальна та неорган≥чна х≥м≥€. .: ¬ища школа, 1998. Ц480 с.
9.јхметов Ќ.—. ќбща€ и неорганическа€ хими€.: ”чебное пособие дл€ студ. хим.-техн.спец. вузов. Цћ.: ¬ысша€ школа, 1998. Ц743 с.
10. арапеть€нц ћ.’., ƒракин —.». ќбща€ и неорганическа€ хими€. Цћ.: ¬ысша€ школа, 1993. Ц592 с.
11.“елегус ¬.—., Ѕодак ќ.≤., «аречнюк ќ.—., ≥нжибало ¬.¬. ќснови загальноњ х≥м≥њ / «а ред. ¬.—.“елегуса: ѕ≥дручник. ЦЋьв≥в: —в≥т, 2000. Ц424 с.
12.—копенко ¬.¬., √ригорТЇва ¬.¬. Ќайважлив≥ш≥ класи неорган≥чних сполук. .: Ћиб≥дь, 1996. Ц151 с.
13.¬ступ до х≥м≥чноњ номенклатури / ќ.ј.√олуб, ћ.ё. орн≥лов, ¬.¬.—копенко та ≥н. .: Ўкол€р, 1997. Ц48 с.
14. орн≥лов ћ.ё., Ѕ≥лод≥д ќ.≤., √олуб ќ.ј. “ерм≥нолог≥чний пос≥бник з х≥м≥њ. Ц .: ≤«ћЌ, 1996. Ц256 с.
15.«айцев ќ.—. ќбща€ хими€. —осто€ние веществ и химические реакции. ћ.: ’ими€, 1990. Ц352 с.
«јЌя““я є40
“≈ћј: ѕ≥дсумковий контроль модул€ 2 ЂЌеорган≥чна х≥м≥€ї.
ј “”јЋ№Ќ≤—“№: дана робота необх≥дна студентам дл€ знанн€ властивостей елемент≥в головних та поб≥чних п≥дгруп пер≥одичноњ системи ƒ.≤.ћенделЇЇва, дл€ закр≥пленн€ ≥ засвоЇнн€ знань з пройдених тем.
Ќј¬„јЋ№Ќ≤ ÷≤Ћ≤: «Т€сувати значенн€ елемент≥в та сполук елемент≥в головних та поб≥чних п≥дгруп пер≥одичноњ системи ƒ.≤.ћенделЇЇва в медичн≥й та фармацевтичн≥й практиц≥. ѕерев≥рка засвоЇнн€ студентами знань ≥з ран≥ше вивчених тем.
«Ќј“»: -ф≥зичн≥ та х≥м≥чн≥ властивост≥ елемент≥в головних та поб≥чних
п≥дгруп пер≥одичноњ системи ƒ.≤.ћенделЇЇва;
-характерн≥ ступен≥ оксидац≥њ елемент≥в головних та поб≥чних п≥дгруп
пер≥одичноњ системи ƒ.≤.ћенделЇЇва;
-значенн€ сполук елемент≥в головних та поб≥чних п≥дгруп
пер≥одичноњ системи ƒ.≤.ћенделЇЇва дл€ медицини ≥ фармац≥њ.
¬ћ≤“»: -записати характерн≥ х≥м≥чн≥ реакц≥њ елемент≥в та сполук елемент≥в
головних та поб≥чних п≥дгруп пер≥одичноњ системи ƒ.≤.ћенделЇЇва;
-розв'€зувати типов≥ розрахунков≥ задач≥;
-застосовувати знанн€ з пройдених тем на практиц≥.
—јћќ—“≤…Ќј ѕќ«јј”ƒ»“ќ–Ќј –ќЅќ“ј
1.«агальн≥ законом≥рност≥ зм≥ни кислотно-основних та оксидац≥йно-в≥дновних властивостей d-елемент≥в при переход≥ в≥д нижчих до вищих ступен≥в оксидац≥њ.
2.«алежн≥сть оксидац≥йно-в≥дновних властивостей сполук d-елемент≥в в≥д рЌ середовища (на приклад≥ ’рому та ћангану).
|
|
|
3.«агальна характеристика ћол≥бдену ≥ ¬ольфраму, здатн≥сть до утворенн€ ≥зопол≥- та гетеропол≥кислот.
4.«агальна характеристика елемент≥в п≥дгрупи јрсену. Ѕ≥нарн≥ сполуки з воднем, киснем, с≥ркою та ≥ншими неметалами, њх одержанн€ та кислотно-основн≥ властивост≥.
5.ћанган, положенн€ в пер≥одичн≥й систем≥ ƒ.≤.ћенделЇЇва. ’арактерн≥ ступен≥ оксидац≥њ. ѕриродн≥ сполуки.
6.«датн≥сть d-елемент≥в до комплексоутворенн€. ат≥онн≥, ан≥онн≥ та нейтральн≥ комплекси. ’≥м≥чний звТ€зок в комплексних сполуках.
7.√алоген≥ди метал≥в. ѓх застосуванн€ в фармац≥њ.
8.–оль метал≥в в ф≥з≥олог≥чних процесах, що в≥дбуваютьс€ в живих орган≥змах.
9.” €к≥й мас≥ води треба розчинити 5 г м≥дного купоросу CuSO4Х5H2O, щоб 1 г приготовленого розчину м≥стив 0,04 г безводноњ сол≥?
10.¬изначте мол€рну масу екв≥валента мангану в реакц≥њ з киснем, €кщо утворюЇтьс€: а) MnO2; б) Mn3O4.
11.ѕ≥д час прожарюванн€ 1 г оксиду метал≥чного елемента в струмен≥ водню вид≥лилос€ 0,284 г води. ¬изначте мол€рн≥ маси екв≥валент≥в елемента та його оксиду.
12.як≥ координац≥йн≥ числа характерн≥ дл€ ћангану, “ехнец≥ю та –ен≥ю в њхн≥х сполуках?
13.Ќапиш≥ть р≥вн€нн€ реакц≥й, що можуть в≥дбуватис€ м≥ж кал≥ю хроматом та: а) хлоридною кислотою; б) сульфатною кислотою. ¬каж≥ть умови, за €ких дан≥ реакц≥њ Ї можливими.
14. ислотно-основн≥ властивост≥ сполук ÷инку.
15.—ульф≥ди арсену, њх характер, розчиненн€ в лугах та сульф≥д≥ амон≥ю.
16.‘≥зико-х≥м≥чн≥ основи застосуванн€ сполук елемент≥в поб≥чних п≥дгруп та п≥дгрупи јрсену в фармац≥њ.
17.’≥м≥чн≥ властивост≥ јрсену. ¬заЇмод≥€ з н≥тратною кислотою.
18.Ф÷арська водаФ, взаЇмод≥€ з золотом ≥ платиною.
19.’рому г≥дроксид та надхромов≥ кислоти.
20.—ол≥ ‘еруму. ‘ерити ≥ ферати, њх добуванн€ ≥ застосуванн€.
21.ќксигеновм≥сн≥ сполуки ’рому, добуванн€ ≥ характер оксид≥в та г≥дратних форм.
22.’≥м≥чн≥ властивост≥ обальту та Ќ≥колу.
23.“≥осол≥ јрсену та —тиб≥ю, њх одержанн€ ≥ властивост≥.
24.¬алентн≥ особливост≥ d-елемент≥в. ѕотенц≥али йон≥зац≥њ, спор≥дненн≥сть до електрону, в≥дносна електронегативн≥сть, електродн≥ потенц≥али, р€д напруг.
ќЌ“–ќЋ№Ќ≤ ѕ»“јЌЌя
1.≈лектронна структура атом≥в елемент≥в поб≥чних п≥дгруп та п≥дгрупи јрсену в нормальному та збудженому стан≥.
2.’≥м≥чн≥ властивост≥ ћангану.
3.ќксигеновм≥сн≥ сполуки ћангану. ’арактер оксид≥в та њх г≥дратних форм. ќксидац≥йно-в≥дновн≥ властивост≥.
4.«агальна характеристика d-елемент≥в VI групи. ѕриродн≥ сполуки та методи добуванн€.
5.’≥м≥чн≥ властивост≥ ’рому та його сполук.
6. ислотно-основна та оксидац≥йно-в≥дновна характеристика сполук ‘еруму (II) та ‘еруму (III).
7. омплексн≥ сполуки ‘еруму з ц≥ан≥д-, родан≥д-йонами, диметилгл≥оксимом, оксидом карбону (II), гемоглоб≥ном.
8.Ќайважлив≥ш≥ сполуки обальту та Ќ≥колу, здатн≥сть до комплексоутворенн€. –еакц≥€ „угайова.
9.Ќайважлив≥ш≥ сполуки м≥д≥, ср≥бла та золота, њх кислотно-основна та оксидац≥йно-в≥дновна характеристика, здатн≥сть до комплексоутворенн€.
10.ќсобливост≥ ф≥зичних ≥ х≥м≥чних властивостей ртут≥ та њњ сполук.
11.’≥м≥зм токсичноњ д≥њ сполук кадм≥ю та меркур≥ю.
12. омплексна природа цинквм≥сних фермент≥в та х≥м≥зм њх д≥њ.
13. омплексн≥ сполуки ÷инку, њх застосуванн€.
14.’ромати та дихромати. ѓх оксидац≥йн≥ властивост≥. –≥вновага в розчин≥ хромат- ≥ дихромат-йон≥в.
15.як≥сн≥ реакц≥њ на кат≥они Fe2+ ≥ Fe3+.
16.јрсен≥тна, арсенатна кислота ≥ њх сол≥. ислотн≥ та оксидац≥йно-в≥дновн≥ властивост≥.
17.—ол≥ —тиб≥ю та Ѕ≥смуту, њх г≥дрол≥з.
18.јрсин, його одержанн€ ≥ властивост≥. «астосуванн€ в х≥м≥ко-токсиколог≥чних досл≥дженн€х.
19.’≥м≥чн≥ властивост≥ стиб≥ю та б≥смуту. ќксиди —тиб≥ю, њх характер ≥ в≥дпов≥дн≥ кислоти. —полуки —тиб≥ю з галогенами та с≥ркою. ’арактерн≥ сполуки Ѕ≥смуту, њх властивост≥.
20.Ќайважлив≥ш≥ неорган≥чн≥ препарати елемент≥в поб≥чних п≥дгруп та п≥дгрупи јрсену, €к≥ використовуютьс€ в медицин≥ ≥ фармац≥њ.
21.„ому в≥д ‘еруму до Ќ≥келю ст≥йк≥сть сполук ≥з ступенем оксидац≥њ +3 зменшуЇтьс€, а њз ступенем оксидац≥њ +2 Ц зб≥льшуЇтьс€?
|
|
|
22.Ќа г≥дроксиди цинку та кадм≥ю под≥€ли надлишком розчину сульфатноњ кислоти, лугу, ам≥аку. як≥ сполуки при цьому утворилис€? Ќапиш≥ть р≥вн€нн€ в≥дпов≥дних реакц≥й.
23.як≥ х≥м≥чн≥ реакц≥њ використовують дл€ видаленн€ залишк≥в метал≥чноњ ртут≥, що вилилас€ внасл≥док необережного поводженн€ з нею?
24.ќхарактеризуйте розчинн≥сть сульф≥д≥в ÷инку, адм≥ю та √≥драрг≥уму в кислотах. „и можна використати р≥зне в≥дношенн€ сполук до кислот дл€ розд≥ленн€ сум≥ш≥ порошк≥в ZnS, CdS та HgS? якщо так, то €ким чином зд≥йснити таке розд≥ленн€?
—јћќ—“≤…Ќј –ќЅќ“ј Ќј «јЌя““≤
¬≥дпов≥дати на питанн€ викладача, €к≥ будуть задаватис€ студентам з теми "ѕ≥дсумковий контроль модул€ 2 ЂЌеорган≥чна х≥м≥€ї. –озв'€зуванн€ типових задач. ѕисьмова робота.
Ћ≤“≈–ј“”–ј
1.ƒержавна ‘армакопе€ ”крањни / ƒерж. п≥дприЇмство УЌауково-експертний фармакопейний центр.Ф Ц1-е вид. Ц’арк≥в: –≤–≈√, 2001. Ц556 с.
2. оровин Ќ.¬. ќбща€ хими€. Цћ.: ¬ысша€ школа, 1998. Ц559 с.
3.”гай я.ј. ќбща€ и неорганическа€ хими€. Цћ.: ¬ысша€ школа, 1997. Ц527 с.
4. онспект лекц≥й.
5.ѕрактикум з загальноњ та неорган≥чноњ х≥м≥њ: ѕос≥бник // ™.я.Ћев≥т≥н, –.√. люЇва, ј.ћ.Ѕризицька та ≥н. Ц’.: ќснова, 1998. Ц119 с.
6.Ќеорганическа€ хими€.: ”чебное пособие дл€ студ. фармац. спец. вузов (ѕрактикум) // ј. .—ухомлинов, Ќ.¬.Ѕоровска€, ѕ.я.ѕустовар и др. Ц иев: ¬ысша€ школа, 1983. Ц167 с.
7.√ригорТЇва ¬.¬., —ам≥йленко ¬.ћ., —ич ј.ћ. «агальна х≥м≥€. .: ¬ища школа, 1991. Ц430 с.
8.–оманова Ќ.¬. «агальна та неорган≥чна х≥м≥€. .: ¬ища школа, 1998. Ц480 с.
9.јхметов Ќ.—. ќбща€ и неорганическа€ хими€.: ”чебное пособие дл€ студ. хим.-техн.спец. вузов. Цћ.: ¬ысша€ школа, 1998. Ц743 с.
10. арапеть€нц ћ.’., ƒракин —.». ќбща€ и неорганическа€ хими€. Цћ.: ¬ысша€ школа, 1993. Ц592 с.
11.“елегус ¬.—., Ѕодак ќ.≤., «аречнюк ќ.—., ≥нжибало ¬.¬. ќснови загальноњ х≥м≥њ / «а ред. ¬.—.“елегуса: ѕ≥дручник. ЦЋьв≥в: —в≥т, 2000. Ц424 с.
12.—копенко ¬.¬., √ригорТЇва ¬.¬. Ќайважлив≥ш≥ класи неорган≥чних сполук. .: Ћиб≥дь, 1996. Ц151 с.
13.¬ступ до х≥м≥чноњ номенклатури / ќ.ј.√олуб, ћ.ё. орн≥лов, ¬.¬.—копенко та ≥н. .: Ўкол€р, 1997. Ц48 с.
14. орн≥лов ћ.ё., Ѕ≥лод≥д ќ.≤., √олуб ќ.ј. “ерм≥нолог≥чний пос≥бник з х≥м≥њ. Ц .: ≤«ћЌ, 1996. Ц256 с.
15.«айцев ќ.—. ќбща€ хими€. —осто€ние веществ и химические реакции. ћ.: ’ими€, 1990. Ц352 с.
16.яцимирський .Ѕ., яцимирський ¬. . ’≥м≥чний звТ€зок. .: ¬ища школа, 1993. Ц309 с.
17.‘римантл ћ. ’ими€ в действии: ¬ 2-х ч. / ѕер. с англ. Цћ.: ћир, 1991. Ц„.1.-528 с.; „.2. Ц622 с.
18.«агальна та неорган≥чна х≥м≥€: ѕ≥друч. дл€ студ. вищ. навч. закл. („.2) // ќ.ћ.—тепаненко, Ћ.√.–ейтер, ¬.ћ.Ћедовських, —.¬.≤ванов. Ц .: ѕед. ѕреса, 2000. -784 с.
19.ќганес€н Ё.“. Ќеорганическа€ хими€ дл€ фармацевтических вузов. Цћ.: ¬ысша€ школа, 1983. Ц523 с.
20.ѕерепелиц€ ќ.ѕ. ¬ластивост≥ та еколог≥чний вплив х≥м≥чних елемент≥в: ƒов≥дник. Ц .: ¬ентур≥, 1997. Ц192 с.
«јЌя““я є42
“≈ћј: ’≥м≥€ елемент≥в ≤≤Ѕ п≥дгрупи (÷инк, адм≥й, ћеркур≥й).
Ћабораторна робота є17.
ј “”јЋ№Ќ≤—“№: майбутн≥ пров≥зори повинн≥ знати властивост≥ елемент≥в ≤≤Ѕ п≥дгрупи та њх б≥олог≥чну роль дл€ застосуванн€ в фармацевтичн≥й практиц≥ та в народному господарств≥.
Ќј¬„јЋ№Ќ≤ ÷≤Ћ≤: ¬ивченн€ х≥м≥чних властивостей елемент≥в ≤≤Ѕ п≥дгрупи. ќзнайомленн€ з застосуванн€м сполук елемент≥в ≤≤Ѕ п≥дгрупи у народному господарств≥ та медицин≥.
«Ќј“»: -ф≥зичн≥ та х≥м≥чн≥ властивост≥ елемент≥в I≤Ѕ п≥дгрупи;
-характерн≥ ступен≥ оксидац≥њ елемент≥в I≤Ѕ п≥дгрупи в
нормальному та збудженому стан≥;
-особливост≥ х≥м≥чних властивостей сполук елемент≥в I≤Ѕ п≥дгрупи.
|
|
|
¬ћ≤“»: -записати характерн≥ х≥м≥чн≥ реакц≥њ елемент≥в I≤Ѕ п≥дгрупи;
-розраховувати значенн€ потенц≥алу йон≥зац≥њ;
-показати здатн≥сть до комплексоутворенн€ d-елемент≥в I≤-њ п≥дгрупи;
-розв'€зувати типов≥ розрахунков≥ задач≥;
-за допомогою х≥м≥чних реакц≥й характеризувати властивост≥ d-
елемент≥в I≤-њ групи.
—јћќ—“≤…Ќј ѕќ«јј”ƒ»“ќ–Ќј –ќЅќ“ј
1. «агальна характеристика елемент≥в I≤Ѕ п≥дгрупи. Ќайважлив≥ш≥ природн≥ сполуки.
2. ћетоди одержанн€ елемент≥в I≤Ѕ п≥дгрупи. ƒобуванн€ цинку. ќхарактеризувати процеси за допомогою р≥вн€нь реакц≥й.
3. ’≥м≥чн≥ властивост≥ простих речовин.
4. ќксигеновм≥сн≥ сполуки елемент≥в I≤Ѕ п≥дгрупи, њх отриманн€ непр€мим шл€хом.
5. ’≥м≥чн≥ властивост≥ оксид≥в елемент≥в I≤Ѕ п≥дгрупи, њх оксидац≥йно-в≥дновн≥ властивост≥.
6. «ак≥нчити р≥вн€нн€ реакц≥й:
а) Zn + HNO3 (дуже розб.) →
б) HgCl2 + SnCl2 →
в) Zn + NaOH + H2O →
г) Hg + HNO3 (к.) →
д) Hg + HNO3 (р.) →
7. ¬казати валентн≥ можливост≥ атом≥в елемент≥в Zn, Cd, Hg, обгрунтувати можлив≥сть йон≥в про€вл€ти координац≥йне число 4 при утворенн≥ комплексних сполук.
8. Ќаписати р≥вн€нн€ реакц≥й терм≥чного розкладу н≥трат≥в цинку, кадм≥ю ≥ меркур≥ю (II).
9. як взаЇмод≥Ї цинк з розчинами луг≥в, ам≥аку, хлориду амон≥ю? Ќаписати р≥вн€нн€ реакц≥й.
10. –озчин сулеми, €кий використовують в медицин≥, готують розчиненн€м 1 г сол≥ в 2 кг води. яка мол€рна концентрац≥€ та масова частка одержаного розчину, €кщо густина дор≥внюЇ 1,01 г/см3.
11. яка маса ферум (II) сульфату була в розчин≥, €кщо при взаЇмод≥њ цинку з розчином ц≥Їњ сол≥ маса металу зменшилас€ на 0,04 г?
12. яку масу концентрованоњ сульфатноњ кислоти необх≥дно витратити дл€ розчиненн€ 50 г меркур≥ю?
ќЌ“–ќЋ№Ќ≤ ѕ»“јЌЌя
1. ≈лектронна структура атом≥в елемент≥в IIЅ п≥дгрупи.
2. ’≥м≥чн≥ властивост≥ г≥дроксид≥в цинку, кадм≥ю. „ому HgOH, Hg(OH)2 не ≥снують у в≥льному стан≥?
3. —полуки ÷инку та њх здатн≥сть до комплексоутворенн€.
4. ¬заЇмод≥€ елемент≥в IIЅ п≥дгрупи з водою, лугами та кислотами. Ќавести р≥вн€нн€ реакц≥й з сульфатною та н≥тратною кислотами р≥зних концентрац≥й.
5. ислотно-основна ≥ оксидац≥йно-в≥дновна характеристика сполук ÷инку.
6. омплексн≥ сполуки ÷инку. омплексна природа цинквм≥сних фермент≥в та х≥м≥зм њх д≥њ.
7. Ѕ≥олог≥чна та ф≥з≥олог≥чна роль ÷инку ћеркур≥ю.
8. яку масу аргентуму н≥трату треба вз€ти, щоб приготувати 10 г 2%-го розчину очних крапель? „и буде цей розчин ≥зотон≥чним?
9. яка ≥з солей (AgCl чи AgBr) б≥льш розчинна у вод≥? AgCl чи Ag2CrO4? ” ск≥льки раз≥в?
—јћќ—“≤…Ќј ј”ƒ»“ќ–Ќј –ќЅќ“ј
1. ¬иконанн€ досл≥д≥в, описаних в даних методичних вказ≥вках.
2. ќбговоренн€ результат≥в та оформленн€ висновк≥в.
3. ќформленн€ та захист протоколу.
4. ¬≥дпов≥д≥ на запитанн€, запропонован≥ викладачем, з використанн€м запис≥в на дошц≥.
5.–озв'€зуванн€ розрахункових задач, запропонованих викладачем.
≈кспериментальна частина
«авданн€ 1. —полуки ÷инку ≥ адм≥ю
1.1.–озчиненн€ цинку ≥ кадм≥ю в кислотах ≥ лугах
а) ¬ чотири проб≥рки пом≥ст≥ть по 1 м≥крошпателю цинкового пилу ≥ додайте по 0,5 см3 розбавленого розчину: в першу Ц хлоридноњ, в другу Ц сульфатноњ, в третю Ц н≥тратноњ кислоти, в четверту Ц розчину лугу. ўо спостер≥гаЇтьс€? Ќапиш≥ть р≥вн€нн€ реакц≥њ. ѕовтор≥ть досл≥д з концентрованими розчинами кислот ≥ лугу. Ќапиш≥ть р≥вн€нн€ реакц≥й.
б) ѕовтор≥ть вказан≥ досл≥ди з метал≥чним кадм≥Їм. Ќапиш≥ть р≥вн€нн€ реакц≥й.
1.2.ќдержанн€ г≥дроксид≥в цинку ≥ кадм≥ю та досл≥дженн€ њх властивостей
” дв≥ проб≥рки налийте по 3-4 крапл≥ розчину сол≥ ÷инку, у дв≥ ≥нш≥ Ц розчину сол≥ адм≥ю. ƒо кожноњ проб≥рки додайте 1 краплю натр≥ю г≥дроксиду ≥ спостер≥гайте утворенн€ б≥лих драглистих осад≥в г≥дроксид≥в. ѕерев≥рте њх розчинн≥сть в розбавлен≥й хлоридн≥й кислот≥ ≥ надлишку лугу. як≥ властивост≥ про€вл€ють г≥дроксиди обох метал≥в? Ќапиш≥ть р≥вн€нн€ реакц≥й.
1.3.ќдержанн€ комплексних сполук ÷инку ≥ адм≥ю
ѕом≥ст≥ть в одну проб≥рку 0,5 см3 розчину сол≥ ÷инку, в другу Ц сол≥ адм≥ю ≥ додайте крапл€ми розбавлений розчин ам≥аку до розчиненн€ осад≥в.
¬раховуючи, що характерним координац≥йним числом дл€ обидвох йон≥в-комплексоутворювач≥в Ї 4, напиш≥ть р≥вн€нн€ реакц≥й, р≥вн€нн€ дисоц≥ац≥њ комплекс≥в та вирази дл€ констант нест≥йкост≥. Ќазв≥ть вказан≥ комплексн≥ сполуки. «найд≥ть у дов≥днику значенн€ констант нест≥йкост≥. який комплексний йон б≥льш ст≥йкий ≥ чому?
1.4.¬≥дновлювальн≥ властивост≥ цинку
ѕом≥ст≥ть у фарфоровий тигель два м≥крошпател≥ цинкового пилу, 0,5 см3 розчину кал≥ю н≥трату ≥ 2-3 крапл≥ концентрованого розчину натр≥ю г≥дроксиду. ѕов≥льно нагр≥вайте на полумТњ пальника. ѕ≥днес≥ть пап≥рець ун≥версального ≥ндикатора ≥ визнач≥ть за запахом, €кий газ вид≥л€Їтьс€. яка с≥ль ÷инку утворюЇтьс€? Ќапиш≥ть р≥вн€нн€ реакц≥њ ≥ визнач≥ть коеф≥ц≥Їнти р≥вн€нн€ методом електронного балансу.
|
|
|
ќдержанн€ цинку оксиду
ѕоклад≥ть у фарфоровий тигель дек≥лька м≥крошпател≥в цинкового пилу ≥ нагр≥вайте на полумТњ до утворенн€ б≥лого порошку цинку оксиду. ќдержаний порошок розд≥л≥ть на дв≥ проб≥рки ≥ до одноњ додайте розбавлений розчин хлоридноњ кислоти, до другоњ Ц розчин лугу. ўо спостер≥гаЇтьс€? Ќапиш≥ть р≥вн€нн€ реакц≥њ.
1.6. ¬ит≥сненн€ кадм≥ю з його солей цинком
«анурте в стаканчик з розчином кадм≥ю сульфату цинкову пластинку ≥ спостер≥гайте вид≥ленн€ метал≥чного кадм≥ю у вигл€д≥ губчастоњ маси. Ќапиш≥ть р≥вн€нн€ реакц≥њ.
1.7.ќдержанн€ ≥ властивост≥ кадм≥ю карбонату
«м≥шайте у фарфоров≥й чашц≥ по 25 см3 2н розчин≥в кадм≥ю хлориду ≥ амон≥ю карбонату, а пот≥м додайте такий самий обТЇм розбавленого розчину ам≥аку, щоб осад кадм≥ю карбонату повн≥стю розчинивс€. Ќагр≥йте одержаний розчин комплексноњ сол≥ [Cd(NH3)4]CO3 на вод€н≥й ванн≥. —постер≥гайте утворенн€ б≥лих блискучих кристал≥в кадм≥ю карбонату. «лийте р≥дину з осаду, промийте методом декантац≥њ осад. ѕерев≥рте розчинн≥сть одержаного розчину у вод≥, кислотах ≥ лугах.
ѕоклад≥ть один м≥крошпатель одержаного кадм≥ю карбонату в фарфоровий тигель ≥ прожарте. ўо при цьому спостер≥гаЇтьс€? адм≥ю карбонат розкладаЇтьс€ при температур≥ близько 3500—. Ќапиш≥ть р≥вн€нн€ реакц≥й.
1.8.ќдержанн€ ≥ властивост≥ сульф≥д≥в цинку ≥ кадм≥ю
¬ одну проб≥рку налийте 1-2 см3 розчину кадм≥ю сульфату, а в другу Ц цинку хлориду. ƒодайте до обох проб≥рок надлишок розчину натр≥ю сульф≥ду. —постер≥гайте утворенн€ осад≥в. яке забарвленн€ мають осади в обох проб≥рках? «лийте р≥дину з осад≥в ≥ досл≥д≥ть розчинн≥сть сульф≥д≥в у розбавлених та концентрованих хлоридн≥й ≥ сульфатн≥й кислотах на холод≥ ≥ при нагр≥ванн≥. ўо при цьому спостер≥гаЇтьс€? Ќапиш≥ть р≥вн€нн€ реакц≥й.
«авданн€ 2. ћеркур≥й. –туть
2.1.√≥дрол≥з сполук меркур≥ю (≤)
–озчин≥ть к≥лька кристалик≥в н≥трату меркур≥ю (≤) в 1-2 см3 дистильованоњ води. —постер≥гайте утворенн€ осаду основноњ сол≥ (або помутн≥нн€ розчину). ƒосл≥д≥ть розчин ун≥версальним ≥ндикатором. ƒодайте к≥лька крапель розбавленоњ н≥тратноњ кислоти ≥ спостер≥гайте розчиненн€ осаду. Ќапиш≥ть р≥вн€нн€ реакц≥й.
2.2.¬заЇмод≥€ кал≥ю йодиду з сол€ми меркур≥ю (≤)
ƒо 1-2 см3розчину меркур≥ю (≤) н≥трату додайте крапл€ми розчину кал≥ю йодиду ≥ спостер≥гайте утворенн€ жовто-зеленого осаду меркур≥ю (≤) йодиду. ÷€ сполука нест≥йка ≥ поступово розкладаЇтьс€ на ртуть ≥ меркур≥ю (≤≤) йодид, €ка в надлишку кал≥ю йодиду розчин€Їтьс€ внасл≥док утворенн€ комплексноњ сполуки. Ќапиш≥ть р≥вн€нн€ реакц≥й.
2.3.ќдержанн€ меркур≥ю (≤) хлориду (каломел≥)
ƒо 1-2 см3 розчину натр≥ю хлориду або хлоридноњ кислоти додайте крапл€ми розчину меркур≥ю (≤) н≥трату ≥ спостер≥гайте утворенн€ б≥лого осаду каломел≥. Ќапиш≥ть р≥вн€нн€ реакц≥њ.
2.4.ќдержанн€ ≥ властивост≥ меркур≥ю (≤≤) оксиду
ƒо 1-2 см3 меркур≥ю (≤≤) н≥трату додайте 2-3 см3 розбавленого розчину лугу ≥ спостер≥гайте утворенн€ жовтого осаду меркур≥ю (≤≤) оксиду. –озд≥л≥ть одержаний осад з розчином у дв≥ проб≥рки, додайте до одноњ розбавленоњ кислоти, до другоњ Ц надлишок розчину лугу. ўо при цьому спостер≥гаЇтьс€? Ќапиш≥ть р≥вн€нн€ реакц≥й.
2.5.ќдержанн€ ≥ властивост≥ аргентуму тетрайодомеркурату
ƒо 1-2 см3 розчину меркур≥ю (≤≤) н≥трату додайте крапл€ми розчину кал≥ю йодиду до розчиненн€ осаду, що утворюЇтьс€, а пот≥м розчину аргентуму н≥трату ≥ спостер≥гайте утворенн€ €сно-жовтого осаду комплексноњ сол≥ (Ag2[HgI4]). ¬≥дф≥льтруйте осад, промийте його на ф≥льтр≥ водою ≥ висуш≥ть м≥ж аркушами ф≥льтрувального паперу. ѕоклад≥ть невелику к≥льк≥сть одержаноњ комплексноњ сполуки в суху проб≥рку ≥ п≥д≥гр≥йте. —постер≥гайте зм≥ну €скраво-жовтого забарвленн€ сол≥ на оранжево-червоне. ѕри охолодженн≥ сполуки забарвленн€ знову стаЇ €скраво-жовтим. омплексна сполука застосовуЇтьс€ €к теплочутлива фарба (термо≥ндикатор). Ќапиш≥ть р≥вн€нн€ реакц≥й.
ќформити ≥ зажистити протокол.
Ћ≤“≈–ј“”–ј
1. ƒержавна ‘армакопе€ ”крањни / ƒерж. п≥дприЇмство УЌауково-експертний фармакопейний центр.Ф Ц1-е вид. Ц’арк≥в: –≤–≈√, 2001. Ц556 с.
2. оровин Ќ.¬. ќбща€ хими€. Цћ.: ¬ысша€ школа, 1998. Ц559 с.
3. ”гай я.ј. ќбща€ и неорганическа€ хими€. Цћ.: ¬ысша€ школа, 1997. Ц527 с.
4. онспект лекц≥й.
5. ѕрактикум з загальноњ та неорган≥чноњ х≥м≥њ: ѕос≥бник // ™.я.Ћев≥т≥н, –.√. люЇва, ј.ћ.Ѕризицька та ≥н. Ц’.: ќснова, 1998. Ц119 с.
6. Ќеорганическа€ хими€.: ”чебное пособие дл€ студ. фармац. спец. вузов (ѕрактикум) // ј. .—ухомлинов, Ќ.¬.Ѕоровска€, ѕ.я.ѕустовар и др. Ц иев: ¬ысша€ школа, 1983. Ц167 с.
7. √ригорТЇва ¬.¬., —ам≥йленко ¬.ћ., —ич ј.ћ. «агальна х≥м≥€. .: ¬ища школа, 1991. Ц430 с.
8. –оманова Ќ.¬. «агальна та неорган≥чна х≥м≥€. .: ¬ища школа, 1998. Ц480 с.
9. јхметов Ќ.—. ќбща€ и неорганическа€ хими€.: ”чебное пособие дл€ студ. хим.-техн.спец. вузов. Цћ.: ¬ысша€ школа, 1998. Ц743 с.
10. арапеть€нц ћ.’., ƒракин —.». ќбща€ и неорганическа€ хими€. Цћ.: ¬ысша€ школа, 1993. Ц592 с.
11. “елегус ¬.—., Ѕодак ќ.≤., «аречнюк ќ.—., ≥нжибало ¬.¬. ќснови загальноњ х≥м≥њ / «а ред. ¬.—.“елегуса: ѕ≥дручник. ЦЋьв≥в: —в≥т, 2000. Ц424 с.
12. —копенко ¬.¬., √ригорТЇва ¬.¬. Ќайважлив≥ш≥ класи неорган≥чних сполук. .: Ћиб≥дь, 1996. Ц151 с.
13. ¬ступ до х≥м≥чноњ номенклатури / ќ.ј.√олуб, ћ.ё. орн≥лов, ¬.¬.—копенко та ≥н. .: Ўкол€р, 1997. Ц48 с.
14. орн≥лов ћ.ё., Ѕ≥лод≥д ќ.≤., √олуб ќ.ј. “ерм≥нолог≥чний пос≥бник з х≥м≥њ. Ц .: ≤«ћЌ, 1996. Ц256 с.
15. «айцев ќ.—. ќбща€ хими€. —осто€ние веществ и химические реакции. ћ.: ’ими€, 1990. Ц352 с.
16. яцимирський .Ѕ., яцимирський ¬. . ’≥м≥чний звТ€зок. .: ¬ища школа, 1993. Ц309 с.
17. ‘римантл ћ. ’ими€ в действии: ¬ 2-х ч. / ѕер. с англ. Цћ.: ћир, 1991. Ц„.1.-528 с.; „.2. Ц622 с.
18. «агальна та неорган≥чна х≥м≥€: ѕ≥друч. дл€ студ. вищ. навч. закл. („.2) // ќ.ћ.—тепаненко, Ћ.√.–ейтер, ¬.ћ.Ћедовських, —.¬.≤ванов. Ц .: ѕед. ѕреса, 2000. -784 с.
19. ќганес€н Ё.“. Ќеорганическа€ хими€ дл€ фармацевтических вузов. Цћ.: ¬ысша€ школа, 1983. Ц523 с.
20. ѕерепелиц€ ќ.ѕ. ¬ластивост≥ та еколог≥чний вплив х≥м≥чних елемент≥в: ƒов≥дник. Ц .: ¬ентур≥, 1997. Ц192 с.
«јЌя““я є44
“≈ћј: ’≥м≥€ елемент≥в п≥дгрупи јрсену.
Ћабораторна робота є18.
ј “”јЋ№Ќ≤—“№: майбутн≥ пров≥зори повинн≥ знати властивост≥ елемент≥в п≥дгрупи јрсену та њх б≥олог≥чну роль дл€ застосуванн€ в наступн≥й фармацевтичн≥й практиц≥.
.
Ќј¬„јЋ№Ќ≤ ÷≤Ћ≤: ¬ивчити х≥м≥чн≥ властивост≥ елемент≥в п≥дгрупи јрсену. Ќавчитис€ проводити х≥м≥чн≥ досл≥ди та складати р≥вн€нн€ х≥м≥чних реакц≥й, €к≥ характеризують властивост≥ елемент≥в п≥дгрупи јрсену та њх сполук. ќзнайомити студент≥в з б≥олог≥чною роллю даних елемент≥в та њх застосуванн€м в медичн≥й практиц≥.
«Ќј“»: -ф≥зичн≥ та х≥м≥чн≥ властивост≥ елемент≥в п≥дгрупи јрсену;
-характерн≥ ступен≥ оксидац≥њ елемент≥в п≥дгрупи јрсену в
нормальному та збудженому стан≥;
-особливост≥ х≥м≥чних властивостей сполук елемент≥в п≥дгрупи
јрсену.
¬ћ≤“»: -записати характерн≥ х≥м≥чн≥ реакц≥њ елемент≥в п≥дгрупи јрсену;
-визначати јрсен за методом ћарша;
-писати реакц≥њ посл≥довних перетворень молекул та йон≥в елемент≥в
п≥дгрупи јрсену;
-розв'€зувати типов≥ розрахунков≥ задач≥;
-за допомогою х≥м≥чних реакц≥й характеризувати властивост≥
елемент≥в п≥дгрупи јрсену.
—јћќ—“≤…Ќј ѕќ«јј”ƒ»“ќ–Ќј –ќЅќ“ј
1. «агальна характеристика елемент≥в п≥дгрупи јрсену. Ќайважлив≥ш≥ природн≥ сполуки.
2. ћетоди одержанн€ елемент≥в п≥дгрупи јрсену. ќхарактеризувати процеси за допомогою р≥вн€нь реакц≥й.
3. ¬однев≥ сполуки јрсену, —тиб≥ю та Ѕ≥смуту в пор≥вн€нн≥ з ам≥аком та фосф≥ном.
4. ’≥м≥чн≥ властивост≥ простих речовин п≥дгрупи јрсену. ¬≥дношенн€ до неметал≥в. ¬заЇмод≥€ з н≥тратною кислотою.
5. јрсин, його одержанн€ ≥ властивост≥. «астосуванн€ в х≥м≥ко-токсиколог≥чних досл≥дженн€х. –еакц≥€ ћарша.
6. —тиб≥н та б≥смутин, одержанн€ ≥ властивост≥.
7. —полуки јрсену (III), —тиб≥ю (III), Ѕ≥смуту (III) з киснем, њх добуванн€ ≥ х≥м≥чн≥ властивост≥.
8. ќксиди та г≥дроксиди елемент≥в ≥з ступенем оксидац≥њ +3, њх кислотно-основн≥ та оксидац≥йно-в≥дновн≥ характеристики.
9. «ак≥нч≥ть р≥вн€нн€ реакц≥й:
AsH3 + KMnO4 + H2SO4 →
NaBiO3 + Mn(NO3)2 + HNO3 →
As + HNO3 (к.) →
As2O3 + Sn + H2SO4 →
SbCl3 + HCl + Zn →
Sb2S3 + HNO3 (к.) →
AsH3 + NaClO →
As + H2SO4 (к.) →
Sb + Br2 + NaOH →
SbCl3 + Na2CO3 + H2O →
10. як≥ форми оксигеновм≥сних ан≥он≥в јрсену (V) та —тиб≥ю (V) в≥дом≥? «≥ставте њх з фосфатними йонами, знайд≥ть причини под≥бност≥ та в≥дм≥нност≥. як впливають умови на склад арсенат- та стибат-йон≥в?
11. Ќаписати електронн≥ формули атом≥в елемент≥в As, Sb, Bi. ¬казати њх валентн≥ можливост≥.
12. ” вигл€д≥ €ких сполук јрсен, —тиб≥й та Ѕ≥смут знаход€тьс€ в природ≥? який загальний принцип добуванн€ цих елемент≥в з м≥нерал≥в? Ќаписати в≥дпов≥дн≥ реакц≥њ.
13. як реагують арсен, стиб≥й та б≥смут з хлором, киснем? Ќаписати в≥дпов≥дн≥ р≥вн€нн€ реакц≥й.
14. ќхарактеризуйте в≥дношенн€ арсену, стиб≥ю та б≥смуту до хлоридноњ, сульфатноњ та н≥тратноњ кислот. Ќапиш≥ть р≥вн€нн€ реакц≥й.
15. як ≥ чому зм≥нюЇтьс€ кислотно-основний характер оксид≥в та г≥дроксид≥в тривалентних елемент≥в при переход≥ в≥д јрсену до Ѕ≥смуту?
16. як одержати т≥оарсен≥ти та т≥оарсенати? ўо спостер≥гаЇтьс€ при п≥дкисленн≥ розчин≥в цих солей? Ќаписати р≥вн€нн€ реакц≥й.
17. Ѕ≥олог≥чна роль елемент≥в п≥дгрупи јрсену.
18. ¬ €ких умовах прот≥каЇ реакц≥€ взаЇмод≥њ натр≥ю арсен≥ту з йодом? „ому?
19. Ќаписати р≥вн€нн€ г≥дрол≥зу стиб≥ю хлориду.
20. ’≥м≥ко-токсиколог≥чне значенн€ сполук јрсену.
ќЌ“–ќЋ№Ќ≤ ѕ»“јЌЌя
1. ≈лектронна структура атом≥в елемент≥в п≥дгрупи јрсену в нормальному та збудженому стан≥.
2. —полуки јрсену (V), —тиб≥ю (V), Ѕ≥смуту (V) з киснем, њх добуванн€ ≥ х≥м≥чн≥ властивост≥.
3. ¬≥дновна здатн≥сть сполук ≥з ступенем оксидац≥њ +3 в р€ду As-Sb-Bi.
4. ћета- та ортоарсен≥тн≥ кислоти, њх х≥м≥чн≥ властивост≥, взаЇмоперетворенн€.
5. ƒисоц≥ац≥€ г≥дроксиду арсену €к амфотерного електрол≥ту.
6. јрсенатна кислота, њњ добуванн€ та оксидац≥йн≥ властивост≥.
7. јрсен≥ти та арсенати, њх кислотно-основн≥ та оксидац≥йно- в≥дновн≥ властивост≥.
8. як≥сна реакц≥€ на йон AsO43-.
9. Cол≥ кат≥он≥в —тиб≥ю та Ѕ≥смуту, њх г≥дрол≥з.
10. —ульф≥ди арсену, стиб≥ю та б≥смуту, њх характер, розчиненн€ в лугах та сульф≥д≥ амон≥ю.
11. ќдержанн€ натр≥ю б≥смутату та його властивост≥ €к сильного оксидника.
12. —тиб≥атна кислота та њњ сол≥.
13. «астосуванн€ сполук јрсену, —тиб≥ю та Ѕ≥смуту в медицин≥ та фармац≥њ.
14. —полуки елемент≥в п≥дгрупи јрсену з галогенами. ”творенн€ комплексних сполук та пентагалоген≥д≥в.
15. яку масу натр≥ю б≥смутату можна одержати при оксидац≥њ хлором в лужному середовищ≥ 4,66 г б≥смуту (III) оксиду?
16. «найд≥ть масову частку натр≥ю арсенату у 0,5ћ розчин≥ (ρ=1,07 г/см3).
17. ќбчисл≥ть процентний вм≥ст: а) As в скородит≥ (FeAsO4Х2H2O); б) Sb в кермезит≥ (3Sb2S3ХSb2O3).
18. який обТЇм 0,5ћ розчину йоду необх≥дно вз€ти дл€ оксидац≥њ 450 см3 0,1н розчину натр≥ю арсен≥ту?
19. ќдин ≥з способ≥в розд≥ленн€ сполук јрсену та —тиб≥ю грунтуЇтьс€ на пропусканн≥ с≥рководню кр≥зь розчин трихлорид≥в у концентрован≥й хлоридн≥й кислот≥. —початку осаджуЇтьс€ сульф≥д лише одного з елемент≥в. ѕ≥сл€ в≥дф≥льтровуванн€ осаду ≥ розбавл€нн€ розчину осаджують с≥рководнем сульф≥д ≥ншого елемента. ƒайте ≥нтерпретац≥ю тому, що в≥дбуваЇтьс€. ѕо€сн≥ть д≥ю концентрац≥йного фактора на ц≥ перетворенн€.
20. ÷инкову пластинку масою 19,5 г занурили у розчин сол≥ б≥смуту. „ерез де€кий час њњ маса зб≥льшилас€ до 26,6 г. —к≥льки грам≥в б≥смуту вид≥лилос€? „им доводитьс€ нехтувати при розвТ€занн≥ задач≥?
21. Ќавед≥ть приклади к≥лькох реакц≥й, за допомогою €ких можна добути натр≥й б≥смутат. ќхарактеризуйте перетворенн€ сол≥ п≥д д≥Їю хлоридноњ, сульфатноњ та н≥тратноњ кислот. Ќапиш≥ть р≥вн€нн€ реакц≥й.
22. „ому розчини SbCl3 та Bi(NO3)3 при розбавл€нн≥ водою стають каламутними? як зробити њх знову прозорими, не в≥докремлюючи осад≥в?
23. Ќапиш≥ть р≥вн€нн€ реакц≥й г≥дрол≥зу трихлорид≥в арсену, стиб≥ю, б≥смуту. ўо сп≥льного ≥ що в≥дм≥нного у перетворенн€х цих сполук п≥д д≥Їю води?
24. ќхарактеризуйте терм≥чну ст≥йк≥сть арсину, стиб≥ну, б≥смутину. як використовуЇтьс€ в≥дпов≥дна властив≥сть сполук дл€ визначенн€ јрсену, —тиб≥ю, Ѕ≥смуту в р≥зних речовинах?
—јћќ—“≤…Ќј ј”ƒ»“ќ–Ќј –ќЅќ“ј
1. ¬иконанн€ досл≥д≥в, описаних в даних методичних вказ≥вках.
2. ќбговоренн€ результат≥в та оформленн€ висновк≥в.
3. ќформленн€ та захист протоколу.
4. ¬≥дпов≥д≥ на запитанн€, запропонован≥ викладачем, з використанн€м запис≥в на дошц≥.
5.–озв'€зуванн€ розрахункових задач, запропонованих викладачем.
≈кспериментальна частина






