Наряду с уже рассмотренными превращениями, связанными с присутствием в молекуле фурана кольца, для этой группы соединений известны также реакции с участием различных функциональных групп. Правда, не все замещенные фураны устойчивы. Устойчивы, в основном, фураны с электроноакцепторными заместителями.
Химические свойства замещенных фуранов являются ожидаемыми. Рассмотрим, для примера, превращения фуранового альдегида – фурфурола.
Этот альдегид гетероциклического ряда вступает в обычные реакции, характерные для альдегидов, например, в реакции Канницаро и конденсацию бензоинового типа


Известен целый ряд соединений, состоящих из нескольких колец, одним из которых является фурановое кольцо. К ним относятся, в том числе, бензфуран (кумарон) и дибензофуран

Эти соединения содержатся в каменноугольной смоле и могут быть получены синтетически. Например, дибензофуран легко получается при термическом дегидрировании дифенилового эфира

Кроме чисто термических процессов, к дибензофуранам ведет также высокотемпературное окисление дифенилов. Так, образование хлорированных дибензофуранов происходит при нагревании хлорированных дифенилов с участием кислорода при 500-750оС

Обсуждение методов получения хлорированных дибензофуранов связано с тем, что их некоторые представители, содержащие атомы хлора в 2,3,7,8-положениях, относятся к наиболее ядовитым суперэкотоксикантам и лишь немногим уступают хлорированным диоксинам. Из изложенного выше видно, что они легко могут образоваться в процессах получения, использования и утилизации полихлорированных дифенилов и дифениловых эфиров.
Пиррол
Пиррол был найден в каменноугольной смоле и в костном масле – продукте сухой перегонки обезжиренных костей (Рунге, 1834 г.). Свое название получил по способности окрашивать в красный цвет (pyrrol – красное масло) сосновую лучинку, смоченную соляной кислотой. Строение пиррола установлено Байером в 1870 г.

Пиррольное кольцо, как структурный фрагмент, входит в молекулу органических соединений, имеющих исключительно важное биологическое значение: аминокислот и белков, алкалоидов, хлорофиллов, гемина крови, витамина В12 и многих других.
Способы получения. Как и фуран, пиррол можно получить дегидратацией 1,4-дикарбонильных соединений с участием аммиака

Другой удобный способ получения пиррола - пиролиз аммониевой соли слизевой кислоты

Перегонка с цинковой пылью имида янтарной кислоты (сукцинимида) в енольной форме, структурно близкого пирролу соединения, также ведет к пирролу

Еще одним удобным методом получения пиррола и N-алкилзамещенных пирролов является дегидратация 1,4-бутиндиола пропусканием его паров с аммиаком или аминами при 300оС над катализатором, состоящим из оксидов алюминия и тория
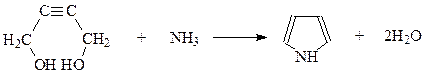
Исходный диол легко получается конденсацией ацетилена с двумя молекулами формальдегида.
Химические свойства. По своему строению пиррол представляет собой плоское пятичленное кольцо. Находящиеся вне гибридизации электроны четырех углеродных атомов и два электрона гетероатома образуют в пирроле общее электронное облако. Энергия резонанса пиррола составляет 100,49 кДж/моль. Судя по длинам связей в пирроле, электронное облако в этом гетероцикле распределено неравномерно

Связь С2–С3 несколько длиннее двойной связи, а связь С3-С4 существенно короче ординарной связи.
В соответствии со строением, пиррол проявляет ароматический характер, вступает в реакции присоединения, обладает кислотно-основными свойствами.
Реакции замещения
По способности вступления в реакции электрофильного замещения пиррол напоминает фенол и анилин. Атомы углерода в пирроле α -электроноизбыточны. Если в бензоле на каждый атом кольца приходится один электрон, то в случае пиррола - больше, причем, электронная плотность распределена неравномерно. В пирроле наибольшая электронная плотность приходится на 2 – и 5-положения кольца.
Однако такая электроноизбыточность не объясняет предпочтительности α -положения пиррола в реакциях электрофильного замещения. В этих реакциях более существенную роль играет, по-видимому, то обстоятельство, что при α-атаке образуется более стабильный σ -комплекс,
чем при β -атаке. Действительно, в карбокатионе, образующемся при атаке в α -положение, в делокализации заряда участвуют три канонические структуры, а в альтернативном случае – только две структуры

Рассмотрим конкретные реакции электрофильного замещения с участием пиррола.
Галогенирование. Пиррол галогенируется так же легко, как и фенол. Если не предпринимать мер предосторожности, галогенирование идет во все положения фуранового кольца. Моногалогенпирролы удается получить лишь в особо мягких условиях

Тетраиодпиррол используется как антисептик (иодол).
Нитрование. При нитровании пиррола ацетилнитратом при относительно низкой температуре (5оС) в продуктах реакции нитрогруппа занимает α -положение (выход около 7%)

Известно, что реакционная способность каждого из α -и β -углеродов пиррола в рассматриваемой реакции выше, чем у бензола более чем в 1000 раз.
Сульфирование. Вследствие ацидофобности пиррола сульфировать его серной кислотой не представляется возможным. Чтобы обойти это затруднение, применяют уже знакомый пиридинсульфотриоксид. Как и в случае других реакций электрофильного замещения, сульфирование пиррола идет с участием α -положений кольца

Алкилирование. Как и в случае фурана, прямое алкилирование пиррола протекает неоднозначно и сопровождается полимеризацией. Поэтому с целью введения алкильного радикала в пиррольное ядро, прибегают к косвенному приему. Сперва получают металлическое производное этого гетероцикла, затем реакцией с галогеналкилами проводят N - и С -алкилирование. При температурах реакции ниже 0оС происходит N -алкилирование, а продукты С -алкилирования обычно получают восстановлением продуктов их ацилирования

Ацилирование. Остаток карбоновой кислоты во 2-положение пиррольного кольца можно ввести при помощи реакции гетероцикла с ангидридами кислот. Так, пиррол реагирует с уксусным ангидридом при 150оС даже без катализатора

При формилировании пиррола используется реакция Вильсмайера-Хаака. В этой реакции в качестве ацилирующего средства применяют диметилформамид в присутствии фосфорилхлорида
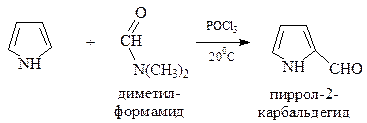
Наконец, следует отметить, что реакционная способность пиррола позволяет реагировать ему даже с солями диазония

Реакции присоединения
Пиррол вступает в некоторые реакции присоединения, в которых ведет себя как непредельное соединение с системой сопряженных двойных связей. Так, в отличие от бензола, пиррол присоединяет атомарный водород с образованием пирролина. Каталитическое восстановление водородом над окисью платины или никелем приводит к пирролидину

Другим примером присоединения к пирролу может послужить реакция с трифенилметильным радикалом







