Типичными представителями ароматических углеводородов являются производные бензола, т.е. такие карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести атомов углерода, называемая бензольным или ароматическим ядром.Общая формула ароматических углеводородов CnH2n-6.
Строение бензола
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами: 
Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными "полуторными " связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, и все валентные углы равны 120°.
шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:

С теоретической точки зрения ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p- электронов, где n – целое число. Приведенным критериям ароматичности, известным под названием правила Хюккеля, в полной мере отвечает бензол. Его число шесть p- электронов является числом Хюккеля для n=1, в связи с чем, шесть p- электронов молекулы бензола называют ароматическим секстетом".
Примером ароматических систем с 10 и 14 p- электронами являются представители многоядерных ароматических соединений –
нафталин  и антрацен
и антрацен  .
.
Изомерия
Теория строения допускает существование только одного соединения с формулой бензола (C6H6) а также только одного ближайшего гомолога – толуола (C7H8). Однако последующие гомологи могут уже существовать в виде нескольких изомеров. Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Положение двух заместителей указывают с помощью приставок: орто- (о-), если они находятся у соседних углеродных атомов (положение 1, 2-), мета- (м-) для разделенных одним атомом углерода (1, 3-) и пара- (п-) для находящихся напротив друг друга (1, 4-).
Например, для диметилбензола (ксилола):
орто-ксилол (1,2-диметилбензол)  мета-ксилол (1,3-диметилбензол)
мета-ксилол (1,3-диметилбензол)  пара-ксилол (1,4-диметилбензол)
пара-ксилол (1,4-диметилбензол) 
Получение
1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.
 гептан гептан
| ––500°C--- |  толуол толуол
| + 4H2 |
2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина при 300°C.
 циклогексан циклогексан
| ––300°C,Pd® | 
| + 3H2 |
3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).
| 3НCєСН | ––600°C® | 
|
4) Сплавление солей ароматических кислот со щелочью или натронной известью.

| + NaOH | ––t°® | 
| + Na2CO3 |
5) Алкилирование собственно бензола галогенопроизводными (реакция Фриделя-Крафтса) или олефинами.

| + CН3- | СН-Сl I CH3 | ––AlCl3® | 
| CH-CH3 I + HCl CH3 изопропил- бензол |

| + CН2=CН2 | ––H3PO4® | 
| CН2-CН3 этил- бензол |
Ароматические соединения с одним бензольным кольцом: физические и химические свойства. Механизм реакций электрофильного замещения (SE) в бензольном ядре. Теория замещения в бензольном ядре.
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Физические свойства некоторых аренов представлены в таблице.
Таблица. Физические свойства некоторых аренов
| Название | Формула | t°.пл., °C | t°.кип., °C | d420 |
| Бензол | C6H6 | +5,5 | 80,1 | 0,8790 |
| Толуол (метилбензол) | С6Н5СH3 | -95,0 | 110,6 | 0,8669 |
| Этилбензол | С6Н5С2H5 | -95,0 | 136,2 | 0,8670 |
| Ксилол (диметилбензол) | С6Н4(СH3)2 | |||
| орто- | -25,18 | 144,41 | 0,8802 | |
| мета- | -47,87 | 139,10 | 0,8642 | |
| пара- | 13,26 | 138,35 | 0,8611 | |
| Пропилбензол | С6Н5(CH2)2CH3 | -99,0 | 159,20 | 0,8610 |
| Кумол (изопропилбензол) | C6H5CH(CH3)2 | -96,0 | 152,39 | 0,8618 |
| Стирол (винилбензол) | С6Н5CH=СН2 | -30,6 | 145,2 | 0,9060 |
Химические свойства
Бензольное ядро обладает высокой прочностью, чем и объясняется склонность ароматических углеводородов к реакциям замещения. В отличие от алканов, которые также склонны к реакциям замещения, ароматические углеводороды характеризуются большой подвижностью атомов водорода в ядре, поэтому реакции галогенирования, нитрования, сульфирования и др. протекают в значительно более мягких условиях, чем у алканов.
Электрофильное замещение в бензоле
Несмотря на то, что бензол по составу является ненасыщенным соединением, для него не характерны реакции присоединения. Типичными реакциями бензольного кольца являются реакции замещения атомов водорода – точнее говоря, реакции электрофильного замещения.
Рассмотрим примеры наиболее характерных реакций этого типа.
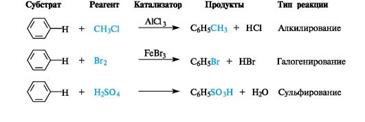
1) Галогенирование. При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода ядра замещается галогеном.
 + Cl2 –AlCl3®
+ Cl2 –AlCl3®  (хлорбензол) + H2O
(хлорбензол) + H2O
Реакции галогенирования осуществляются в присутствии катализатора, в качестве которого чаще всего используют хлориды алюминия или железа.
2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это смесь концентрированных азотной и серной кислот в соотношении 1:2 соответственно).
 + HNO3 –H2SO4®
+ HNO3 –H2SO4®  (нитробензол) + H2O
(нитробензол) + H2O
Серная кислота в данной реакции играет роль катализатора и водоотнимающего средства.
3) Сульфирование. Реакция сульфирования осуществляется концентрированной серной кислотой или олеумом (олеум – это раствор серного ангидрида в безводной серной кислоте). В процессе реакции водородный атом замещается сульфогруппой, приводя к моносульфокислоте.
 + H2SO4 –SO3®
+ H2SO4 –SO3®  (бензолсульфокислота) + H2O
(бензолсульфокислота) + H2O
4) Алкилирование (реакция Фриделя-Крафтса). При действии на бензол алкилгалогенидов в присутствии катализатора (хлористого алюминия) осуществляется замещение алкилом атома водорода бензольного ядра.
 + R–Cl –AlCl3®
+ R–Cl –AlCl3®  (R-углеводородный радикал) + HCl
(R-углеводородный радикал) + HCl
Следует отметить, что реакция алкилирования представляет собой общий способ получения гомологов бензола - алкилбензолов.
Рассмотрим механизм реакции электрофильного замещения в ряду бензола на примере реакции хлорирования.
Первичной стадией является генерирование электрофильной частицы. Она образуется в результате гетеролитического расщепления ковалентной связи в молекуле галогена под действием катализатора и представляет собой хлорид-катион.

| + AlCl3 ® Cl+ + AlCl4- |
Образующаяся электрофильная частица атакует бензольное ядро, приводя к быстрому образованию нестойкого p- комплекса, в котором электрофильная частица притягивается к электронному облаку бензольного кольца.

| + Cl+ ® | 
| Cl+ |
| p- комплекс |
Иными словами, p- комплекс – это простое электростатическое взаимодействие электрофила и p- электронного облака ароматического ядра.
Далее происходит переход p- комплекса в s- комплекс, образование которого является наиболее важной стадией реакции. Электрофильная частица "захватывает" два электрона s- электронного секстета и образует s- связь с одним из атомов углерода бензольного кольца.

| Cl+ ® |  s- комплекс
s- комплекс
|
s- Комплекс – это катион, лишенный ароматической структуры, с четырьмя p- электронами, делокализованными (иначе говоря, распределенными) в сфере воздействия ядер пяти углеродных атомов. Шестой атом углерода меняет гибридное состояние своей электронной оболочки от sp2- до sp3-, выходит из плоскости кольца и приобретает тетраэдрическую симметрию. Оба заместителя – атомы водорода и хлора располагаются в плоскости, перпендикулярной к плоскости кольца.
На заключительной стадии реакции происходит отщепление протона от s- комплекса и ароматическая система восстанавливается, поскольку недостающая до ароматического секстета пара электронов возвращается в бензольное ядро.
 ®
®  + H+
+ H+
Отщепляющийся протон связывается с анионом четыреххлористого алюминия с образованием хлористого водорода и регенерацией хлорида алюминия.
H+ + AlCl4- ® HCl + AlCl3
Именно благодаря такой регенерации хлорида алюминия для начала реакции неоходимо очень небольшое (каталитическое) его количество.
Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.
1) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с образованием циклогексана, а производные бензола дают производные циклогексана.
 + 3H2 –t°,p,Ni®
+ 3H2 –t°,p,Ni®  (циклогексан)
(циклогексан)
2) На солнечном свету под воздействием ультрафиолетового излучения бензол присоединяет хлор и бром с образованием гексагалогенидов, которые при нагревании теряют три молекулы галогеноводорода и приводят к тригалогенбензолам.

| + 3Cl2 –hn® |  гексахлорциклогексан
гексахлорциклогексан
| 
|  сим-трихлорбензол
сим-трихлорбензол
|
3) Окисление. Бензольное ядро более устойчиво к окислению, чем алканы. Даже перманганат калия, азотная кислота, пероксид водорода в обычных условиях на бензол не действуют. При действии же окислителей на гомологи бензола ближайший к ядру атом углерода боковой цепи окисляется до карбоксильной группы и дает ароматическую кислоту.
 + 2KMnO4 ®
+ 2KMnO4 ®  (калиевая соль бензойной кислоты) + 2MnO2 + KOH + H2O
(калиевая соль бензойной кислоты) + 2MnO2 + KOH + H2O
 + 4KMnO4 ®
+ 4KMnO4 ®  + K2CO3 + 4MnO2 + 2H2O + KOH
+ K2CO3 + 4MnO2 + 2H2O + KOH
Во всех случаях, как видно, независимо от длины боковой цепи образуется бензойная кислота.
При наличии в бензольном кольце нескольких заместителей можно окислить последовательно все имеющиеся цепи. Эта реакция применяется для установления строения ароматических углеводородов.
 –[O]®
–[O]®  (терефталевая кислота)
(терефталевая кислота)
Применение
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола.
Наиболее типичные для ароматических соединений реакции электрофильного замещения SE приведены на примере бензола на схеме 3.2.
Схема 3.2. Реакции электрофильного замещения в бензоле
Общее описание механизма реакций электрофильного замещения SE.
Наличие π-электронной плотности с двух сторон плоского ароматического цикла (см. 2.3.2) ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться электрофильной атаке. В общем виде реакции замещения протона в бензольном коль- це на другие электрофилы можно представить следующим образом:

Механизм таких реакций включает ряд общих стадий. Первичной стадией является генерирование электрофильной частицы. Она обычно образуется путем взаимодействия реагента EY с катализатором и может представлять собой либо электронодефицитную часть поляризованной молекулы реагента Εδ+-Υδ-, либо частицу Е+ с полным положительным зарядом (после гетеролитического разрыва связи).

Предполагают, что электрофильная частица, атакуя ароматический субстрат, сначала образует нестойкий π-комплекс, в котором она одновременно связана со всеми π-электронами ароматической системы.

Наиболее важна стадия образования σ-комплекса (самая медленная стадия реакции). Электрофил «забирает» два электрона π-системы и образует σ-связь с одним из атомов углерода бензольного кольца. В σ-комплексе ароматичность нарушена, поскольку один из атомов углерода кольца перешел в sp3 -гибридизованное состояние. Некоторые σ-комплексы удалось выделить в индивидуальном виде.
На последней (быстрой) стадии реакции происходит отщепление протона от σ-комплекса. Ароматическая система восстанавливается (недостающая до секстета пара электронов возвращается в бензо-
льное ядро). Отщепляющийся протон связывается с нуклеофильной частью реагента.






