Классификация органических соединений.
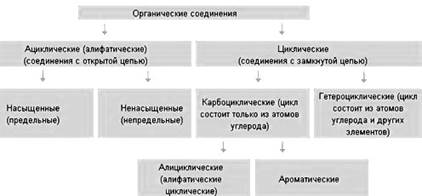
• насыщенные (предельные) -все атомы углерода связаны между собой только простыми связями;
• ненасыщенные (непредельные) - атомами углерода кроме одинарных простых связей, имеются также и двойные, и тройные связи. алкены, алкины и алкадиены.
В молекулах как ациклических и циклических соед атомы водорода можно замещать на другие атомы или группы атомов, таким образом, получать производные углеводородов. Наличие тех или иных групп в молекулах органических соединений обуславливает общность их свойств. На этом основана классификация производных углеводородов.
К «Другим классам органических соединений» относятся следующие:
Спирты получаются замещением одного или нескольких атомов водорода гидроксильными группами – OH. Это соединение с общей формулой R – (OH)х, где х – число гидроксильных групп. Формула CnH2n+1OH
Альдегиды содержат альдегидную группу (С = О), которая всегда находится в конце углеводородной цепи.
Карбоновые кислоты содержат в своём составе одну или несколько карбоксильных групп – COOH.
Сложные эфиры – производные кислородосодержащих кислот, которые формально являются продуктами замещения атомов водорода гидроокислов –OH кислотной функции на углеводородный остаток; рассматриваются также как ацилпроизводные спиртов.Жиры (триглицериды) – природные органические соединения, полные сложные эфиры глицерина и односоставных жирных кислот; входят в класс липидов. Природные жиры содержат в своём составе три кислотных радикала с неразветвлённой структурой и, обычно, чётное число атомов углерода.Углеводы – органические вещества, которые содержат содержащими неразветвленную цепь из нескольких атомов углерода, карбоксильную группу и несколько гидроксильных групп.Амины содержат в своём составе аминогруппу – NH2
Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Белки – высокомолекулярные органические вещества, которые состоят состоящие из альфа – аминокислот, соединённых в цепочку пептидной связью.
Нуклеиновые кислоты – высокомолекулярные органические соединения, биополимеры, образованные остатками нуклеотидов.
Строение органических соединений: гибридизация орбиталей атома углерода, типы связей в органических соединениях.
Гибридизация атомных орбиталей углерода
Гибридизация- это мысленная операция превращения обычных атомных орбиталей в новые орбитали, геометрия которых соответствует эксперементально определенной геометрии молекул.
Для образования молекулы метана атом углерода переходит в возбужденное состояние: С* 1s22s12p12p12p1 (рис. 3).
Наиболее распространенным типом химической связи в органических соединениях является ковалентная связь. Она образуется за счет перекрывания орбиталей двух атомов с образованием общей электронной пары. Ковалентная связь может быть простой (одинарной), двойной и тройной. Простая (одинарная) или σ(сигма)-связь – связь между атомами, осуществляемая одной парой электронов, максимальная плотность которых расположена на линии, соединяющей центры этих атомов.Такая связь может быть образована при перекрывании орбиталей как s-, так и 2р-электронов, а также электронов орбиталей, находящихся в состоянии sp3-, sp2- и sр-гибридизации.
Кратная химическая связь – это связь, образованная обобществлением двух или трех электронных пар.
Кратная связь может быть двойной (в случае двух пар электронов) или тройной (с участием трех пар электронов). Кратные связи состоят из одной σ-связи и одной или двух π-связей. В этом случае σ-связь образуется в результате перекрывания sр2 –гибридных орбиталей, а π-связь негибридизованных 2р-орбиталей. Электроны,
принимающие участие в образовании π-связи, называют πэлектронами.Молекула с ковалентной связью может быть неполярной, если связанные этой связью атомы имеют одинаковую электроотрица-
тельность (например, в случае молекулы водорода). Если же один
из атомов обладает большим сродством к электрону и по этой при-
чине электронная плотность смещена в его сторону, то такая моле-
δ+ δ-
кула или связь будет полярной. Так, в формуле СН 3 Сl знаки δ+ и
δ- означают, что на атоме хлора имеется избыточная электронная
плотность (частичный отрицательный заряд), а на атоме углерода – их
дефицит (частичный положительный заряд). Смещение электрон-
ной плотности можно показать стрелкой: СН3 → С1. Чем больше раз-
ница в электроотрицательности атомов, связанных ковалентной свя-
зью, тем более полярна молекула (или связь). Практически все
ковалентные связи полярны (за исключением симметричных моле-
кул).






