Физические свойства спиртов
Учитывая полярность связи О—Н и значительный частичный положительный заряд, локализованный (сосредоточенный) на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал.
Необходимо отметить, что атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность спиртам образовывать особые, так называемые водородные связи между молекулами. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу 32, в обычных условиях жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и ок-танол уже не смешивается с водой.
Химические свойства
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельнымиметаллами (замещаться на них).
С водой это взаимодействие идет значительно активнее, чем со спиртом, сопровождается большим выделением тепла, может приводить к взрыву. Это различие объясняется электронодонорными свойствами ближайшего к гидроксильной группе радикала. Обладая свойствами донора электронов (+I-эффектом), радикал несколько повышает электронную плотность на атоме кислорода, «насыщает» его за свой счет, уменьшая тем самым полярность О—Н-связи и «кислотный» характер атома водорода гидроксильной группы в молекулах спиртов по сравнению с молекулами воды.
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов.
Например:
С2Н5ОН + НВг <-> С2Н5Вг + Н2O
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140 °С образуется диэтиловый (серный) эфир.
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
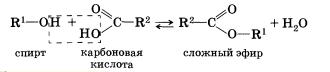
Реакция этерификации катализируется сильными неорганическими кислотами.
Например, при взаимодействии этилового спирта и уксус-аой кислоты образуется уксусноэтиловый эфир — этилацетат:
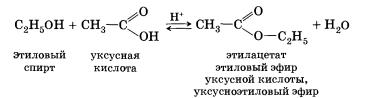
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате ее образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксиль-ной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140 °С в присутствии концентрированной серной кислоты.
6. Окисление спиртов обычно проводят сильными окислителями, например дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
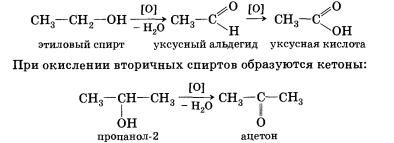
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов. При пропускании паров спирта при 200—300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
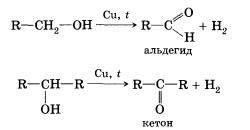
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди(II).
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Алкоголяты щелочных и щелочноземельных металлов подвергаются гидролизу при взаимодействии с водой. Например, при растворении этилата натрия в воде протекает обратимая реакция
С2Н5ОNа + НОН <-> С2Н5ОН + NаОН
равновесие которой практически полностью смещено вправо. Это также подтверждает, что вода по своим кислотным свойствам («кислотному» характеру водорода в гидроксильной группе) превосходит спирты. Таким образом, взаимодействие алкоголятов с водой можно рассматривать как взаимодействие соли очень слабой кислоты (в данном случае в этом качестве выступает спирт, образовавший алкоголят) с кислотой более сильной (эту роль здесь играет вода).
Спирты могут проявлять основные свойства при взаимодействии с сильными кислотами, образуя соли алкилоксония благодаря наличию неподеленной электронной пары на атоме кислорода гидроксильной группы:
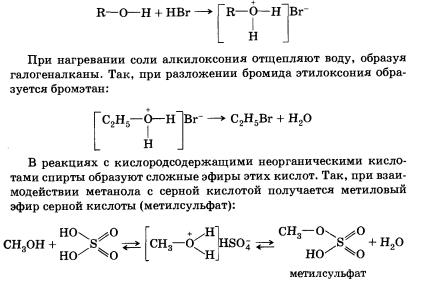
Реакция этерификации обратима (обратная реакция — гидролиз сложного эфира), равновесие смещается вправо в присутствии водоотнимающих средств.
Внутримолекулярная дегидратация спиртов протекает в соответствии с правилом Зайцева: при отщеплении воды от вторичного или третичного спирта атом водорода отрывается от наименее гидрированного атома углерода. Так, дегидратация бутанола-2 приводит к бутену-2, а не бутену-1.
Наличие в молекулах спиртов углеводородных радикалов не может не сказаться на химических свойствах спиртов.
Химические свойства спиртов, обусловленные углеводородным радикалом, различны и зависят от его характера. Так, все спирты горят; непредельные спирты, содержащие в молекуле двойную С=С связь, вступают в реакции присоединения, подвергаются гидрированию, присоединяют водород, реагируют с галогенами, например, обесцвечивают бромную воду, и т. д.
Способы получения
1. Гидролиз галогеналканов. Вы уже знаете, что образование галогеналканов при взаимодействии спиртов с галогено-водородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой.
Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле.
2. Гидратация алкенов — присоединение воды по тг-связи молекулы алкена — уже знакома вам. Гидратация пропена приводит в соответствии с правилом Марковникова к образованию вторичного спирта — пропанола-2
ОН
l
СН2=СН—СН3 + Н20 -> СН3—СН—СН3
пропен пропанол-2
3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов.
4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена).
5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода(II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка).
Необходимую для этой реакции смесь угарного газа и водорода, называемую также (подумайте почему!) «синтез-газ», получают при пропускании паров воды над раскаленным углем.
6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен.
Рассмотрим реакцию получения спиртов из галогеналканов — реакцию гидролиза галогенпроизводных углеводородов. Ее обычно проводят в щелочной среде. Выделяющаяся бромоводородная кислота нейтрализуется, и реакция протекает практически до конца.
Эта реакция, как и многие другие, протекает по механизму нуклеофильного замещения.
Это реакции, основной стадией которых является замещение, протекающее под воздействием нуклеофильной частицы.
Напомним, что нуклеофильной частицей является молекула или ион, имеющая неподеленную электронную пару и способная притягиваться к «положительному заряду» — участкам молекулы с пониженной электронной плотностью.
Наиболее распространенными нуклеофильными частицами являются молекулы аммиака, воды, спирта или анионы (гидроксил, галогенид, алкоксид-ион).
Частицу (атом или группу атомов), замещаемую в результате реакции на нуклеофил, называют уходящей группой.
Замещение гидроксильной группы спирта на галогенид-ион также протекает по механизму нуклеофильного замещения:
СН3СН2ОН + НВг —> СН3СН2Вг + Н20
Интересно, что эта реакция начинается с присоединения катиона водорода к атому кислорода, содержащегося в гидроксильной группе:
СН3СН2—ОН + Н+ —> СН3СН2— ОН
Под действием присоединившегося положительно заряженного иона связь С—О еще больше смещается в сторону кислорода, эффективный положительный заряд на атоме углерода увеличивается.
Это приводит к тому, что нуклеофильное замещение на галогенид-ион происходит гораздо легче, а отщепляется под действием нуклеофила молекула воды.
СН3СН2—ОН+ + Вг —> СН3СН2Вг + Н2O
Получение простых эфиров
При действии алкоголята натрия на бромэтан происходит замещение атома брома на алкоголят-ион и образуется простой эфир.
Реакцию нуклеофильного замещения в общем виде можно записать следующим образом:
R - X +HNu -> R - Nu +HX,
если нуклеофильной частицей является молекула (НВг, Н20, СН3СН2ОН, NН3, СН3СН2NН2), или
R—X + Nu- —> R—Nu + Х-,
если нуклеофилом является анион (ОН, Вг-, СН3СН2O-), где X — галоген, Nu — нуклеофильная частица.
Отдельные представители спиртов и их значение
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт — объясняется одним из способов его получения — перегонкой твердых пород дерева (греч. — вино, опьянеть; вещество, древесина).
Метанол очень ядовит! Он требует осторожного обращения при работе с ним. Под действием фермента алкогольде-гидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96% (по объему) этанола и 4% (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди(II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным или денатуратом.
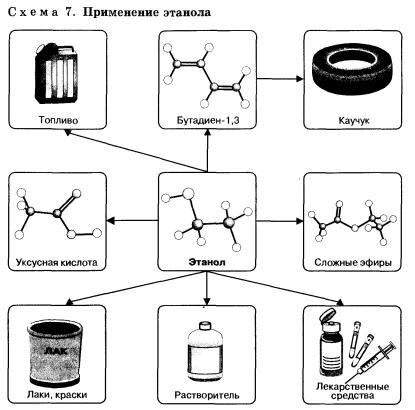
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах, значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пропантриол-1,2,3 (глицерин) — вязкая, сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел. Широко используется в косметике, фармацевтической ипищевой промышленности. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание. К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и таким образом придавая пластмассам необходимую гибкость и эластичность
Пентахлорфенол (ПХФ) получают хлорированием фенола при высокой температуре. Он представляет собой белое кристаллическое — вещество. Плохо растворяется в воде, при взаимодействии со щелочами дает соли. Ядовит для теплокровных животных (ЛД&0 для кроликов 36, для мышей—150). Наибольшее распространение получила натриевая соль пентахлорфенола — пентахлорфенолят натрия. Он выпускается промышленностью в виде 92%-ного порошка, который хорошо растворим в воде; применяют как водный раствор. Для улучшения проникновения гербицида в ткани растения к раствору добавляют 0,1—0,2% ОП-7.
Используют пентахлорфенолят натрия главным образом для предвсходовой борьбы с сорняками на посевах некоторых овощных культур при норме расхода около 5—10 кг на 1 га. Широко используют этот гербицид и для борьбы с сорняками на не посевных площадях, на обочинах дорог, на оросительно-осушительных канавах и т. д. (10—30 кг на 1 га).
Пентахлорфенол выпускается. промышленностью в виде 20—35%-ного раствора в минеральном масле. Используют для борьбы с однолетними сорняками на кукурузе, сахарной свекле, хлопчатнике, зернобобовых для предвсходовой обработки в дозировке от 8 до 12 кг на 1 га, для борьбы с повиликой после укоса многолетних трав —от 15 до 20 кг на 1 га. Применяют пентахлорфенол также для крепления минеральных масел.
В последнем случае его вводят в масло в количестве 5—10% (2—3 кг на 1 га). -Далее из этого крепленого масла приготовляют эмульсию с концентрацией по пен-тахлорфенолу 0,5%. Такой эмульсии расходуют не менее 600г—800 л на га. Применяют ее в тех же случаях, что и пентахлорфенолят натрия или общенстребительные минеральные масла.
Кроме применения пентахлорфенола как гербицида, его используют в качестве дефолианта на хлопчатнике (5—10%-ные дусты на инертном наполнителе, водные растворы пентахлорфенолята натрия). Листья опадают через 2 недели после обработки.






