Подтверждённая экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила учёных к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику. Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определённую массу покоя), а с другой—его движение напоминает волну и может быть описано определённой амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определённой траектории движения электрона—можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Cледовательно, под электронной орбитой следует понимать не определённую линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая.
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
По современным представлениям состояние электрона в атоме описывается четырьмя квантовыми числами.
Главное квантовое число – n определяет энергию АО и номер энергетического уровня, на котором находится электрон (т.е. допустимые уровни энергии электрона) и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число – 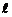 определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-1.
определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-1.
Магнитное квантовое число – m l определяет пространственную ориентацию данной АО и отчасти её форму (т.е. ориентацию электронных облаков в пространстве) и может принимать значения от – 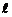 …0…+
…0…+ 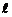 .
.
Спиновое квантовое число – ms характеризует собственный момент импульса и связанный с ним магнитный момент (т.е. вращение электрона вокруг оси), и может принимать значения ± 1/2.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2 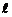 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
+1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
| n=1 | l=0 | m=0 | 1s |
| n=2 | l=0 | m=0 | 2s |
| l=1 | m=-1,0,1 | 2px, 2py,2pz | |
| n=3 | l=0 | m=0 | 3s |
| l=1 | m=-1,0,1 | 3px,3py,3pz | |
| l=2 | m=±2,±1,0 | 3d (5 орбиталей) | |
| n=4 | l=0 | m=0 | 4s |
| l=1 | m=-1,0,1 | 4px,4py,4pz | |
| l=2 | m=±2,±1,0 | 4d (5 орбиталей) | |
| l=3 | m=±3, ±2, ±1,0 | 4f (7 орбиталей) |
Например строение атома фтора выражается электронной формулой
F 1s22s22p5 и электронно-графической формулой:
2s 2p
| 1s | ¯ | ¯ | ¯ | | ||
| ¯ | ||||||
При заполнении АО действуют правила:
1. Принцип Паули (или запрет Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковые. Основным следствием этого принципа является то, что на одной АО не может находиться более двух электронов. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа. При переходах электронов с одной орбиты на другую атом поглощает или излучает энергию.
Принцип Паули определяет ёмкость (максимальное число электронов) энергетических уровней и подуровней, которая соответственно равна 2n2 и 2(2 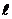 +1) т.е. удвоенному числу АО.
+1) т.е. удвоенному числу АО.
2. Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Например, четыре валентных p – электрона атома кислорода размещаются в квантовых ячейках следующим образом:
2p
| ¯ | | |
3. Закономерная последовательность заполнения энергетических уровней и подуровней в атомах с увеличением порядкового номера элемента выражается правилами Клечковкого,
Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы n+ 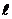 .
.
При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа.
Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ® 4 d ® 5 p ® 6 s ® …
Например:
Цезий (Сs) находится в 6 периоде, его 55 электронов (порядковый номер 55) распределены по 6 энергетическим уровням и их подуровням. Cоблюдая последовательность заполнения электронами орбиталей получим:
55Cs 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s24d10 5p6 6s1
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома становится возможным «распаривание» валентных электронов, то есть их переход с тех подуровней, где все АО заняты полностью (↑↓) на другие валентные подуровни того же уровня, имеющие незаполненные АО.
Возбуждение меняет валентное состояние атома (число его неспаренных электронов).
С 1s22 s22p2 –основное электронное состояние; валентность равна 2.
С * 1s22 s12p3-возбужденное состояние атома; валентность равна 4.






