Тот факт, что растворимость водорода в расплавах на основе железа подчиняется закону "квадратного корня" (Сивертса), со всей определенностью доказывает диссоциацию молекул Н2 на атомы и переход водорода в металл в форме атомов, а для некоторых металлов и в форме гидридов, имеющих общую формулу Ме n Н.
Экспериментальные данные, полученные для интервалов температур, характерных для существования Fe d и Fe g дают основание утверждать, что присутствие растворенного водорода в атомарной форме свойственно и для этих высокотемпературных модификаций железа. Однако остается еще не выясненным, как именно растворяется водород в твердом железе и его сплавах, как он внедряется в кристаллическую решетку железа и как сохраняется в ней, в особенности при низких "комнатных" и "отрицательных" температурах. Очевидно, растворимость водорода при этих температурах ничтожна и она полностью маскируется при экспериментальных исследованиях адсорбции или хемсорбции водорода. В то же время для понимания природы воздействия водорода на служебные свойства металла особенно важно знать природу нахождения в нем водорода. В ряде работ по рентгенографии, в частности [182], было установлено, что при растворении водорода в решетке a-железа ее параметр остается неизменным: 2,867±0,0015. Следовательно, не приходится говорить о том, что водород, подобно, например, азоту и углероду, образует в железе фазы внедрения (по крайней мере, в обычном их понимании). Еще в середине 40-х годов А.И. Красников [183] предположил, что водород при растворении в металлах ионизируется под их воздействием, отдает электрон в общий "электронный газ", а сам в форме протона, т.е. в виде элементарных частиц несравненно меньших размеров по сравнению с атомами водорода, внедряется в электронные оболочки атомов металла-растворителя. Естественно, такие ничтожные изменения межатомных расстояний не могут быть замечены обычными методами рентгеноструктурных исследований. Впоследствии это предположение было экспериментально подтверждено исследованиями вторичных рентгеновских спектров, полученных с помощью специально разработанной рентгеновской трубки с большой разрешающей способностью. Подтвердили его также и некоторые опыты по насыщению водородом расплавленного металла, находящегося под воздействием сильного постоянного электрического поля, а также по экстрагировании водорода в тех же условиях [184]. Авторы согласны с А.Н. Морозовым [158], предположившим, что в стальных образцах, охлажденных до комнатной температуры, значительная часть водорода, поглощенного ими в процессе плавки, находится уже не в растворенном виде, а в форме молекул десорбированного водорода, выделенных в дефектных участках структуры металла. Об этом свидетельствует резко выраженный экстремум на кривой скорости выделения водорода, неоднократно наблюдавшийся нами в момент разрушения под нагрузкой стального образца, находящегося в вакууме [204]. Расчеты показали, что водород, образовавший этот пик, был локализован в молекулярной форме в каких-то микродефектах в районе разрушения металла (см. рис. 62).
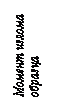

Для исследования формы существовании водорода в образцах, охлажденных до минусовых температур, авторами был сконструирован микроанализатор на газы, представлявший собой комбинацию оптического квантового генератора (лазера) и масс-спектрометра, снабженного системой напуска исследуемых газов. Установка позволяла определять количество водорода, находящегося в объемах металла, мгновенно расплавляемого (не более 0,001 сек) и частично (или полностью) испаряемого под воздействием луча лазера. Прицельный обстрел поверхности металла лучами лазера производился с помощью микроскопа. При этом на поверхности образца выплавляли лунку, имевшую в зависимости от расходуемой мощности и природы металла либо форму конуса с диаметром основания 35-40×10–6 м и глубиной 70-80×10–6 м, либо шарового сегмента диаметром 60×10–6 м и глубиной 10-15×10–6 м. Вес исследованной пробы металла определялся путем измерения размеров осевого сечения выплавленной лунки: он составлял обычно от 10-8 до 10–5кг.
Вследствие очень короткого времени "лазерной атаки" водород из окружающего "лунку" металла выделиться не успевал, т.е. им пренебрегали, что давало ошибки не более ±5 %. Количество выделившегося водорода измеряли по объему газа, проходившего от исследуемой лунки через масспекторометр, оцениваемому по интенсивности отметки контролируемой массы 2. Надежность метода проверили путем исследования распределения водорода в монокристалле железа. Здесь распределение водорода оказалось практически равномерным (для отдельных точек отклонения не превышали ±0,01 см3 Н 2/100г металла, т.е. как и вероятностные ошибки самого метода, не превышало ±5% от среднего содержания водорода в монокристалле. Последнее было определено не только как среднее из 32-х локальных определений водорода в исследуемом монокристалле, но и путем определения методом плавления в потоке инертного газа на аппарате RH2 дублера изучаемого монокристалла, полученного в тех же условиях. Величина [ H ]ср составила 1,41 1/млн. Таким образом было установлено, что в бездефектном монокристалле железа водород, находящийся в диффузинно-способном состоянии, распределен равномерно. Он составляет подавляющую часть от всего водорода, находящегося в таком металле.
Совершенно иная картина наблюдалась в промышленных образцах железа и его сплавов.
1. В образцах, содержащих крупные оксидные и сульфидные включения отмечались пики массы 17,18 и 33, что свидетельствовало о растворении какой-то части водорода во включениях в форме H 2 O, ОН и SH.
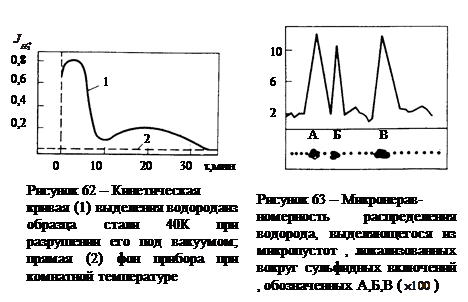
2. В тex же образцах наблюдались "пики" массы 2, превышающие в 4-10 раз средний уровень этой массы, характерный для данного образца (см. рис. 63), хотя объем включения и окружающей его микрополости не превышает долей процента от объема исследуемой лунки. Дело в том, что здесь коэффициент термического расширения сульфида MnS - FeS в интервале температур 25-1000 °С составляет: a¢=18,5×10–4 1/°С, т.е. почти в полтора раза выше, чем для металлической матрицы, где a¢¢= 12,5×10–4 1/°С.
3. Подобное явление еще ярче выражено в чугунах с глобулярным графиком, который практически не смачивается жидким металлом.
4. Многочисленные исследования автора показали ярко выраженную микронеравномерностъ распределения водорода в образцах аустенитных сталей. На границах первичных кристаллов содержание водорода в 2-3 раза выше среднего (см. рис. 64). Это, очевидно, связано с резким изменением растворимости водорода при переходе металла из жидкого состояния в твердое и с ликвацией водорода.
  |
5. Хотя и не столь резкое, но вполне заметное скопление водорода наблюдалось в составе газов, выделенных из участков, находящихся на границах вторичных кристаллов в ферритных и феррито-перлитных сталях. Очевидно, это связано с g-a превращением металла и со скачкообразным уменьшением при этом растворимости водорода в металле (см. рис. 65).
6.
  |
Резкие пики содержания водорода всегда наблюдались в участках микротрещин, микропор и т.д.
7. Ярко выраженная неравномерность распределения водорода наблюдалась в сварном шве и околошовной зоне (см. рис. 66).
Приведенные выше данные свидетельствуют о том, что в образцах сталей, охлажденных до комнатной и более низких температур, значительная часть водорода сохраняется в уже молизованном состоянии в различного рода ловушках, дефектах и пустотах.
Влияние водорода на механические свойства сталей при комнатных температурах и при температурах, необходимых для пластической деформации сталей многократно и тщательно исследовались [161, 171, 185]. Поэтому здесь лишь вкратце коснемся этой проблемы. В работе [185] особо рассматриваются данные, полученные на образцах с "невысокими" концентрациями водорода (5-8 см3/100г), достигнутыми, преимущественно путем катодного наводораживания, и данные, относящиеся к образцам сталей с "высоким" содержанием водорода (более 10 см3/100 г). В этом случае повышенное содержание водорода достигали путем длительной выдержки металла при высоких температурах в контакте с водородом, находящимся под высоким давлением. Многократные исследования показали, что при небольшом содержании водорода при температурах, близких к комнатным, водород не влияет на сопротивление металла пластической деформации, но резко уменьшает пластичность и сопротивление металла разрыву. Весьма характерным для этих образцов оказалось почти полное восстановление механических свойств металла, его пластичности и прочности после удаления водорода даже просто за счет выдержки при комнатной или при несколько повышенной температурах.
  |
При исследованиях механических свойств сталей, насыщенных до высоких концентраций водорода (10-30 см3/100 г металла) было установлено, что для большинства углеродистых и низколегированных сталей, после их наводораживания, наблюдается существенное снижение всех механических свойств: sS, sВ, d, y, ак и сопротивление пластической деформации. Это объясняется образованием в металле, при насыщении образцов водородом, множества микротрещин и других дефектов и скоплением в них молекулярного водорода, а также обезуглероживанием металла за счет образования метана, обладающего высоким давлением и способного вызывать микроразрушения металла и «водородное охрупчивание стали».
Таким образом, водород, остающийся в пересыщенном растворе в металле в атомарной форме или в виде протонов, часто является причиной ухудшения механических свойств металла, а молекулярный водород, выделенный в отдельную фазу, характеризует масштабы разрушений металла и образования микротрещин, дислокации, других нарушений сплошности металла и "ловушек" водорода [186].






