В практических условиях носителем водорода, определяющим его переход в жидкий металл в процессе плавки, является не молекулярный водород, а водяной пар, содержащийся в газовой фазе по тем или иным причинам. С другой стороны, десорбция водорода из металла в газовую фазу при вакуумировании или при обработке металла инертным газом является более чистым вариантом "распределения водорода" между контактирующими фазами (жидким металлом и газом).
В современных условиях как уже упомянутые, так и другие варианты удаления водорода из металла приобретают все большее распространение. Наконец, в результате большого количества очень хорошо поставленных исследований уже точно установлено, что для системы расплавленное железо-молекулярный водород процессы сорбции и десорбции водорода металлом проходят через одни и те же этапы, только в обратном порядке и направлении [158, 175, 176]. В связи с этим, ниже будут рассмотрены некоторые данные только о десорбции водорода расплавленным железом и некоторыми расплавами на его основе.
В настоящее время существуют две взаимоисключающие друг друга концепции, описывающие механизм переноса водорода из расплава в газовую фазу. Одна из них рассматривает в качестве лимитирующей стадии массоперенос атомов водорода из объема металла к поверхности контакта металла с газовой фазой (найдена даже энергия активации этого процесса ~24,5 кДж/моль). Другая считает ведущими процессы, происходящие на границе контакта металл-газ, т.е адсорбционно-кинетическое звено.
Первая из этих точек зрения базируется на общеизвестной, удобной, но недоказуемой физической модели, предусматривающей наличие в металле у поверхности неподвижного "диффузионного" или "ламинарного" слоя. Вторая концепция принимает схему, основанную на учете частоты смены отдельных микро-участков поверхностного слоя металла, контактирующего с газом. Кроме того, существует теория [203], согласно которой удаление водорода из металла, в зависимости от его концентрации и ряда других условий, может происходить в трех различных режимах: кинетическом, смешанном и диффузионном.
Многие исследователи считают, что в условиях, характерных для внепечной дегазации металла, лимитирующим звеном, определявшим скорость удаления водорода из металла, является его диффузия в расплаве. Однако эта точка зрения не всегда подтверждается получаемыми экспериментальными данными и современной прикладной формальной кинетикой. Вполне возможно, что различие существующих точек зрения на механизм удаления водорода обусловленно разнообразием применяемых методов исследования с присущими им недостатками. В связи с этим, ниже будут рассмотрены некоторые данные только о десорбции водорода расплавленным железом и некоторыми расплавами на его основе.
Проводя свои исследования, авторы учитывали общее положение о том, что процесс десорбции водорода из металла проходит через три последовательные стадии, поддающиеся количественной оценке:
1. Массоперенос водорода внутри металла к его поверхности;
2. Адсорбция атомов водорода на поверхности контакта металла с газовой фазой, молизация атомов водорода и десорбция его молекул с поверхности металла;
3. Массоперенос молекул водорода в газовой фазе.
Исследования проводились с помощью плавки металла во взвешенном состоянии с последующей "закалкой" образца в толстостенной изложнице. Каждый образец сначала насыщался водородом: во время предварительной выдержки он омывался газовой смесью Ar + H 2 [178]. Парциальное давление водорода строго удерживалось на заданном уровне в пределах 0,010-0,013 МПа, температура металла поддерживалась на уровне 1600 (±20) °С. Экспериментально было установлено, что при этих условиях для достижения полного равновесия распределения водорода между газовой фазой и металлом достаточно выдержки металла в течение ~300 се 

кунд. Таким образом, в зависимости от 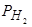 , исходная концентрация водорода в образцах составляла 7-8 1/млн.
, исходная концентрация водорода в образцах составляла 7-8 1/млн.
Лабораторная установка представлена на рис 57. Для исследования кинетики собственно процесса десорбции водорода переключением газовых кранов отключали источник водорода и реакционную трубку продували потоком аргона. При этом строго контролировали температуру металла, время выдержки образца и характеристики потока экстрагирующего газа: скорость, частоту пульсации, суммарное давление и среднюю температура в реакционной ампуле. Скорость десорбции водорода контролировалась двумя методами:
1. Путем определения остаточного содержания водорода в закаленных образцах. В этом случае применялись все известные и оправдавшие себя методы уменьшения потерь металлом водорода до его поступления в газоанализатор. Многократные опыты показали, что здесь теряется не более 5-6 % от исходного содержания водорода. Содержание водорода в металле определяли на установке RH2 фирмы LECO (чувствительность 0,01 1/млн, точность определения +0,1 1/млн воспроизводимость опытных данных ±10-15 %).
2. Путем непрерывного анализа, выходящего из реакционной ампулы газа с использованием термокондуктометрического датчика, выполненного на базе серийного катарометра Г-4З. Одновременно фиксировался и объем отходящего газа. Таким образом, фиксировали общее количество водорода, переходящего в газовую фазу и скорость его экстрагирования в различные моменты процесса десорбции.
Ниже вкратце приведены полученные результаты. При этом надо отметить, что они относятся к вполне конкретным условиям нахождения капель расплава, плавящихся в высокочастотном электромагнитном поле, омывающем их газовом потоке. Таким образом они не могут рассматриваться как общие, приемлемые для всех возможных случаев десорбции водорода из металла. В то же время, полезность полученных результатов заключается в том, что они количественные и достаточно точные.
Как уже отмечалось, процесс десорбции водорода из металла встречает общее сопротивление, складывающееся из суммы сопротивлении отдельных его стадий, т.е.
1/КS=1/Кж+1/Ка.к+1/Кr, (160)
где КS – наблюдаемая константа скорости процесса удаления водорода;
Кж – константа скорости массопереноса (водорода) в расплаве;
Ка.к – константа скорости адсорбционно-кинетической стадии процесса десорбции;
Кr – константа скорости массопереноса в газовой фазе.
В условиях описанных опытов сама плавка металла "в электромагнитном тигле" обеспечивает его интенсивное перемешивание и, как следствие этого, весьма малую толщину диффузионного слоя. Кроме того, коэффициент диффузии водорода в жидком металле при t =1600 °С очень высок, по крайней мере на 1-2 порядка выше, чем для других компонентов металла. Например, в работе [131] приводятся следующие значения Дн:
при 1600 °С Дн = (3,5I±0,04)×10–3 см2/c
при 1650 °С Дн =(3,71±0,05)×10-3 см2/с
при Дн=5,21×10–2 exp (1000±2000)/ РТ см2/с
Таким образом, коэффициент массопереноса водорода в капле металла, плавящейся в высокочастотном электромагнитном поле, β= D /d очень велик и предположение о "внутреннем массопереносе", как о ведущем звене процесса, маловероятно.
Экспериментальные данные, приведенные на рис. 58, показывают некоторую зависимость "остаточной" концентрации водорода в металле от температуры при постоянных исходном содержании водорода и всех прочих условиях опыта. Эти данные также отвергают предположение о нулевом порядке процесса десорбции водорода, т.к. здесь не соблюдаются необходимые для этого линейная зависимость [ H ] от t и постоянство V H при различных значениях t.
С другой стороны, если бы удаление водорода определялось его "внутренним массопереносом", то как и для реакций первого порядка, для него было бы справедливо выражение:
ln ([ H ]0/[ H ]t)=Kt (161)
(см. главу 2).

Как видно из рис. 59 а, этого не наблюдается для всех исследованных концентраций [H] и температур металла. Зато для всех исследованных температур: 1560, 1600 и 1650 °С обнаруживается линейная зависимость:
1/[ H ]t=Kt. (162)
Эта зависимость следует также из общеизвестной формулы, типичной для кинетики реакции второго порядка (см.главу 2).
1/[ H ]t–1/[ H ]0=Kt и d [ H ]t/ d t= –K[ H ]t2, (163)
где [ H ]0 и [ H ]t – исходная и соответствующая моменту времени t концентрации водорода в металле;
К – константа скорости процесса десорбции (зависящая от температуры).
 |
Учитывая, что величина 1/[ H ]0 известна для каждого опыта (постоянна), для реакции второго порядка следует ожидать линейную зависимость 1/[ H ]t от t, которая, как видно из рис. 59 б и имеет место на практике.
При десорбции водорода второй порядок реакции возможен в том случае, когда процесс лимитируется адсорбционно-кинетическим звеном, например реакцией молизации адсорбированного на поверхности металла водорода:
Н адс+ Н адс= Н 2газ
Во всем исследованном интервале температур (I500-I650° С) энергия активации процесса десорбции водорода составила I38-I70 кДж/моль, т.е. значительно выше, чем это наблюдается для процессов, лимитируемых "внутренним массопереносом".
Скорость адсорбционно-кинетитеского акта в значительной мере определяется способностью поверхностного слоя металла адсорбировать атомарный водород, находящиеся растворенным в металле. В настоящее время адсорбционная активность водорода в расплавах на основе железа изучена недостаточно, хотя отдельные работы были посвящены ее исследованию [176, 177]. Учитывая возможные неточности в количественных оценках адсорбционной активности водорода, можно все же утверждать, что она отчетливо проявляется в присутствии в сплавах железа поверхностно-активных компонентов [178]. Это подтверждается обнаруженным нами отчетливым отрицательным влиянием кислорода и серы на скорость десорбции водорода (см. рис. 60). Наиболее простым и надежным объяснением этого отрицательного влияния сильных поверхностно-активных компонентов на скорость десорбции водорода является положение об ограниченном числе в поверхностном слое металла активных центров, обеспечивающих адсорбцию. Когда какая-то часть этих центров оккупирована кислородом или серой, то уменьшает число таких центров доступных для водорода, что аналогично уменьшении поверхности контакта металла и газовой атмосферы и, следовательно, приводит к уменьшению скорости процесса десорбции водорода.
Таким образом, в условиях наших экспериментов адсорбционно-кинетическое звено имеет значительно большую вероятность играть ведущую роль в процессе десорбции водорода, чем внутренний массоперенос. Очевидно это положение применимо не только к таким, исследованным авторами ситуациям, когда имеется высокоразвитая поверхность контакта металл-газ. Например, в работе [177], где в лабораторных условиях исследовали десорбцию водорода при продувке железоуглеродистых расплавов инертным газом в 
тигле, также были найдены второй порядок реакции дегазации и зависимость константы скорости десорбции водорода от состава металла.
Для более полного выявления природы процесса удаления водорода из металла авторы исследовали также и 3-й этап этого процесса, т.е. массоперенос молекулярного водорода в газовой фазе. Было установлено, что скорость обдувающего металл аргона и частота пульсация этого газа оказывает значительное влияние на константу скорости десорбции водорода. Подтверждением этого служит рис. 61, демонстрирующий влияние скорости обтекания металлической капли инертным газом. Такое влияние имеет большое значение, т.к. хорошо известно, что реакции, скорость которых контролируется внешним массопереносом, протекают относительно быстро и состояние, близкое к равновесию, достигается за относительно короткое время[178].
Действительно, применение пульсирующего потока аргона для транспортирование металла в восходящем рукаве установки циркуляционного вакуумирования стали [68], привело к заметному понижению остаточной концентрации водорода в металле по сравнению с использованием обычного потока аргона при том же относительном расходе его. Таким образом, наши исследования подтверждают гипотезу, в соответствие с которой удаление водорода из расправленного металла может, в зависимости от его концентрации и ряда других условий, проходить в трех различных режимах: адсорбционно-кинетическом, диффузионном и смешанном.






