Термодинамика растворения водорода в железе и в большинстве расплавов на его основе имеет много общего с термодинамикой растворения азота в тех же расплавах. Прежде всего, многими исследователями, начиная с Сивертса твердо установлено, что для каждой заданной температуры растворимость водорода в железе и его сплавах пропорциональна корню квадратному из парциального давления водорода, т.е.
S H=K 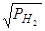 , (154)
, (154)
где К – функция температуры.
Справедливость закона "квадратного корня" по отношению к системе металл-водород определяет диссоциацию молекулярного водорода на атомы Н 2®2 Н как обязательное звено в процессе растворения водорода в металле и обязывает считать, что водород растворяется в атомарной форме или, возможно, в форме протонов Н +. Однако не исключается возможность растворения водорода в форме молекул гидридов некоторых компонентов исследуемых сплавов при обязательном условии, что в молекулах гидридов содержится лишь по одному атому водорода и " n " атомов металла, т.е. они имеют общую химическую формулу Me n Н.
Температурная зависимость растворимости водорода, например, в расплавленном железе определяется уравнением изохоры Вант-Гоффа. Если [ H ] – концентрация растворенного в металле водорода при его давлении в газообразной фазе 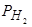 , то константа равновесия процесса растворения КН определяется:
, то константа равновесия процесса растворения КН определяется:
КН=[ H ]2/ 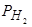 , (155)
, (155)
т.е. ln KH=2 ln [ H ]– ln 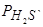 и при
и при 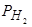 =1 (например 1 кг/см2, 1 ат или 0,1 Мпа) ln KH=2 ln [ H ] и, следовательно, dln КН/ dT =D Н / RT 2 или dln [ H ]/ dT =D Н / RT 2 При парциальном давлении водорода равном единице (например, 0,1 MПa) концентрацию растворенного водорода рассчитывают и обозначают его растворимостью S H. Поэтому, применительно к растворению водорода, уравнение Вант-Гоффа обычно записывается в виде:
=1 (например 1 кг/см2, 1 ат или 0,1 Мпа) ln KH=2 ln [ H ] и, следовательно, dln КН/ dT =D Н / RT 2 или dln [ H ]/ dT =D Н / RT 2 При парциальном давлении водорода равном единице (например, 0,1 MПa) концентрацию растворенного водорода рассчитывают и обозначают его растворимостью S H. Поэтому, применительно к растворению водорода, уравнение Вант-Гоффа обычно записывается в виде:
dlnS Н/ dT =D Н /2 RT 2. (156)
Таким образом, как и при растворении азота, характер растворимости водорода в металле определяется знаком энтальпии процесса сорбции водорода металлом.
В связи с высокой прочностью молекул Н 2, для процесса диссоциации Н 2=2 Н, и D Н дис>>0. Поскольку железо ни при каких температурах не образует гидридов,
SD Н S=D Н дис+D Н раст>0. (157)
Следовательно, как для жидкого железа, так и для всех его аллотропических модификаций, растворимость водорода заметно повышается с повышением температуры.
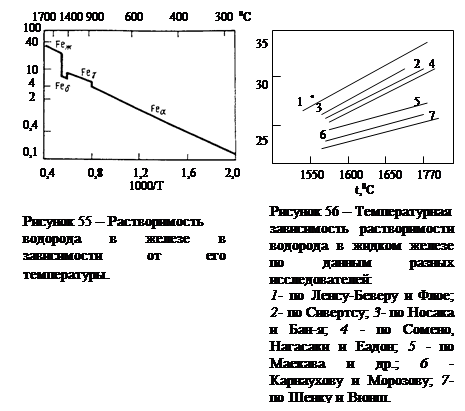
На рис. 55 приведена кривая, демонстрирующая зависимость растворимости водорода в железе от температуры. Подчеркиваем здесь имеющие весьма большое практическое значение резкие изменения растворимости водорода при температурах кристаллизации железа и при g-a-превращении. Следует отметить, что хотя характер зависимости растворимости водорода от температуры твердо установлен и не вызывает сомнений как для жидкого железа, так и для твердых модификаций его (d, g, a), абсолютные значения [% H ] или S H (при 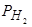 =1 кг/см2 или 0,1 МПа) при различных температурах по данным разных исследователей сильно отличаются (см. рис. 56) [162].
=1 кг/см2 или 0,1 МПа) при различных температурах по данным разных исследователей сильно отличаются (см. рис. 56) [162].
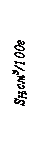
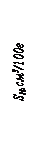
lg [% H ]= –1750/ T –1,677, (158)
а также
lgS H= –1750(±100)/ T +2,362(±0,068)+1/2 (159)
[175], где S H выражена в 1/млн и 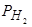 в кг/см2.
в кг/см2.
По данным, приведенным в работе [174], растворимость водорода в расплавленном железе постепенно повышается в соответствии с уравнениями (151) и (152) и им подобными. Однако при достижении температур, близких к точке кипения железа, характер процесса растворения изменяется. При этих температурах практически невозможно контролировать парциальное давление водорода, контактирующего с металлом вследствие резкого повышения интенсивности испарения железа. Измеряемое исследователем общее давление газа в «реакционной ячейке» слагается из  и Р Fe, а последнее резко возрастает в контакте с высоко нагретым металлом. Этому соответствует понижение объема водорода, переходящего в раствор в металле. Такой перелом хода псевдокривой растворимости водорода наблюдается [174] при t»2700 °C. В этом случае наблюдается полная аналогия с политермой растворимости азота в жидком железе (см. рис. 50 б).
и Р Fe, а последнее резко возрастает в контакте с высоко нагретым металлом. Этому соответствует понижение объема водорода, переходящего в раствор в металле. Такой перелом хода псевдокривой растворимости водорода наблюдается [174] при t»2700 °C. В этом случае наблюдается полная аналогия с политермой растворимости азота в жидком железе (см. рис. 50 б).
Описанный характер растворимости водорода в твердом и расплавленном железе присущ многим металлам, в которых растворяется атомарный водород (Cr, Mn, Ni, Co, Cu и др.) Однако существует широкий круг металлов, образующих гидриды - преимущественно при низких температурах (ниже 600-900 °С). Растворимость водорода в этих металлах, исследованная преимущественно в интервале температур 1000-25°С, значительно возрастает при понижении температуры и приближается к цифрам, определяемым стехиометрическими составами гидридов, т.е. на много порядков выше, чем для металлов первой группы. К таким металлам, образующим экзотермические растворы водорода (т.е.D Н <0) [173] относятся, например, Nb, V, Ti, Pd, Zr, Ce, La и др. Для металлургии стали, естественно, наибольший интерес представляет влияние концентраций легирующих металлов и примесных элементов на растворимость водорода в сплаве и активность водорода в этом сплаве. Эти данные получили широкое распространение [32, 33] и хорошо иллюстрируются таблицей 13 параметров взаимодействия  = dlgf H/ d [ R ] при 1600 °С.
= dlgf H/ d [ R ] при 1600 °С.
Таблица13 – Параметры взаимодействия первого порядка  для сплавов Fe-N
для сплавов Fe-N
| Элемент | 
| Элемент | 
| Элемент | 
|
| Al | +0,013 | Ge | +0,01 | Ni | - 0,002 |
| B | +0,05 | La | -0,027 | O | +2,5 |
| C | +0,06 | Mn | -0,0014 | P | +0,011 |
| Co | +0,0018 | Mo | +0,0022 | S | +0,008 |
| Cr | +0,0022 | Nb | -0,0023 | Si | +0,027 |
| Cu | +0,0005 | Nd | -0,038 | Ti | -0,019 |
| V | +0,0074 | W | +0,048 |
Таким образом, растворимость водорода в жидких сплавах W, Si, C, B, Al и железа особенно сильно понижает кислород, далее совсем незначительно понижают растворимость водорода Mo, S, P, Ce. Некоторые данные из этой таблицы нельзя считать точными. Прежде всего это касается влияния кислорода. Особый интерес для металлургов представляет изменение влияния компонентов металла на растворимость в нем водорода при понижении температуры металла. К сожалению, до сих пор этот вопрос малоизучен и в литературе нет данных о зависимостях  от температуры.
от температуры.






