При температурах, обычных для сталеплавильных процессов, молекулярный азот является относительно малоактивным газом. Именно это позволяет использовать его для "внепечной" продувки перед разливкой сталей, не очень чувствительных к содержанию в них азота. Накопленный промышленностью опыт говорит о том, что благотворное влияние механического перемешивания металла продуваемым азотом значительно опережает повышение его концентрации в стали и приближение к нежелательным значениям концентраций азота.
Однако для многих, чаще всего конвертерных низко-углеродистых марок стали, предназначенных для глубокой штамповки, холодного волочения и т.д. отрицательное влияние азота на пластические свойства металла весьма заметно. Например, для сталей, разливаемых на машинах непрерывной разливки, содержание азота по техническим условиям ограничивают значениями 0,002-0,003 %. Поэтому даже незначительная скорость перехода азота из атмосферного воздуха в металл при сливе его из конвертера в ковш имеет большое практическое значение, а вопросы кинетики растворения азота подлежат серьезному изучению.
Как в рассмотренном ранее случае растворения в металле кислорода при взаимодействии азота с металлом следует рассматривать 3 этапа:
1. Внешний массоперенос, определяемый составом, температурой и динамикой газовой среды;
2. Переход через границу раздела газ-металл, включающий в себя адсорбцию молекул азота, их диссоциацию и переход атомов азота через пограничный слой металла. На этом этапе процесса значительную роль, очевидно, играет также химическое взаимодействие азота с нитридообразующими компонентами в металле;
3. Массоперенос азота в объеме металла, определяемый его гидродинамикой (температурой, вязкостью, тепловым, гравитационным и другими силовыми полями).
Кинетика растворения азота в железе и его сплавах изучалась многими исследователями при температуре существования феррита и реже – в интервале температур, обычных для аустенита. Исследователи справедливо предполагали, что в изученном интервале температур ведущим звеном процесса являлся внутренний массоперенос, т.е. 3-й этап процесса. Это позволило вывести уравнение [167], характеризующее температурную зависимость коэффициента диффузии азота в железе. Также было установлено некоторое понижение значений D N для твердого железа при повышении в нем концентрации углерода, кремния и некоторых других элементов.
Кинетике растворения азота в жидком железе и его расплавах посвящено очень немного работ. В работе [166] было найдено, что энергия активации растворения азота в расплавленном железе составляет 40000-50000 кал/моль, т.е. 200-240 кДж/моль. Это, по мнению ее авторов, является доказательством ведущей роли третьего этапа, т.е. внутреннего массопереноса в процессе растворения азота.
Независимо от этой работы, автор на основании результатов исследований с применением "бестигельной плавки" [165,167] построил кинетические кривые поглощения азота жидким железом и некоторыми сплавами его с углеродом и кислородом.
Если скорость поглощения азота металлом определяется его внутренним массопереносом, то должно быть справедливо уравнение:
V N= d [% N ]/dt=K([ N ]S–[ N ]), (147)
где К – постоянная для данных условий опыта, равная
К=(F / V) (D N/d); (148)
F – поверхность и V – объем образца, подвергаемого контакту с азотом;
D N – коэффициент диффузии азота в неперемешиваемом (диффузионном) слое металла;
d – толщина диффузионного слоя, определяемая температурой и гидродинамикой металлического образца или капли.
Интегрирование выражения для V N дает:
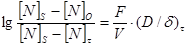 , (149)
, (149)
или, для данных размеров, температуры и химического состава образца и определенных условий перемешивания:
lg ([ N ]S–[ N ]0/[ N ]S–[ N ]t)= const t, (150)
где [ N ]S – концентрация азота в поверхностном слое металла, близкая к равновесию с газовой фазой;
[ N ]0 – концентрация азота в объеме металла, близкая к нулю в начале процесса перехода азота в металл;
[ N ]t – концентрация азота в объеме металла в момент времени t.
  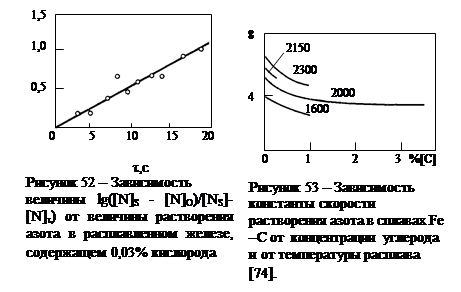 |
Например, как видно из рис. 52, экспериментальные данные для железа, содержащего 0,03 % [ O ] при t =1650 °C, полученные при плавлении его в индукционной печи или с помощью метода «бестигельной плавки», довольно хорошо ложатся на теоретически ожидаемую прямую линию.
Также было обнаружено [163, 167], что константа скорости процесса растворения азота: К=(F / V) (D /d) в расплавах железа понижается при t= const, но при различных концентрациях [ C ] и [ O ] (см. рис. 53 и 54). Это объяснялось отрицательным влиянием [ C ] и [ O ] на коэффициент диффузии азота в расплавах на основе железа.
Приведенные экспериментальные данные можно рассматривать как подтверждение предположения о ведущей роли третьего этапа, т.е. внутреннего массопереноса в процессе растворения азота в расплавах на основе железа. Однако никак нельзя обобщать и распространять этот вывод на все случаи практики.

 Очевидно правильно, что в подавляющем большинстве практических ситуаций первый этап процесса поглощения азота, т.е. внешний массоперенос не играет ведущей роли. В этом убеждают следующие рассуждения: при любых заданных аэродинамических условиях массоперенос молекул азота и кислорода в газовой фазе должен быть примерно одинаковыми. Однако многочисленные наблюдения говорят о том, что скорость сорбции азота из воздуха струёй расплавленного металла на 2-3 порядка ниже, чем скорость поглощения им кислорода, хотя парциальное давление азота в воздухе почти в 4 раза больше, чем кислорода. Если скорость поглощения металлом кислорода связана с аэродинамикой потока кислорода, контактирующего с металлом [48, 75, 138], то для азота такая связь не установлена. Следовательно, природа процессов сорбции кислорода и азота различна. Очевидно, что скорость растворения в металле азота определяется либо адсорбционно-кинетическим звеном процесса (второй этап), либо, как указано для лабораторных опытов с плавкой во взвешенном состоянии, – внутренним массопереносом.
Очевидно правильно, что в подавляющем большинстве практических ситуаций первый этап процесса поглощения азота, т.е. внешний массоперенос не играет ведущей роли. В этом убеждают следующие рассуждения: при любых заданных аэродинамических условиях массоперенос молекул азота и кислорода в газовой фазе должен быть примерно одинаковыми. Однако многочисленные наблюдения говорят о том, что скорость сорбции азота из воздуха струёй расплавленного металла на 2-3 порядка ниже, чем скорость поглощения им кислорода, хотя парциальное давление азота в воздухе почти в 4 раза больше, чем кислорода. Если скорость поглощения металлом кислорода связана с аэродинамикой потока кислорода, контактирующего с металлом [48, 75, 138], то для азота такая связь не установлена. Следовательно, природа процессов сорбции кислорода и азота различна. Очевидно, что скорость растворения в металле азота определяется либо адсорбционно-кинетическим звеном процесса (второй этап), либо, как указано для лабораторных опытов с плавкой во взвешенном состоянии, – внутренним массопереносом.
Особый интерес представляет адсорбционно-кинетическое звено процесса поглощения азота. С его помощью можно, в частности, объяснить и отмеченное выше понижение скорости сорбции азота при повышении концентрации кислорода в металле. Известно, что концентрация кислорода в металле практически не влияет на растворимость в нем азота, в то же время установлено [181], что концентрация кислорода в сплавах Fе - О при 1600 °С незначительно влияет на D N. При изменении [ O ] в пределах 0,006-0,07 % D N изменяется от 0,8×10–5 см2/с до 0,54×10–5 см2/с, т.е. только на 30-33 %. Все это позволяет допустить экспериментально трудно доказуемое, но пока что не опровергнутое предположение о том, что кислород, являясь сильным поверхностно-активным элементом, занимает значительную часть активных центров на поверхности металлического расплава и именно за счет этого значительно уменьшает скорость поглощения азота металлом. Важная роль адсорбционно-кинетического звена в процессе растворения азота в расплавленном металле иллюстрируется следующими примерами:
1. Еще в 1911 году (128) был обнаружен "активный" азот, представляющий собой смесь молекулярного азота N 2 и атомов азота являющихся продуктами разложения нитридов В, Ti, Mg, Ca и т.д., а также электрического разряда в газовых смесях. Обладая повышенным запасом энергии "активный азот" значительно быстрее растворяется в металлах, чем обычный молекулярный. Иногда активность азота сохраняется в течение десятков секунд.
2. Отмечено, что в условиях плазменной плавки и дуговой автоматической сварки [168] при наличии некоторого количества атомарного и даже ионизированного азота иногда наблюдается весьма активное поглощение его металлом.
3. В последние годы была тщательно проверена гипотеза о весьма высокой активности азота в состоянии "момента зарождения" при диссоциации в условиях электрической дуги таких соединений, как, например, NO, NH 2, NC. Растворимость такого "активизированного" азота пока не определена, но получено много данных, характеризующих повышенную скорость поглощения активизированного азота расплавленным металлом и его энергичное выделение при кристаллизации металла, иногда даже с его вспениванием или с образованием пузыристых слитков.
4. Авторы работы [169], отмечая высокую прочность молекулярного азота, одновременно указывают, что процесс его поглощения описывается кинетическим уравнением первого порядка по азоту. Они предположили, что сам акт растворения азота может происходить только при условии активации его молекул в контакте с поверхностью металла за счет взаимного соударения этих молекул. По их мнению процесс растворения азота протекает следующим образом: ½ N 2+½ N 2 и далее ½ N 2=[ N ], т.е. процесс имеет первый порядок по азоту, но его ведущим звеном является адсорбционно-кинетическое звено, а не внутренний массоперенос азота.
В зависимости от температуры и химического состава металла, растворенный в металле азот находится в атомарной форме или образует нитридоподобные группировки с растворенными в металле примесями или группировки с атомами самого растворителя – железа, содержащими многозарядные ионы азота. Во всех этих случаях формы существования азота в растворе не связаны с природой процесса активации азота в газовой фазе, т.е. в данном случае никакой "наследственности" не сохраняется. Это значит, что при наличии в газовой фазе активизированного азота увеличивается только скорость адсорбционно-кинетического звена процесса растворения азота, лимитирующее влияние этого звена на скорость растворения азота ослабевает или полностью устраняется, а скорость поглощения азота, во всяком случае на ранних этапах его сорбции (т.е. при далеких от равновесия с газовой фазой значениях) существенно возрастает. Таким образом, в зависимости от ряда обстоятельств, ведущим звеном процесса сорбции азота из газовой фазы расплавленным металлом является либо внутренний массоперенос, либо адсорбционно-кинетическое звено процесса.
В заключение следует такие отметить, что процессы поглощения и экстрагирования из металла азота не являются "обратимыми" и их скорости и степени их завершенности в отдельные зафиксированные моменты процессов адсорбции и десорбции азота далеко не одинаковы. Нами экспериментально остановлено, что отмеченное авторами работ [174, 175] равенство скоростей адсорбции и десорбции азота при постоянстве внешних условий (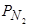 , t °C и состав металла) не достигается, имеется определенный "гистерезис" в случаях десорбции азота. Этот вопрос необходимо дополнительно тщательно исследовать. На практике, даже при совершенном варианте вакуумирования очень трудно обеспечить удаление азота до низких концентраций, поэтому вопросы о защите металла от контакта с азотом в процессе плавки, выпуска и разливки решаются гораздо чаще, чем вопросы извлечения из металла ранее растворившегося в нем азота.
, t °C и состав металла) не достигается, имеется определенный "гистерезис" в случаях десорбции азота. Этот вопрос необходимо дополнительно тщательно исследовать. На практике, даже при совершенном варианте вакуумирования очень трудно обеспечить удаление азота до низких концентраций, поэтому вопросы о защите металла от контакта с азотом в процессе плавки, выпуска и разливки решаются гораздо чаще, чем вопросы извлечения из металла ранее растворившегося в нем азота.
ГЛАВА 6






