| 1.Хімік визначає доброякісність води очищеної. Який реактив йому необхідно використовувати для виявлення домішки нітратів? A* розчин діфеніламіна B розчин барію хлориду C розчин кислоти сульфосалицилової D розчин амонію оксалату E розчин срібла нітрату | Нітрати. Не більше 0.00002 %. 5 мл субстанції поміщають у пробірку, занурену в льодяну баню, додають 0.4 мл розчину 100 г/л калію хлориду, 0.1 мл розчину дифеніламіну і краплями, при пере- мішуванні, 5 мл кислоти сірчаної, вільної від азоту.Потім пробірку переносять у водяну баню, нагрітудо температури 50 °С; через 15 хв блакитне забарвлення випробовуваного розчину має бути не інтен- сивнішим за забарвлення еталона, приготованого паралельно з випробовуваним розчином із використанням суміші 4.5 мл води, вільної від нітратів, Р і 0.5 мл еталонного розчину нітрату. ДФУ 1.4, с. 390 |
| 2. Провізор-аналітик аптеки проводить аналіз води очищеної. для цього певну кількість досліджуваного зразка він доводить до кипіння, додає 0,02 М розчин калію перманганату і кислоту сірчану розведену. Після кип'ятіння отриманого розчину протягом 5 хвилин рожеве забарвлення повинне зберігатися. Яку домішку визначав провізор-аналітик? A * речовини, що окиснюються B діоксид вуглецю C нітрати D сульфати E важкі метали | Визначали домішку речовин, що окислюються. ДФУ 1.4, с. 390 |
| 3. На аналіз надійшов зразок води очищеної з аптеки. За допомогою якого реактиву можна виявити в ньому наявність важких металів? A * тіоцетаміда B 2,6-діхлорфеніліндофенола C натрію нітропрусиду D нінгідрину E тіосемікарбазида | Важкі метали (2.4.8. метод А). Не більше 0.00001 %. До 200 мл субстанції додають 0.15 мл 0.1 М розчину кислоти азотної та випарюють у скляній випарювальній чашці на водяній бані до об'єму 20 мл. До 1 2 мл водного розчину, додають 2 мл буферного розчину рН 3,5 і перемішують. Одержану суміш лодають до 1,2 мл реактиву тіоацетаміду і негайно перемішують. Паралельно за тих самих умов готують еталон, використовуючи замість 12 мл випробовуваного розчину суміш 10 мл еталонного розчину свинцю і 2 мл випробовуваного розчину. Готують холостий розчин, використовуючи суміш 10 мл води і 2 мл випробовуваного розчину. Порівняно з холостим розчином еталон повинен мати світло-коричневе забарвлення. Через 2 хв коричневе забарвлення випробовуваного розчину має бути не інтенсивнішим за забарвлення еталона. ДФУ 1.0, с. 78 ДФУ 1.4, с. 390 |
. Неорганічні ЛЗ, що вміщують галогени.
| 1.В контрольно-аналітичну лабораторію надійшов ЛЗ кальцію хлорид. Вкажіть, який титрований розчин необхідно використати для його кількісного визначення: A * натрію едетат B калію бромат C кислота хлороводнева D калію перманганат E натрію гідроксид | Комлексонометрія, пряме титрування, титрований розчин – натрію едетат, індикатор – кальконкарбонова кислота, s=1:
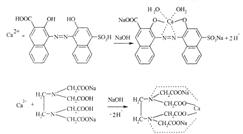

|
| 2. Виберіть лікарську речовину, кількісне визначення якої за ДФУ здійснюється методом ацидиметрії в неводному середовищі: A *Натрію фторид B Кислота аскорбінова C Цефалексин D Кальцію хлорид E Фенол | Натрію фторид кількісно визначають за допомогою методу ацидиметрії в неводному середовищі, титрант – кислота хлорна, індикатор – кристалічний фіолетовий, s=1: NaF + HClO4 → NaClO4 + HF |
| 3. Бромід-йон в лікарських засобах “Natrii bromidum” і “Kalii bromidum” ідентифікують з наступним реактивом A *нітратом срібла B нітратом свинцю C нітратом натрію D нітритом натрію E нітратом кальцію | Бромід-іон ідентифікують за допомогою реактиву нітрату срібла в середовищі розведеної нітратної кислоти. При цьому утворюється жовтуватий осад, який повільно розчиняється в розчині аміаку: AgNO3 + Br- → AgBr↓ + NO3- AgBr↓ + 2NH4OH → [Ag(NH3)2]Br + 2H2O |
| 4. Провізор-аналітик досліджує субстанцію йоду. Який титрований розчин ДФУ рекомендує для його кількісного визначення? A * натрію тіосульфат B кислота хлористоводнева C натрію гідроксид D калію бромат E натрію едетат | Йод кількісно визначають за допомогою прямого титрування його натрію тіосульфатом, індикатор –крохмаль, s=1/2: I2 + Na2S2O3 → 2NaI + Na2S4O6 |
| 5. Провізору-аналітику необхідно зробити висновок про якість приготування 3% розчину натрію броміду. Кількісне визначення мікстури проведено рефрактометрично. Розрахувати кількість натрію броміду в цьому випадку можна визначивши значення: A *показника заломлення B питомого показника поглинання C оптичної щільності розчину D в'язкості розчину E рН-розчину | За допомогою рефрактометру визначають показник заломлення. Концентрацію речовини обчислюють за формулою: X = (n-n0)/F, де Х – концентрація розчину; n – показник заломлення розчину; n0 – показник заломлення розчинника при тій самій температурі; F – фактор, що дорівнює величині приросту показника заломлення при збільшенні концентрації на 1%. |
| 6. Тотожність кислоти хлороводневої визначають за запахом вільного хлору який виділиться при нагріванні ЛЗ з: A *MnO2 B BaCl2 C NaOH D NaNO3 E CuSO4 | При нагріванні кислоти хлористоводневої з мангану діоксидом виділяється вільний хлор, який визначають за запахом: 4HCl + MnO2 → Cl2↑ + MnCl2 + 2H2O |
| 7. Кількісне визначення кислоти хлороводневої проводять за методом: A *алкаліметрії B нітритометрії C ацидіметрії D комплексонометрії E перманганатометрії | Кислоту хлористоводневу кількісно визначають за допомогою методу алкаліметрії, прямого титрування, індикатор – метиловий червоний, s=1: HCl + NaOH → NaCl + H2O |
| 8. Яка з ЛР з винною кислотою в присутності натрію ацетату утворює білий осад, розчинний в лугах та мінеральних кислотах? A * Калію хлорид; B Натрію хлорид; C Литию карбонат; D Натрію йодид; E Натрію бромід | Солі калію з розчином винної кислоти при охолодженні утворюють білий кристалічний осад:

|
| 9. Хлорне вапно ідентифікують за катіоном кальцію після кип’ятіння з ацетатною кислотою до повного усунення активного хлору з наступним реактивом: A *амонію оксалатом B магнію сульфатом C калію хлоридом D натрію нітритом E амонію молібдатом | Іон кальцію відкривають розчином амонію оксалату за утворенням білого осаду, нерозчинного у кислоті оцтовій розведеній і розчині аміаку, розчинного у розведених мінеральних кислотах: Ca2+ + (NH4)2C2O4 → CaC2O4↓ + 2NH4+ |
| 10. Кількісне визначення активного хлору у хлорному вапні проводять методом A *йодометрії B алкаліметрії C броматометрії D цериметрії E перманганатометрії | Вміст активного хлору у хлорному вапні визначають за допомогою методу йодометрії, титруванням за замісником, індикатор – крохмаль, s=: CaOCl2 + 2HCl + 2KI → I2 + 2KCl + CaCl2 + H2O I2 + Na2S2O3 → 2NaI + Na2S4O6 |
. Неорганічні ЛЗ, що вміщують оксиген.
| 1.Ідентифікацію розчину магнію пероксиду проводять за допомогою утворення надхромових кислот. Яке забарвлення при цьому з’являється? A * синє B червоне C зелене D чорне E жовте | У реакції утворення надхромових кислот магнію пероксид утворює синє забарвлення:
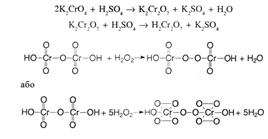
|
| 2. Провізору-аналітику на аналіз надійшла субстанція водню пероксиду. Кількісне визначення цього ЛЗ він повинен виконати перманганатометрично. До появи якого забарвлення розчину проводиться титрування згідно АНД? A *Рожевого B Зеленого C Жовтого D Синього E Безбарвного | Водню пероксид кількісно визначають за допомогою методу перманганатометрії, прямого титрування, титрують до появи рожевого забарвлення розчину, s=2,5: 5H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O |
| 3. Відповідно до АНД кількісне визначення розчину пероксиду водню проводять методом: A *перманганатометрії B аргентометрії C комплексонометрії D ацидиметрії E алкаліметрії | Водню пероксид кількісно визначають за допомогою методу перманганатометрії, прямого титрування, без індикатору, s=2,5: 5H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O |
| 4. Для кількісного визначення розчину гідрогену пероксиду можна використати наступний метод: A *йодометрії B нітритометрії C меркуриметрії D аргентометрії E комплексонометрія | Водню пероксид кількісно можна визначати за допомогою методу йодометрії, титрування за замісником, індикатор - крохмаль, s=1/5: 2KMnO4 + 10KI + 8H2SO4 → 2MnSO4 + 6K2SO4 + 5I2 + 8H2O I2 + Na2S2O3 → 2NaI + Na2S4O6 |
| 5. Провізор-аналітик досліджує розчин пероксиду водню 3%. Який реактив ДФУрекомендує для його ідентифікації? A * калію хромат B натрію хлорид C магнію сульфат D кальцію хлорид E цинку оксид | Для ідентифікації водню пероксиду ДФУ рекомендує використовувати калію хромат:
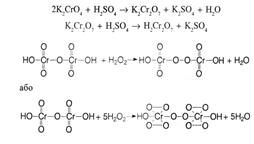
|
| 6. Ідентифікацію магнію пероксиду проводять за допомогою реакції утворення надхромових кислот. Яке забарвлення при цьому спостерігається? A *Синє B Червоне C Зелене D Чорне E Жовте | У реакції утворення надхромових кислот магнію пероксид утворює синє забарвлення:

|
| 7. Сечовину в розчині гідропериту ідентифікують за допомогою біуретової реакції. Яке забарвлення при цьому з'являється? A *Фіолетове B Зелене C Блакитне D Жовте E Чорне | Сечовину в розчині гідропериту відкривають за допомогою біуретової реакції – з'являється фіолетове забарвлення:
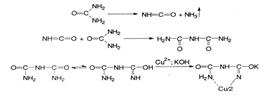
|






