Свойства разбавленных растворов неэлектролитов
Задача 1. Вычислить величину осмотического давления раствора, в 1 л которого содержится 0,2 моля неэлектролита, если температура равна 170С.
Решение:
При выражении объёма в литрах уравнение Менделеева-Клапейрона для осмотического давления будет иметь вид Росм = 103СмRT.

Ответ: 482,2 кПа
Задача 2. Определить массу глюкозы С6Н12О6, которую должен содержать 1 л раствора, чтобы быть изотоничным раствору, содержащему в 1л 9,2 г глицерина С3Н8О3.
Решение: Определим молярную концентрацию глицерина
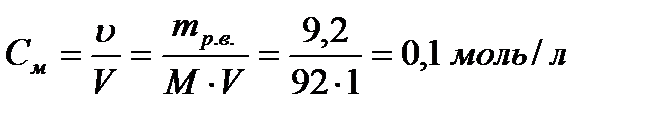
Так как по условию растворы изотонические, токонцентрация глюкозы должна быть равна 0,1 моль/л. Следовательно, m(C6H12O6)=180∙0,1=18г. Ответ: 18г
Задача 3. Требуется вычислить давление пара раствора, содержащего при 200С 0,2 моля сахара в 450 г воды. Давление водяного пара при этой температуре равно 2332,75 Па.
Решение: Найдём число молей растворителя: νводы= 450: 18 = 25 (моль)
Подставляем известные величины в формулу
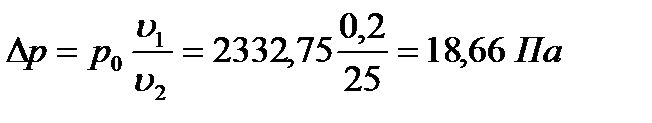
Тогда, давление пара раствора р = р0 – ∆р =2332,75–18,66 =2314,1 П
Ответ: 2314,1 Па
Задача 4. Вычислить температуру замерзания раствора, содержащего 44 г глюкозы С6Н12О6 в 0,2 кг воды. Криоскопическая константа воды равна 1,860При решении подобных задач использовать табличные данные из справочников.
Решение:
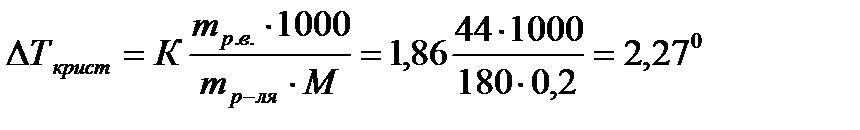
Тогда, Ткрис = –2,270
Ответ: – 2,270
Задача 5. При растворении 2,626г фенола С6Н5ОН в 100г этилового спирта температура кипения повысилась на 0,3240. Э = 1,160. Вычислить молярную массу фенола.
Решение: Подставим известные величины в формулу:
 Ответ: 94 г/моль
Ответ: 94 г/моль
Задача 6. При растворении 2,626г фенола С6Н5ОН в 100г этилового спирта температура кипения повысилась на 0,3240. Вычислить молярную массу фенола.
| Решение: | |||||||||
| Подставим известные величины в формулу: | |||||||||
| M = | Э ×1000× mр . в | = | 1,16 ×1000× 626 | = 94 г / моль | |||||
| D Т | кип × mр - ля | 0,324 ×100 | |||||||
Ответ: 94г/моль
Вопросы для самоконтроля
- Можно ли считать растворы механическими смесями? Почему?
- Являются ли растворы химическими соединениями? Почему?
- Почему процесс растворения является эндотермическим процессом?
- Объясните, в чём сущность процесса растворения.
- Что называется концентрацией раствора?
6. В чем заключается явление осмоса?
7. По какой формуле вычисляется осмотическое давление?
8. Какие растворы называются изотоническими?
9. Чем отличается давление пара раствора от давления пора чистого растворителя?
10. В чем отличие температур замерзания и кипения растворов неэлектролитов от тех же величин для чистых растворителей?
Варианты контрольных заданий
Вариант 1
1. Какой из компонентов раствора следует считать растворителем?
2. В 500 мл воды растворено 35,3 г сульфата натрия. Вычислите массовую долю (%) соли в растворе и молярную концентрацию эквивалентов сульфата натрия в приготовленном растворе.
3. Сформулируйте 2 – й закон Рауля.
Сколько граммов этиленгликоля С2Н4(ОН)2 необходимо прибавить на 1 кг воды для приготовления антифриза с температурой замерзания -15оС?
Вариант 2
1. Что такое молярная концентрация вещества в растворе?
2. Вычислите молярную концентрацию и молярную концентрацию эквивалентов серной кислоты в растворе с массовой долей Н2SO4 4%. Плотность раствора равна 1,032 г/мл.
3. Вычислите массовую долю сахарозы С12Н22О11 в растворе, температура кипения которого равна 100,13оС. Эбулиоскопическая константа воды 0,52о.
Вариант 3
1. Что такое молярная концентрация эквивалентов вещества в растворе?
2. Сколько граммов карбоната кальция требуется для приготовления 2 литров раствора с массовой долей вещества 10%? Плотность раствора равна 1,09 г/мл. Вычислите молярную концентрацию эквивалентов и молярную концентрацию карбоната калия в этом растворе.
3. В 200 г воды растворено:
а) 31 г мочевины СО(NH2); б) 90 г глюкозы.
Расчётами покажите, будут ли температуры кипения растворов одинаковы?
Вариант 4
1. Что такое молярная доля растворенного вещества А в растворе
2. Массовая доля фосфорной кислоты в растворе составляет 20%. Вычислите массовую долю и молярную концентрацию эквивалентов фосфорной кислоты в этом растворе
3. Вычислите молярную массу тростникового сахара, если его водный раствор, содержащий 3,42 г сахара в 100 г воды, замерзает при температуре - 0,186оС. Криоскопическая константа воды равна 1,86о.
Вариант 5
1. Что такое моляльная концентрация вещества в растворе?
2. Сколько граммов хлорида кальция необходимо для приготовления 0,5 л раствора с массовой долей этого вещества 10%. Плотность раствора равна 1,18 г/мл.
3. Водный раствор сахарозы С12Н22О11 кипит при температуре 100,13оС. Эбулиоскопическая константа воды равна 0,52о. Сколько граммов сахарозы содержится в 0,5 кг этого раствора?
Вариант 6
1. Можно ли считать растворы механическими смесями? Почему?
2. Какой объём раствора серной кислоты с массовой долей Н2SO4 96%, плотностью 1,84 г/мл, потребуется для приготовления 0,5 л раствора с молярной концентрацией эквивалентов Н2SO4 2моль/л. Чему равна молярная концентрация и мольная доля серной кислоты в приготовленном растворе?
3. При какой температуре будет замерзать водный раствор глицерина С3Н5(ОН)3 с массовой долей его 15%? Криоскопическая константа воды 1,86о. Вычислите температуру кипения этого раствора.
Вариант 7
1. Что такое молярность, нормальность, моляльность раствора?
2. Сколько воды и кристаллической соды Na2CO3· 10H2O необходимо взять для приготовления 100 мл раствора с массовой долей Na2CO3 0,5%. Плотность раствора 1,019 г/мл. Вычислите молярную концентрацию эквивалентов, моляльную концентрацию и молярную долю карбоната натрия в приготовленном растворе.
3. Водный раствор сахарозы С12Н22О11 кипит при температуре 100,13оС. Эбулиоскопическая константа воды равна 0,52о. Сколько граммов сахарозы содержится в 1 кг этого раствора?
Вариант8
1. Дайте определение понятию «массовая доля».
2. Вычислите молярную концентрацию и молярную концентрацию эквивалентов фосфорной кислоты в растворе с массовой долей кислоты 30%. Плотность раствора 1,180 г/мл.
3. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды равна -0,558оС. Вычислите молярную массу растворенного вещества.
Вариант 9
1. Какова зависимость между объёмами и нормальностями растворов, реагирующих без остатка?
2. Молярная концентрация эквивалентов раствора гидроксида бария равна 0,02 моль/л, плотность раствора - 1,07 г/мл. Вычислите молярную и моляльную концентрации гидроксида бария, а также массовую и мольную доли его в растворе.
3. При растворении 6,8 г вещества в 400 мл воды получен раствор с температурой замерзания, равной -0,93оС. Определите молярную массу растворённого вещества.
Вариант 10
1. Что называется титром раствора?
2. Плотность раствора хлорида алюминия с массовой долей его 16% равна 1,149 г/мл. Вычислите молярную концентрацию, моляльную концентрацию и молярную концентрацию эквивалентов хлорида алюминия в этом растворе. Какая масса его содержится в 1 л данного раствора?
3. Для приготовления антифриза к 30 л воды добавлено 9 л глицерина С3Н5(ОН)3 с плотностью 1,26 г/мл. Чему равна температура замерзания приготовленного антифриза?
Вариант 11
1. Что называется осмотическим давлением?
2. В 200 мл раствора сульфата калия содержится 2,74 г растворённого вещества. Вычислите моляльную и молярную концентрации, а также молярную концентрацию эквивалентов сульфата калия в этом растворе.
3. Определите, какой из двух растворов будет замерзать при более низкой температуре: а) раствор этилового спирта с массовой долей спирта 1%; б) раствор глицерина С3Н5(ОН)3 с массовой долей его 105? Насколько градусов отличаются температуры замерзания данных растворов?
Вариант 12
1. Как вычислить молярную массу растворенного неэлектролита, зная осмотическое давление его раствора?
2. Сколько граммов медного купороса CuSO4· 5H2O необходимо добавить к 270 г воды¸ чтобы приготовить раствор сульфата меди с массовой долей его10%? Вычислите моляльную и молярную концентрации, молярную концентрацию эквивалентов сульфата меди в приготовленном растворе. Плотность раствора равна 1,107 г/мл.
3. В 1000 г воды растворено 90 г вещества. Температура кипения этого раствора выше температуры кипения воды на 0,258оС. Эбулиоскопическая константа воды равна 0,516оС. Вычислите молярную массу растворённого вещества.
Вариант 13
1. Приведите различные формулировки I закона Рауля и его математические выражения.
2. Рассчитайте массу хлорида калия, которую необходимо растворить в 100 г воды, чтобы получить 10.5 % раствор данной соли. Ответ: 11.7 г
3. Вычислить осмотическое давление раствора сахара С12Н22О11, если 1 л раствора содержит 85,5 г растворенного вещества, а температура равна 170 С. Ответ: 602,8 кПа.
Вариант 14
1. Приведите формулировки и математические выражения II закона Рауля.
2. Рассчитайте массу иодида калия, необходимую для приготовления 30 мл 40 % водного раствора этой соли плотностью 1.395 г / см3. Ответ:16.74 г.
3. Раствор содержит в 1 л 0,4 моля неэлектролита. Вычислить осмотическое давление раствора при 270С. Ответ: 999,7 кПа.
Вариант 15
1. Каков физический смысл криоскопической и эбуллиоскопической констант растворителя?
2. В 10 мл 20 % раствора содержится 2.8 г растворенного вещества. Рассчитайте плотность такого раствора. Ответ: 1.4 г / см3
3. Вычислить, при какой температуре осмотическое давление раствора, содержащего 45 г глюкозы в 1 л, достигнет 656,8 кПа. Ответ: 316К.
Вариант 16
1. Как вычислить молярную массу неэлектролита с помощью криоскопии и эбуллиоскопии?
2. Водный раствор аммиака плотностью 0.904 г / см3 содержит 26 % аммиака. Рассчитайте молярнуюконцентрациюаммиакавэтомрастворе. Ответ: 13.8 моль / л.
3. Сколько граммов глюкозы содержится в 0,2 л раствора, осмотическое давление которого при 370С составляет 810,6 кПа? Ответ: 11,3 г.
Вариант 17
1. Какие растворы называются изотоническими?
2. Рассчитайте массу хлорида бария, которая содержится в 200 мл 0.2 М раствора этой соли. Ответ: 8.32 г.
3. Осмотическое давление раствора, в 0,25 л которого содержится 0,66 г мочевины, равно 111439 Па при 330С. Вычислить молярную массу мочевины. Ответ: 60,3 г/моль.
Вариант 18
1. Чем отличается давление пара раствора от давления пора чистого растворителя?
2. Рассчитайте массу воды и нитрата натрия, которые необходимы для приготовления 500 г раствора с моляльной концентрацией 0.1 моль / кг.Ответ: 4.2 г NaNO3; 495.8 г H2O
3. Раствор, содержащий при 270С 7,4 г глюкозы в 1 л, изотоничен раствору мочевины СО(NH2)2.Сколько граммов мочевины содержит 1 л раствора? Ответ: 2,47 г.
Вариант 19
1. В чем отличие температур замерзания и кипения растворов неэлектролитов от тех же величин для чистых растворителей?
2. Водный раствор уксусной кислоты приготовлен смешиванием 60 г ледяной уксусной кислоты и 90 г воды и имеет плотность 1.05 г / см3. Рассчитайте массовую и молярную доли уксусной кислоты в растворе, молярную и моляльную концентрации раствора и его титр.Ответ: 40 % масс.; 16.7 % мол.; 7.0 моль / л; 11.1 моль / кг; 20 г / л.
3. При какой температуре должен находиться раствор, содержащий 0,42 молянеэлектролита в 1 л, чтобы быть изотоничным раствору, содержащему при 200С 6,4 г метилового спирта в 0,5 л раствора? Ответ: 60С.
Вариант 20
1. Каков физический смысл эбуллиоскопической константы растворителя?
2. Рассчитайте молярность, моляльность и молярную долю сульфата аммония в водном растворе плотностью 1.06 г / см3 и концентрацией 12 % (масс.).
Ответ: 0.96 моль / л; 1.03 моль / кг; 1.83 % мол.
3. Давление водяного пара при 250С составляет 3167,2 Па. Вычислить для той же температуры давление пара раствора, в 468 г которого содержится 18 г глюкозы С6Н12О6. Ответ: 3154,5 кПа
Вариант 21
1. Какой из компонентов раствора следует считать растворенным веществом.?
2. Изотонический раствор содержит 8.5 г / л хлорида натрия и имеет плотность 1.01 г / см3. Рассчитайте молярную и моляльную концентрации этого раствора, а также массовую и молярную доли хлорида натрия в нем.Ответ: 0.145 моль / л; 0.145 моль / кг; 0.84 % масс.; 0.26 % мол.
3. Давление пара воды при 200С составляет 2338,1Па. Сколько граммов сахара С12Н22О11 следует растворить в 710 г воды для получения раствора, давление пара которого на 18,66 Па ниже давления пара воды? Ответ: 109,3 г.
Вариант 22
1. От каких факторов зависит растворимость веществ?
2. Рассчитайте массовую и молярную доли, моляльную концентрацию и титр 12.2 М водного раствора азотной кислоты плотностью 1.35 г / см3.Ответ: 56.9 % масс.; 27.4 % мол.; 21.0 моль / кг; 769 г / л.
3. Вычислить давление пара 10 %-го водного раствора сахара при 1000С. Ответ: 100,73 кПа.
Вариант 23
1.Зависимость растворимости от природы веществ?
2. Определить молекулярную массу анилина, если при 300С давление пара раствора, содержащего 3,08 г анилина в 370 г эфира, равно 85792 Па, а давление пара растворителя при той же температуре составляет 86365 Па. Ответ: 93.
3. Вычислить, при какой температуре осмотическое давление раствора, содержащего 45 г глюкозы в 1 л, достигнет 656,8 кПа. Ответ: 316К.
Вариант 24
1. По какой формуле вычисляется осмотическое давление?
2. Образец высокочистого селена содержит 4 . 10-4 % (молярных) кальция. Рассчитайте массовую долю кальция в высокочистом селене и число атомов кальция, содержащихся в 1 мг селена. Ответ: 2 . 10-4 % масс.; 6 . 1013 атомов.
3. При 280С давление водяного пара составляет 3780 Па. Насколько понизится давление пара при той же температуре, если в 340 г воды растворить 54 г глюкозы? Ответ: 56,7 Па
Вариант 25
1. В чем заключается явление осмоса?
2. Рассчитайте массовую долю сахарозы C12H22O11 в растворе, в котором на каждую молекулу сахарозы приходится 30 молекул воды. Ответ: 8.8 % масс.
3. Вычислить, на сколько градусов понизится температура замерзания бензола, если в 50 г его растворить 1,5 г нафталина С10Н8. Ответ: 0,50С.
Вариант 26
1. Что называется концентрацией раствора?
2. Рассчитайте объем 96 % раствора серной кислоты (плотность 1.84 г / см3), необходимый для приготовления 490 мл 0.25 М раствора серной кислоты путем смешивания исходного раствора с водой. Ответ: 6.80 мл.
3. Раствор, содержащий 6,15 г растворенного вещества в 150 г воды, замерзает при −0,930С. Определить молярную массу растворенного вещества. Ответ: 82 г/моль.
Вариант 27
1. Объясните, в чём сущность процесса растворения.
2. Определите молярную концентрацию водного раствора карбоната натрия, полученного смешиванием 1.0 л 4 % раствора карбоната натрия (плотность 1.04 г / см3) и 1.0 л 16 % раствора карбоната натрия (плотность 1.17 г / см3). Полученный раствор имеет плотность 1.11 г / см3. Ответ: 1.08 моль / л.
3. Раствор, содержащий при 270С 7,4 г глюкозы в 1 л, изотоничен раствору мочевины СО(NH2)2.Сколько граммов мочевины содержит 1 л раствора? Ответ: 2,47 г.
Вариант 28
1. Почему процесс растворения является эндотермическим процессом?
2. Рассчитайте объем воды, который необходимо прилить к 100 мл 29 % раствора аммиака плотностью 0.90 г / см3, чтобы получить 10 % раствор аммиака Ответ: 171 мл.
3. Раствор, содержащий 2.5 г фенола С6Н5ОН в 91 г бензола, замерзает при 3,80С. Вычислить криоскопическую константу бензола, зная, что чистый бензол замерзает при 5,50С. Ответ: 5,20.
Вариант 29
1. Являются ли растворы химическими соединениями? Почему?
2. Рассчитайте массовую долю хлороводорода в растворе, полученном смешиванием одного объема 39 % соляной кислоты плотностью 1.20 г / см3 и трех объемов воды. Ответ: 11 %
3. При растворении 0,029 моля неэлектролита в 100 г ацетона температура кипения последнего повысилась на 0,430. Вычислить эбулиоскопическую константу ацетона. Ответ: 1.480.
Вариант 30
1. Можно ли считать растворы механическими смесями? Почему?
2. Рассчитайте массу воды, которую необходимо прилить к 200 мл 20 % раствора серной кислоты плотностью 1.14 г / см3 для получения 5 % раствора этой кислоты.Ответ: 684 г.
3. Сколько граммов глюкозы содержится в 0,2 л раствора, осмотическое давление которого при 370С составляет 810,6 кПа? Ответ: 11,3 г.






