Задача1. Расчет массовой доли, молярной концентрации и молярной концентрации эквивалента раствора.
Определите массовую долю, молярную концентрацию и молярную концентрацию эквивалента раствора, полученного при смешении 200 мл 2М раствора серной кислоты (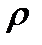 =1,18 г/мл) и 200 мл 8% раствора серной кислоты (
=1,18 г/мл) и 200 мл 8% раствора серной кислоты (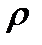 =1,05 г/мл).
=1,05 г/мл).
Решение: Рассчитаем массу первого раствора и массу серной кислоты в нем: m(р-ра)1= 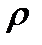 (р-ра)1 . V(р-ра)1=1,18 . 200=236 (г);
(р-ра)1 . V(р-ра)1=1,18 . 200=236 (г);
m(H2SO4)1 = 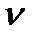 (H2SO4) . M(H2SO4)=c(H2SO4) . V(р-ра)1 . М(H2SO4)=
(H2SO4) . M(H2SO4)=c(H2SO4) . V(р-ра)1 . М(H2SO4)=
=2 . 0,2 . 98=39,2(г);
Масса второго раствора и масса серной кислоты в нем равны
m(р-ра)2 = 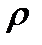 (р-ра)2 . V(р-ра)2 = 1,05 . 200=210 (г);
(р-ра)2 . V(р-ра)2 = 1,05 . 200=210 (г);
m(H2SO4)2 = m(р-ра)2 . 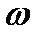 (H2SO4)=210 .0,08 =16,8 (г).
(H2SO4)=210 .0,08 =16,8 (г).
Массовую долю полученного раствора рассчитываем по формуле:
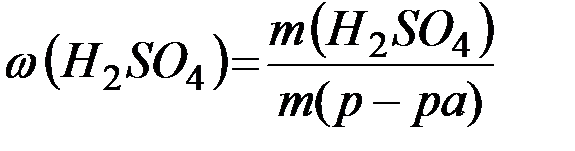 =
= 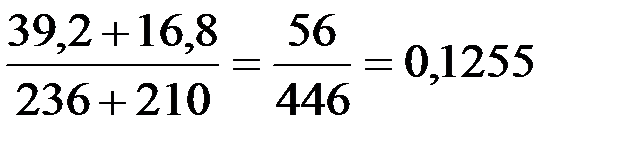 (12,6%)
(12,6%)
Молярная концентрация раствора
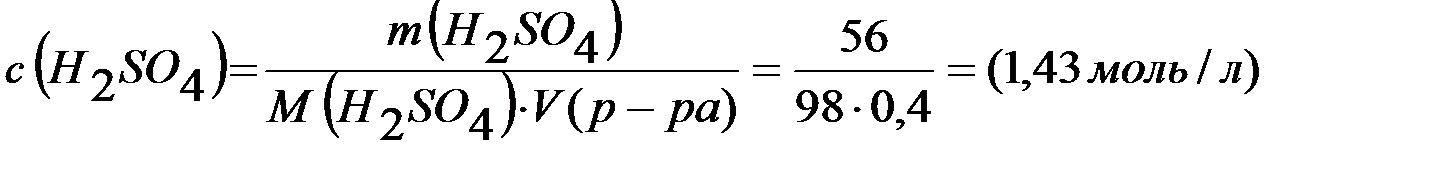 ;
;
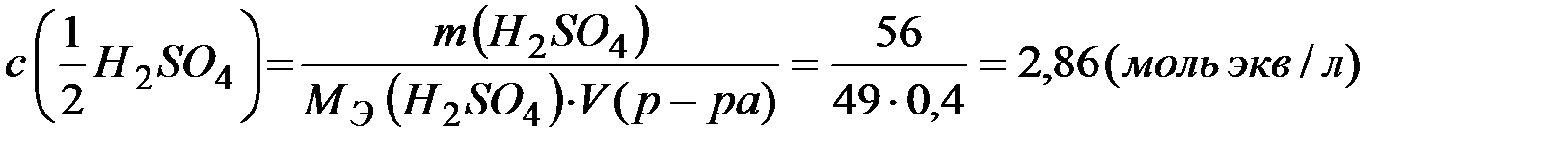
Ответ: 12,6%; 1,43моль/л; 2,86 моль экв/л
Задача 2. Растворение веществ, взаимодействующих с водой, инахождение концентрации полученного раствора.
Найдите массовую долю вещества в растворе, полученном при взаимодействии 4,6 г металлического натрия с 75,6 мл воды.
Решение: Запишем уравнение реакции взаимодействия натрия с водой:
0,2моль 0,2моль 0,1моль
2Na + 2H2O = 2NaOH + H2
2моль 2моль 1моль
Рассчитаем количество вещества и массу NaOH:
 (NaOH)=
(NaOH)=  (Na) =
(Na) = 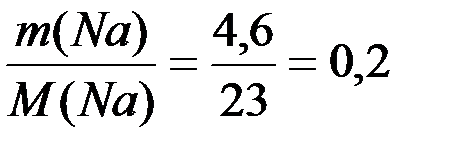 (моль);
(моль);
m (NaOH) = М(NaOH) . 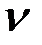 (NaOH)=40 . 0,2=8(г).
(NaOH)=40 . 0,2=8(г).
Масса полученного раствора и массовая доля гидроксида натрия равны:
m(р-ра)= m(H2O) + m(Na) – m(H2) =76,5 + 4,6 - 2 . 0,1=80 (г)
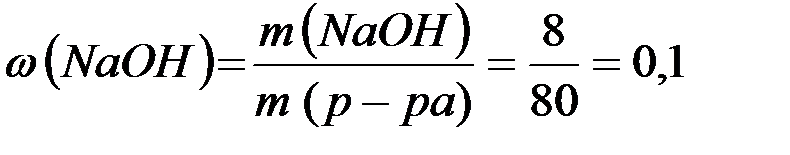 (10%).
(10%).
Ответ: 0,1(10%).
Задача 3. Составление ионно-молекулярных уравнений на основе данных о реагентах и продуктах реакции.
Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами:
а) 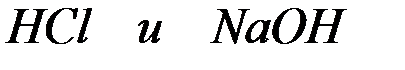
б) 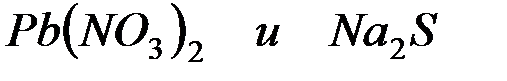
Решение:Запишем уравнения взаимодействия указанных соединений в молекулярной форме:
а) 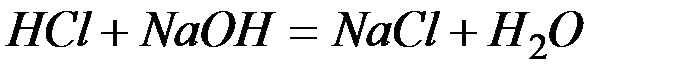
б) 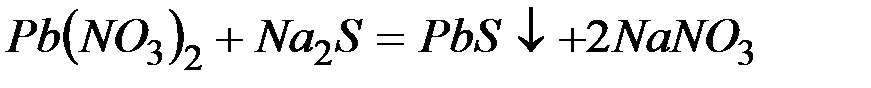
Из рассмотренных примеров видно, что в каждой из реакций присутствует предпосылка для количественного связывания реагентов – образование осадков (PbS, BaSO4, Mg(OH)2), газов (CO2) или недиссоциированных соединений (H2O).
Запишем каждую из этих реакций в ионно–молекулярной форме:
а) 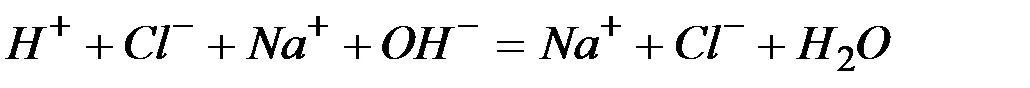
б) 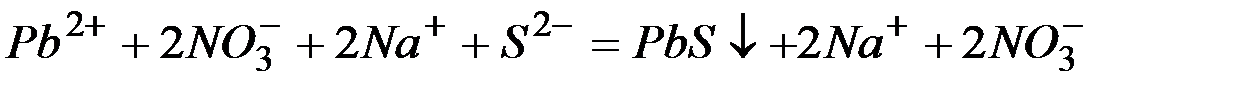
Исключая одинаковые ионы из правых и левых частей уравнений, получаем их краткие ионно-молекулярные формы:
а) 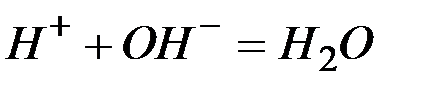
б) 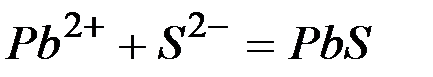
Задача 4. Составление ионно-молекулярных уравнений на основе их ионно–молекулярных форм.
Составьте молекулярные уравнения реакций, которым соответствуют ионно–молекулярные уравнения:
а) 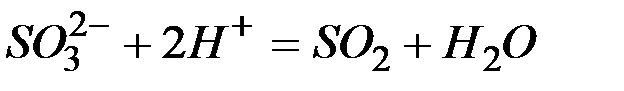
б) 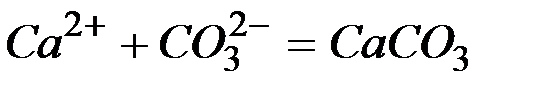
Решение: В левой части приведенных ионно–молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации сильных электролитов. Поэтому при составлении молекулярных уравнений следует исходить из соответствующих водных растворов электролитов. Например:
а) 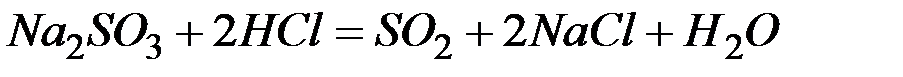
б) 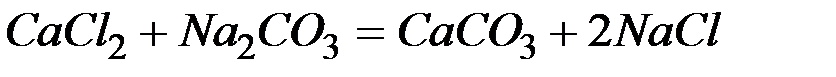
Задача 5. Определение растворимости электролита по величине произведения растворимости.
Произведение растворимости 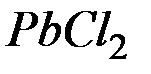 при
при 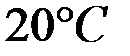 равно
равно 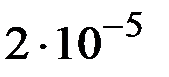 . Вычислите молярную концентрацию
. Вычислите молярную концентрацию 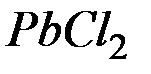 в насыщенном растворе при этой температуре.
в насыщенном растворе при этой температуре.
Решение:Между осадком 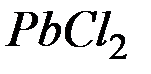 и его ионами в растворе существует равновесие:
и его ионами в растворе существует равновесие:
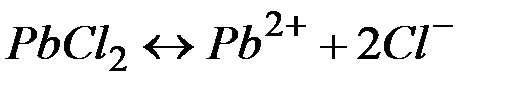 (1) Произведение растворимости, характеризующее это равновесие
(1) Произведение растворимости, характеризующее это равновесие
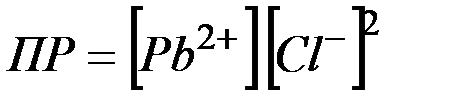 (2) Растворимость
(2) Растворимость 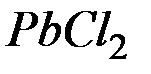 в соответствии с равновесием (1)
в соответствии с равновесием (1)
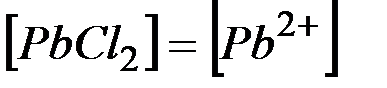
Обозначим 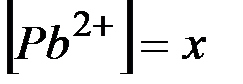 , тогда
, тогда 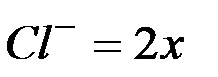 и
и 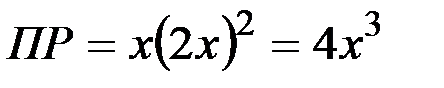 .
.
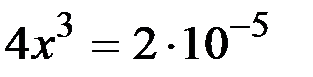 и
и 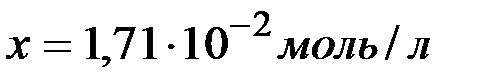 ,
,
т.е. растворимость 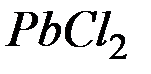 в воде при
в воде при 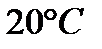 равна
равна 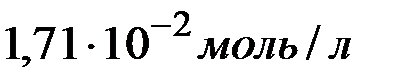 .
.
Ответ: 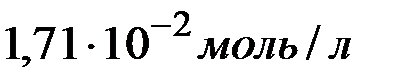 .
.
Задача 6. Вычисление произведения растворимости труднорастворимого электролита.
Растворимость фосфата серебра 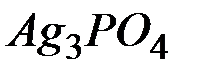 в воде при
в воде при 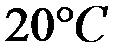 равна
равна 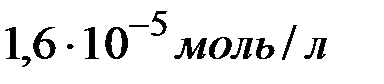 . Определить произведение растворимости этой соли.
. Определить произведение растворимости этой соли.
Решение: Диссоциация (растворение) соли в воде характеризуется равновесием, откуда видно, что 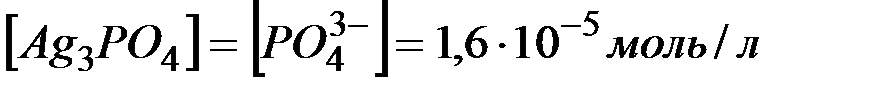 .
.
То 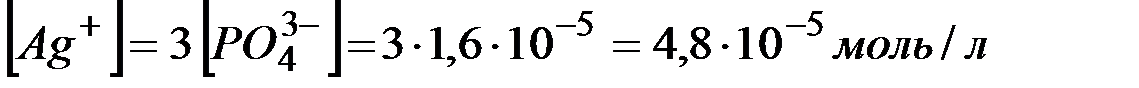
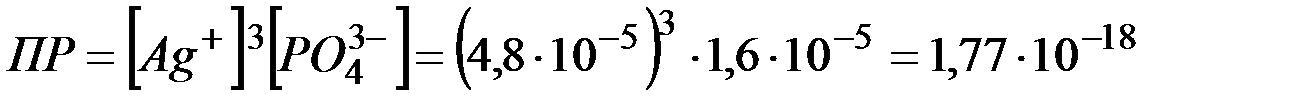 .
.
Ответ: 1,77·10-18
Задача 7. Определение возможности образования осадка в зависимости от концентрации растворов.
Произведение растворимости 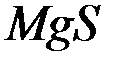 при
при 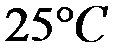 равно
равно 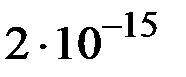 . Образуется ли осадок при смешении равных объемов
. Образуется ли осадок при смешении равных объемов 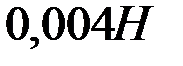 раствора
раствора 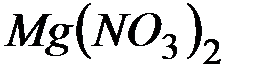 и
и 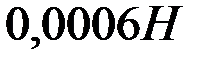 раствора
раствора 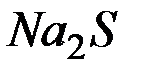 , если степени диссоциации этих электролитов равны 1?
, если степени диссоциации этих электролитов равны 1?
Решение: При смешении равных объемов растворов объем смеси стал в два раза больше объема каждого из взятых растворов, следовательно, концентрация растворенных веществ уменьшилась вдвое, т.е.
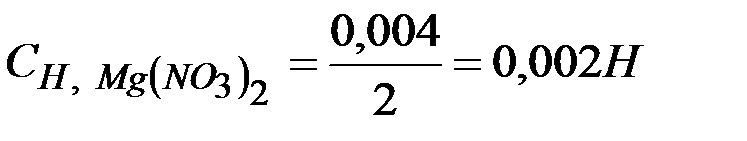
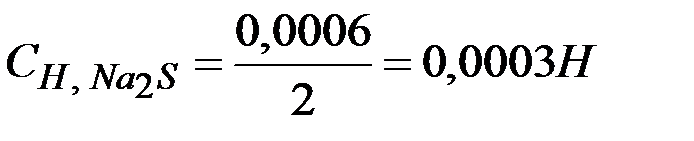 .
.
В соответствии с соотношением между количеством вещества (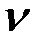 ) и количеством вещества эквивалентов (
) и количеством вещества эквивалентов (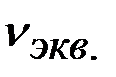 ) для этих солей, их молярные концентрации составят
) для этих солей, их молярные концентрации составят
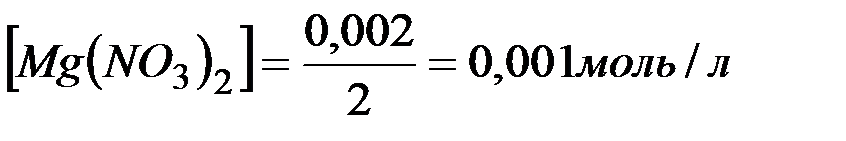
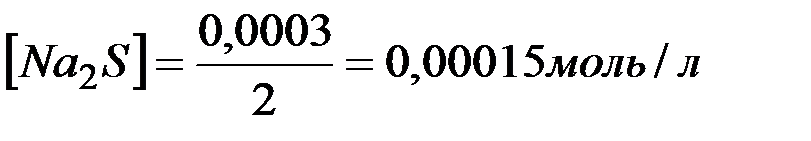 .
.
Тогда 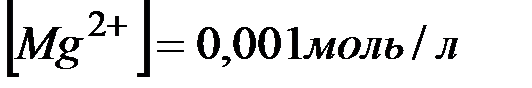 ,; отсюда произведение концентраций ионов
,; отсюда произведение концентраций ионов 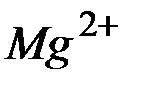 и
и 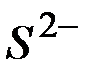 составит
составит 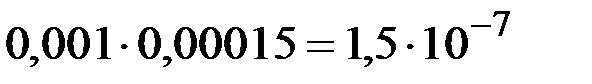 . Эта величина существенно больше
. Эта величина существенно больше 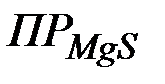 , следовательно, осадок образуется.
, следовательно, осадок образуется.
Ответ:1,5·10-7, осадок образуется.
Задача 8. Вычисление константы гидролиза соли.
Рассчитайте константу гидролиза хлорида аммония NH4Cl, если константа диссоциации NH4ОН равна 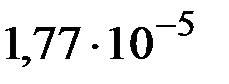 .
.
Решение: Константу гидролиза соли слабого основания и сильной кислоты вычисляют по формуле
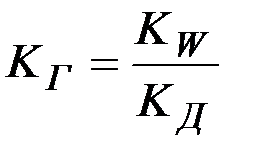 ,
,
где 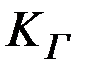 – константа гидролиза;
– константа гидролиза; 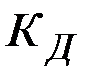 – константа диссоциации слабого основания;
– константа диссоциации слабого основания; 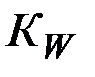 – ионное произведение воды.
– ионное произведение воды.
Константа гидролиза NH4Cl равна
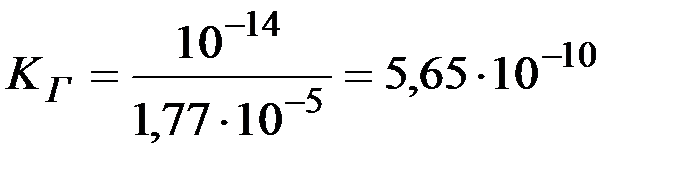 .
.
Ответ: 5,65·10-10
Задача 9. Вычисление степени гидролиза соли.
Определите степень гидролиза 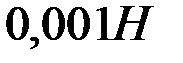 раствора соли
раствора соли 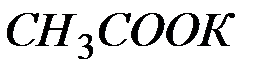 и
и 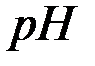 этого раствора, если константа диссоциации уксусной кислоты
этого раствора, если константа диссоциации уксусной кислоты 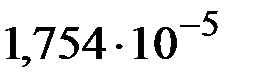 .
.
Решение: Степень и константа гидролиза связаны между собой соотношением
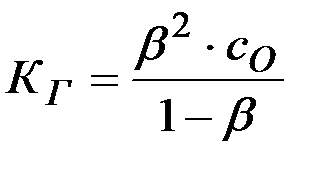
Так как обычно степень гидролиза соли 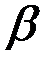 значительно меньше единицы, то
значительно меньше единицы, то 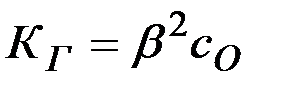 , откуда
, откуда
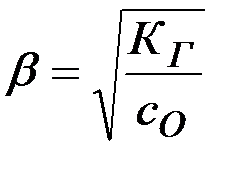
КГ определяется из выражения (13):
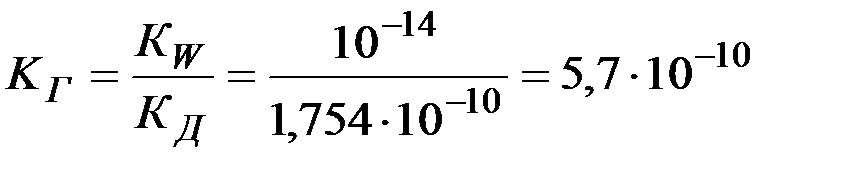 .
.
Поскольку молярная и нормальная концентрации 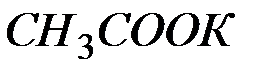 совпадают, то
совпадают, то
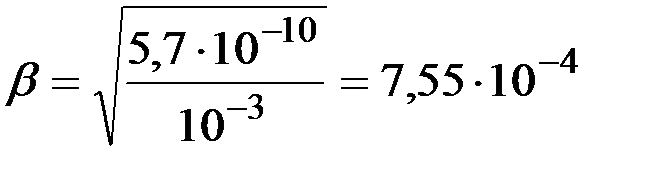 .
.
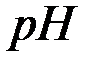 рассчитывается в соответствии с уравнением
рассчитывается в соответствии с уравнением
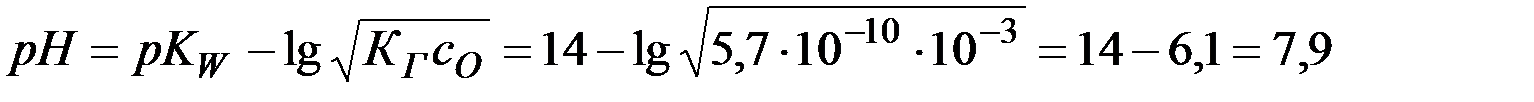 .
.
Ответ: 7,9.
Задача 10. Совместный гидролиз солей.
Обоснуйте, почему совместный гидролиз водного раствора солей 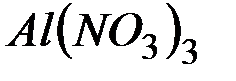 и
и 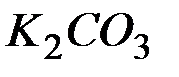 необратим и предложите продукты совместного гидролиза.
необратим и предложите продукты совместного гидролиза.
Решение: Каждая из указанных солей гидролизуется согласно уравнениям:
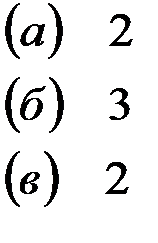
| 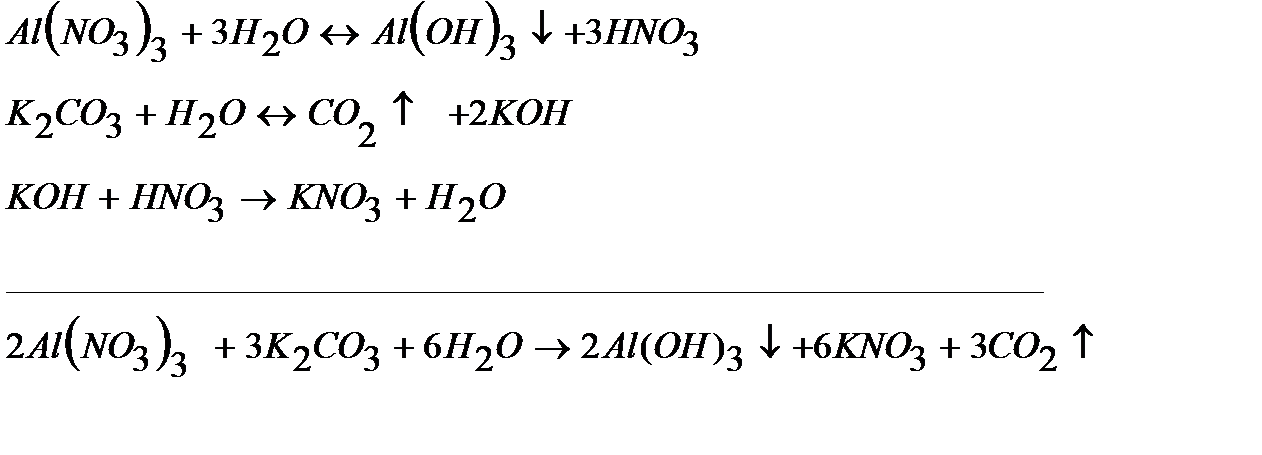
|
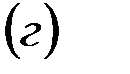
|
В результате этих процессов образуется пара кислота – основание 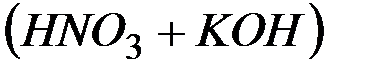 , которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).
, которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).
Задача 11. Определение жесткости воды.
Вычислите жесткость воды, зная, что в 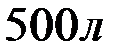 воды содержится
воды содержится 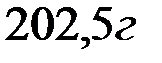
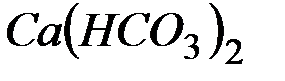 .
.
Решение: В 1 л воды содержится 202,5 г: 500 = 0,405 г 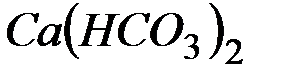 , что составляет 0,405: 81 = 0,005 моль/л (81 г/моль – эквивалентная масса
, что составляет 0,405: 81 = 0,005 моль/л (81 г/моль – эквивалентная масса 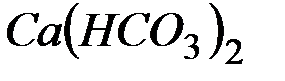 ). Следовательно, жесткость воды равна 5 ммоль экв/л.
). Следовательно, жесткость воды равна 5 ммоль экв/л.
Ответ: 5 ммоль экв/л.
Задача 12. Определение содержания соли по жесткости воды.
Сколько граммов 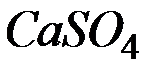 содержится в
содержится в 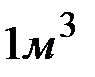 воды, если жесткость, обусловленная присутствием этой соли, равна
воды, если жесткость, обусловленная присутствием этой соли, равна 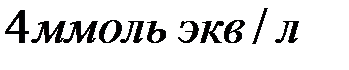 ?
?
Решение: Молярная масса 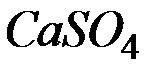 равна 136,14 г/моль; молярная масса эквивалента равна 136,14: 2 = 68,07 (г/моль). В
равна 136,14 г/моль; молярная масса эквивалента равна 136,14: 2 = 68,07 (г/моль). В 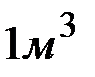 воды жесткостью 4 ммоль экв/л содержится 4 . 1000 = 4000 ммоль, или 4000 . 68,07 = 272280 мг = 272,28 г
воды жесткостью 4 ммоль экв/л содержится 4 . 1000 = 4000 ммоль, или 4000 . 68,07 = 272280 мг = 272,28 г 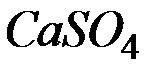 .
.
Ответ: 272,28г.
Задача 13. Определение количества реагента для устранения жесткости воды.
Какую массу соды необходимо добавить к 500 мл воды, чтобы устранить ее жесткость, равную 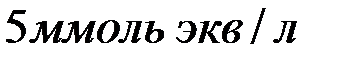 ?
?
Решение: Количество вещества эквивалентов солей, содержащихся в 500 мл воды, составляет
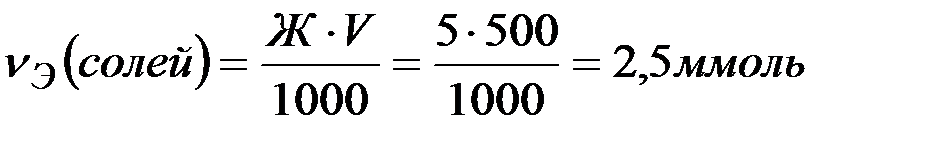
Согласно закону эквивалентов
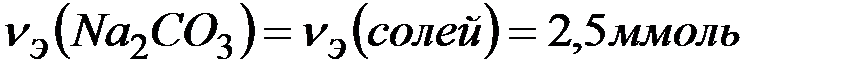
Массу 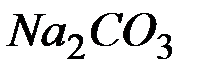 определяем по формуле:
определяем по формуле:
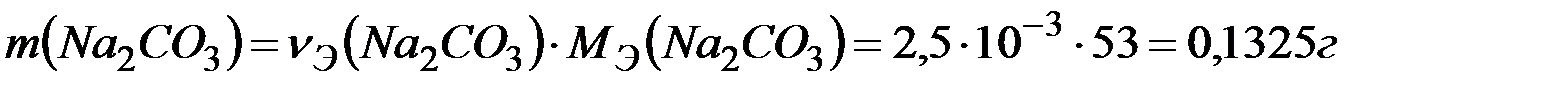 Ответ: 0,1325г.
Ответ: 0,1325г.
Задача 14. Определение жесткости воды по известному количеству реагента, необходимого для устранения жесткости.
Вычислите карбонатную жесткость воды, зная, что на титрование 100 мл этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 мл 0,08Н раствора НСl.
Решение: В соответствии с законом эквивалентов
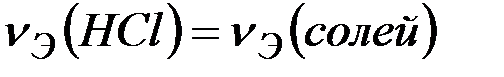 .
.
Количество вещества эквивалентов НСl определяем по формуле:

Поскольку 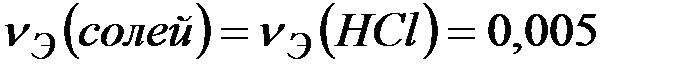 , то
, то
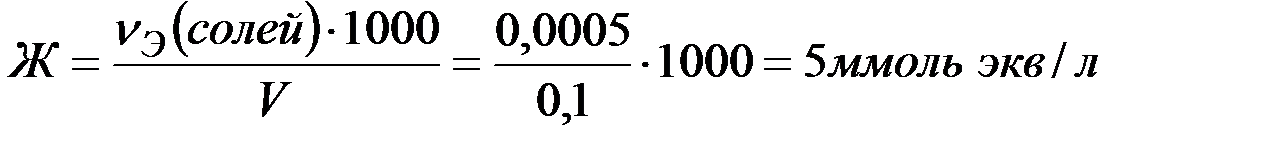 .
.
Ответ: 5ммоль экв/л.
Задача 15.
Вычислите жёсткость воды, зная, что в 500 л её содержится 202,5 г Са(НСО3)2.
Решение: В 1 л воды содержится 202,5: 500 = 0,405 г Са(НСО3)2, что составляет 0,405: 81 = 0,005 эквивалентных масс или 5 мэкв/л (81 г/моль – эквивалентная масса Са(НСО3)2. Следовательно, жёсткость воды 5 мэкв.
Ответ: 5 мэкв
Задача 16. Сколько граммов СаSO4 содержится в 1 м3 воды, если жёсткость обусловленная присутствием этой соли, равна 4 мэкв?
Решение: Мольная масса CaSO4 136,14 г/моль; эквивалентная масса равна 136,14: 2 = 68,07 г/моль. В 1 м3 воды жёсткостью 4 мэкв содержится 4 · 1000 = 4000 мэкв. или 4000 · 68,07 = 272 280 мг = 272, 280 г CaSO4.
Ответ: 272, 280 г
Задача 17. Какую массу соды надо добавить к 500 л воды, чтобы устранить жёсткость, равную 5 мэкв?
Решение: В 500 л воды содержится 500 · 5 = 2500 мэкв солей, обусловливающие жёсткость воды. Для устранения жёсткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль –эквивалентная масса Na2CO3).
Ответ: 132,5 г
Задача 18. Вычислите карбонатную жёсткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н раствора HCI.
Решение: Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив числом эквивалентов растворённого вещества в 1 л раствора, т.е. нормальность, через х составляем пропорцию: 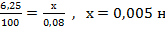
Таким образом, в 1 л исследуемой воды содержится 0,005 · 1000 = 5 мэкв гидрокарбоната кальция или 5 мэкв Са2+ -ионов. Карбонатная жёсткость воды 5 мэкв.
Ответ: 5 мэкв.
Приведённые примеры решают, применяя формулу Ж = m/ЭV, где m –масса вещества, обусловливающего жёсткость воды или применяемого для устранения жёсткости воды, мг; Э –эквивалентная масса этого вещества; V – объём воды, л.
Решение задачи 15: Ж = m/ЭV = 202,500/81·500=5 мэкв. 81 –эквивалентная масса Са(НСО3)2, равная половине его мольной массы.
Решение задачи 16: Из формулы Ж = m/ЭV, m = 4 · 68,07 · 1000 = 272 280 мг = 272,280 г CaSO4.
 Варианты контрольных заданий
Варианты контрольных заданий
Вариант 1
1. Напишите уравнения электролитической диссоциации, происходящей в растворах следующих веществ, в необходимых случаях учтите ступенчатость диссоциации: AICI3, Na2HPO4, H2SO3
2. Закончите уравнения реакций и напишите их в ионно-молекулярной форме (полной и сокращённой): Na2CO3 + HCI →…; AgNO3 + CaCI2→…
3. Водородный показатель раствора равен 8,5. Вычислите концентрацию ионов водорода и гироксид ионов в данном растворе.
4. Из данных ниже солей по катиону гидролизуются:K2S, Zn(NO3)2, K2SO3.
5. Чему равна жёсткость воды, если для её устранения к 50 мл воды потребовалось прибавить 21,2 г карбоната натрия. Напишите уравнения протекающих при этом реакций.
Вариант 2
1. Напишите уравнения ступенчатой электролитической диссоциации следующих веществ: Ва(ОН)2, AI(OH)CI2, H2CO3.
Для каждого из электролитов укажите, какая из ступеней диссоциации характеризуется константой диссоциации, объясните почему? Напишите математические выражения соответствующих констант диссоциации.
2. Закончите уравнения реакций:
FeS + HCI→ …, Ba(NO3)2 + AI2(SO4)3→…
3. Что такое водородный показатель раствора? Вычислите водородный показатель раствора, в котором концентрация гидроксид ионов составляет 9·10-9 моль/л.
4. Из приведённых ниже солей по аниону гидролизуется: K2SO4, Na2S, Mg(NO3)2. Для выбранных солей составьте ионно-молекулярные и молекулярные уравнения реакции гидролиза (учтите ступенчатый характер гидролиза). Укажите реакцию среды в растворах этих солей.
5. В 1 л воды содержится 36,47 мг ионов магния и 50,1 мг ионов кальция. Вычислите общую жёсткость воды.
Вариант 3
1. Напишите уравнения ступенчатой электролитической диссоциации следующих веществ: NH4OH, Ca(H2PO4)2, CH3COOH.
Диссоциация каких электролитов характеризуется константой диссоциации? Напишите математические выражения констант диссоциации для тех из данных электролитов, к которым можно приложить это понятие (с учётом ступенчатости диссоциации).
2. Закончите уравнения реакций:
Fe(OH)3 + H2SO4→…; Ni(NO3)2 + H2S →
Составьте полные и сокращённые ионно-молекулярные уравнения данных реакций.
3. Что такое гидроксильный показатель раствора? Вычислите гидроксильный показатель раствора, в котором концентрация ионов водорода равна 2,17·10 -11 моль/л.
4. Какие из приведённых солей подвергаются гидролизу при растворении в воде: ZnBr2, Pb(NO3)2, KHCO.
Для выбранных солей составьте ионно-молекулярные и молекулярные уравнения реакций гидролиза (учтите ступенчатый характер гидролиза). Укажите реакцию среды в растворах этих солей.
5. Растворимость AgJ равна 1,2 ∙ 10−8 моль/л. Вычислить произведение растворимости AgJ. Ответ: 1,5 ∙ 10−16.
Вариант 4
1. Что такое сильные и слабые электролиты? Какой величиной характеризуется сравнительная сила слабых электролитов? Напишите уравнения ступенчатой диссоциации следующих слабых электролитов: Н2СО3, Н3AsO4, H2S.
Приведите названия ионов, содержащихся в растворах данных веществ. Напишите математические выражения констант для всех ступеней диссоциации одного из данных электролитов.
2. Составьте уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения: Pb2+ + 2J- → PbJ2; AI(OH)22- + H- → AI3- + H2O
3. Водородный показатель раствора равен 10,25. Вычислите концентрацию ионов водорода в этом растворе.
4. Как влияет сила слабого электролита, образующего соль, на степень гидролиза соли? Степень гидролиза какой соли при равных молярных концентрациях их растворов больше (по первой ступени гидролиза): К2СО3 или К2SO3?
Составьте ионно–молекулярные и молекулярные уравнения реакций гидролиза данных солей по первой ступени.
5. В 600 л воды содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция. Вычислите общую и карбонатную жёсткость этой воды.
Вариант 5
1. Что такое степень диссоциации? От каких факторов и как зависит степень диссоциации слабого электролита? Как и почему изменится степень диссоциации уксусной кислоты, если ввести в раствор небольшое количество ацетата натрия? Приведите мотивированный ответ.
2. В молекулярной и ионно-молекулярной формах составьте уравнения реакций, протекающих при сливании растворов следующих веществ:
а) гидроксида алюминия и гироксида калия (избыток);
б) гидросульфида натрия и серной кислоты.
3. Что такое ионное произведение воды? Чему равна молярная концентрация гидроксид ионов в растворе, в котором концентрация ионов водорода равна 6,5 · 10-8 моль/л? Какая среда в этом растворе?
4. Укажите реакцию среды в водных растворах следующих солей:NaHCO3, CH3COOK, LiNO3.
Ответ мотивируйте, написав ионно-молекулярные и молекулярные уравнения гидролиза солей.
Вариант 6
1. Сколько ионов получится в растворе при полной электролитической диссоциации одной молекулы каждого из следующих веществ:
а) CaBr2; б) Са(Н2РО4)2; в) Zn(OH)NO3 (по 1-й ступени)?
Составьте уравнения электролитической диссоциации данных веществ.
2. Напишите полные и сокращённые ионно-молекулярные уравнения следующих реакций, протекающих в водном растворе:
Н3РО4 + Са(ОН)2 = СаНРО4 + 2Н2О;
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2 + 6Н2О
3. Водородный показатель одного раствора равен 4,5, а другого –6. В каком растворе молярная концентрация ионов водорода больше и во сколько раз?
4. Какие соли гиролизуются ступенчато? Определите, какие их приведённых ниже солей гидролизуются ступенчато:
NH4NO3, Mn(NO3)2, K2S?
Ответ подтвердите, написав ионно-молекулярные и молекулярные уравнения реакций гидролиза выбранных солей по I –й ступени.
5. Вычислить молярную концентрацию раствора муравьиной кислоты, если рН равен 3, а КДИС= 1,8 ∙ 10–4. Ответ: КДИС= 4,8 ∙ 10–3.
Вариант 7
1. Напишите уравнения электролитической диссоциации веществ:
HCIO4, NH4HS, H2S.
Диссоциация каких из данных электролитов, или их ионов (диссоциация по 2 –й ступени) характеризуется константой диссоциации, почему? Напишите математические выражения соответствующих констант диссоциации.
2. Попарно смешали растворы следующих веществ:
а) NaNO3 + K2SO4 → …; б) СН3СООNa + HSO4→…; в) NaHCO3 + HCI →…
В каких из приведённых случаев реакции протекают практически необратимо, до конца? Чем это можно объяснить для каждого из случаев? Составьте полные и сокращённые ионно-молекулярные уравнения протекающих реакций.
3. Вычислите водородный показатель раствора, в котором молярная концентрация гидроксид ионов равна 7,4·10-11моль/л.
4. Напишите ионно-молекулярные и молекулярные уравнения реакций гидролиза силиката натрия по I –й ступени. Добавление каких веществ приведёт к усилению гидролиза этой соли: а) соляной кислоты; б) раствора щёлочи?
5. Вычислить нормальность раствора НCI (α = 1), имеющего рН равную 1,6.Ответ: 0,025 н.
Вариант 8
1. Напишите уравнение ступенчатой диссоциации сероводородной кислоты и выражения соответствующих констант диссоциации. В каком направлении будут смещаться эти равновесия при добавлении: а) HCI; б) NaOH?
2. Напишите молекулярной форме уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
а) Са2+ + РО43- = ↓Са3(РО4)2;
б) FeS + H+ = Fe2+ + H2S;
3. Вычислите рН раствора соляной кислоты, молярная концентрация эквивалента которого равна 0,05 моль/л, степень диссоциации кислоты равна 1(100%).
4. В растворе какой соли Na2SO3 или NaHSO3 среда более щёлочная? Объясните почему? Напишите ионно-молекулярные и молекулярные уравнения реакций гидролиза данных солей.
5. Растворимость СаСО3 при 180С равна 6,9 ∙ 10−5 моль/л. Вычислить ПРСаСО3. Ответ: 4,8 ∙ 10−9.
Вариант 9
1. Диссоциация каких электролитов характеризуется константой диссоциации? Приведите примеры, составьте уравнения электролитической диссоциации и выражения констант диссоциации выбранных электролитов.
2. Закончите уравнения реакций и напишите их в ионно-молекулярной форме:
а) СН3СООН + Mg(OH)2→ …; б) (NH4)2S + HCI →…
3. Вычислите концентрацию ионов водорода в растворе, рН которого равен 10,25.
4. Какую реакцию среды будут иметь растворы следующих солей:MnSO4, K2S, AI(NO3)3? Составьте уравнения реакций гидролиза данных солей в ионно-молекулярной и молекулярной формах.
5. Вычислить нормальность раствора муравьиной кислоты, рН которого 2,2 (КДИС= 1,8 ∙ 10–4). Ответ: 0,22.
Вариант 10
1. Сколько ионов получится в растворе при полной электролитической диссоциации одной молекулы каждого из следующих веществ:
Cr(SO4)3, NaHSO3, Ba(HCO3)2?
Составьте уравнения электролитической диссоциации данных веществ.
2. Напишите молекулярные, полные ионно-молекулярные и сокращённые ионно-молекулярные уравнения реакций, происходящих при смешении растворов следующих веществ: а) Cu(OH)2 + HNO3→…; б) AI(OH)3 + KOH →…
3. В водном растворе концентрация ионов водорода равна 10-3 моль/л. Вычислите значение рОН раствора.
4. Какой цвет приобретёт лакмус в растворах данных ниже солей: (NH4)2CO3; NaNO3; MnCI2? Ответ мотивируйте уравнениями реакций в ионно-молекулярной и молекулярной формах.
5. ПРPbJ2 равно 8,7 ∙ 10−9. Выпадает ли осадок, если смешать равные объёмы растворов, содержащих 3 г/л Pb(NO3)2 и 1 г/л KJ?
Вариант 11
1. Дайте определения кислотам и основаниям с точки зрения теории электролитической диссоциации. Ответ подтвердите уравнениями диссоциации кислот и оснований.
2. Закончите уравнения реакций и составьте их в полной и сокращённой ионно-молекулярной формах: а) Са(ОН)2 + СО2→…; б) NH4OH + HCI→ …
3. Вычислите рН раствора, в котором концентрация гидроксид ионов равна 6,5·10-6 моль/л.
4. Укажите, какие из данных ниже солей подвергаются гидролизу в водном растворе: NaBr, Na2S, Pb(NO3)2. Для выбранных солей составьте ионно-молекулярные и молекулярные уравнения реакций гидролиза. Укажите реакцию среды в растворах данных солей.
5. Рассчитать рН аммонийного буферного раствора, содержащего 0,3 М NH4OH и 0,15 М NH4CI. (КДИС= 1,8 ∙ 10–5). Ответ: 9,56.
Вариант 12
1. Ниже приведены константы диссоциации слабых кислот:
Кислота СН3СООН, HNO2, HBrO, HCIO
Кд 1,75·10-5 4·10-4 2,0·10-9 5,0·10-8
Напишите уравнения электролитической диссоциации данных кислот и математические выражения констант диссоциации их. В растворе какой кислоты при постоянной температуре концентрация недиссоциированных молекул наибольшая (концентрации растворов одинаковы)?
2. Напишите по 2 уравнения реакций в молекулярной форме, соответствующие следующим ионно-молекулярным: СО32- +… = СО2 + Н2О; Ве(ОН)2 + 2ОН- = [Be(OH)4]2-.
3. Вычислите водородный показатель раствора азотной кислоты, с концентрацией 0,02 моль/л, считая диссоциацию кислоты полной.
4. В водном растворе какой соли рН<7: Ba(NO3)2, Na2SO3, CH3COOK?
Ответ поясните, составив ионно-молекулярные и молекулярные уравнения реакций гидролиза солей.
5. Строение молекулы воды. Особенности внутреннего строения жидкой воды и кристалла льда.
Вариант 13
1. Теория электролитической диссоциации. Сильные и слабые электролиты. Степень и константа диссоциации. Что называется общим и частным порядком реакции.
2. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaHCO3 и NaOH; б) K2SiO3 и HCl; в) BaCl2 и Na2SO4.
3. Растворимость AgJ равна 1,2 ∙ 10−8 моль/л. Вычислить произведение растворимости AgJ.Ответ: 1,5 ∙ 10−16.
4. Вычислить рН ацетатного буферного раствора, содержащего в 1л 0,25 М СН3СООН и 0,12 М СН3СООNа после добавления к нему 0,02 моля КОН (КДИС= 1,8 ∙ 10–5). Ответ: 4,52.
5. Растворимость бромида калия при 50 ОС равна 80 г. Рассчитайте массовую долю соли в насыщенном при 50 ОС растворе. Ответ: 44,4%
Вариант 14
1. Ионное произведение воды. Водородный показатель. Значение рН в живых организмах. Кислотно-основные свойства веществ.
2. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и КОН; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
3. Вычислить концентрацию [Н+] – ионов, если концентрация [ОН −] ионов равна 4 ∙ 10–10 моль/л. Ответ: 2,5 ∙ 10–5 моль/л.
4. Растворимость PbJ2 при 180С составляет 1,3 ∙ 10−3моль/л.Вычислить произведение растворимости PbJ2 Ответ: 8,7 ∙ 10−9.
5. Какие из представленных ниже уравнений являются уравнениями реакции гидролиза:
а) Na2CO3 + H2O → NaHCO3 + NaOH,
б) Mg + 2H2O → Mg(OH)2 + H2,
в) CuSO4 + 5H2O → CuSO4 ∙ 5H2O,
Вариант 15
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и HCl; б) FeSO4 и (NH4)2S; в) Cr(OH)3 и KOH.
2. Какие из представленных ниже уравнений являются уравнениями реакции гидролиза:
а) 2CuSO4 + 2H2O → Cu2(OH)2SO4 + H2SO4,
б) SO3 + H2O → H2SO4,
в) Cr2S3 + 6H2O → 2Cr(OH)3 + 3H2S,
3. Вычислить рН раствора, в котором концентрация [Н+] – ионов равна 10–5 моль/л.
Ответ: 5.
4. Произведение растворимости PbCI2 равно 1,7 ∙ 10−5. Чему равна концентрация ионов [Pb2+] в насыщенном растворе PbCI2? Ответ: 1,6 ∙ 10−2.
5. Рассчитайте рН ацетатного буферного раствора, приготовленного из 80 мл 0.1 н. раствора уксусной кислоты и 20 мл 0.1 н. раствора ацетата натрия. Константа диссоциации кислоты Ka(СH3COOH) = 1.8 ∙ 10–5, степень диссоциации соли в растворе равна 100 %. Ответ: 4.16
Вариант 16
1. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Mg2+ + CO32- = MgCO3; б) H+ + OH- = H2O.
2.Какие из представленных ниже уравнений являются уравнениями реакции гидролиза:
а) CaH2 + 2H2O → Ca(OH)2 + 2H2,
б) CaC2 + 2H2O → Ca(OH)2 + C2H2,
в) SO2Cl2 + 2H2O → H2SO4 + 2HCl,
3. Вычислить рН раствора, в котором концентрация[Н+] – ионов равна 6,5 ∙ 10–6 моль/л. Ответ: 8,81.
4.Растворимость Fe(OH)3 равна 1,9 ∙ 10−10 моль/л. Вычислить ПРFe(OH)3. Ответ: 3,5 ∙ 10−38.
5. В 1 л раствора содержится 3.0 г уксусной кислоты и 4.1 г ацетата натрия. Рассчитайте рН этого раствора. Константа диссоциации Ka (СH3COOH) = 1.8 ∙ 10–5. Ответ:4.74.
Вариант 17
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНСО3 и H2SO4; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3.
2. Что такое реакция а) гидратации, б) гидролиза? Приведите по 3 примера для каждого вида реакции.
3. Вычислить рН и рОН 0,001 М раствора НСI, приняв α = 1. Ответ: 3; 11.
4. Растворимость ВаСО3 равна 8,9∙ 10−4 моль/л. Вычислить концентрации ионов [Ва2+] и [СО2−] (моль/л), а также ПРВаСО3. Ответ: 8,0 ∙ 10−9.
5. В 600 л воды содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция. Вычислите общую и карбонатную жёсткость этой воды.
Вариант 18
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH.
2. Составьте уравнения гидролиза следующих солей в молекулярной и сокращенной ионной формах: KCN, NH4Cl, ZnCl2, Na2S, Na3PO4, Al2(SO4)3.
3. Вычислить концентрацию [ОН −] – иона в растворе, рН которого 5,1. Ответ: 1,26 ∙ 10–9 моль/л.
4.Произведение растворимости Ag2Cr2O7 равно 2 ∙ 10−7. Выпадает ли осадок при смешении равных объёмов 0,01 н растворов AgNO3 и K2Cr2O7?
5. Некарбонатная жёсткость воды равна 3,18 ммоль/л. Какую массу ортофосфата натрия надо взять, чтобы умягчить 1м3 воды? Составьте уравнения соответствующих реакций умягчения воды.
Вариант 19
1. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Cu2+ + S2- = CuS; б) SiO32- + 2H+ = H2SiO3.
2. Закончите уравнения реакций совместного гидролиза солей:
СuSO4 + Na2CO3 + H2O → Cu2(OH)2CO3 + …,
BeSO4 + NaHCO3 + H2O → BeCO3 +...,
3. Вычислить концентрацию ионов водорода в растворе, если рН равна 4,8. Ответ: 1,6 ∙ 10–5 моль/л.
4. В 2 л воды при 250С растворяется 2,2 ∙ 10−4 г бромида серебра. Вычислить ПPAgBr. Ответ: 3,4 ∙ 10−13.
5. В 20 л воды содержится 0,76 г ионов магния и 2,16 г ионов кальция. Вычислите общую жёсткость воды.
Вариант 20
1. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СаСО3 + 2Н+ = Са2+ + Н2О + СО2; б) Al(OH)3 + OH– = [Al(OH4)]–; в) Pb2+ + 2I– = PbI2.
2. Закончите уравнения реакций совместного гидролиза солей:
AlCl3 + CH3COONa + H2O → Al(OH)(CH3COO)2 + …,
Na2SiO3 + NH4Cl + H2O →...,
3. Вычислить рН 0,1 н раствора НСI, если α = 90%. Ответ: 1,05.
4. Растворимость сульфата бария в воде равна 2,45∙ 10−3 г/л. вычислить приозведение растворимости BaSO4. Ответ: 1,1 ∙ 10−10.
5. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жёсткость этой воды.
Вариант 21
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2.
2. Закончите уравнения реакций совместного гидролиза солей:
FeCl3 + (NH4)2CO3 + H2O →...,
Cr2(SO4)3 + Na2S + H2O →...
3. Вычислить рН 0,01 %-го раствора НСI, плотность которого равна единице (α принять равной 1). Ответ: 2,57.
4. К 1 л0.1 М раствора аммиака добавлено 10.7 г кристаллического хлорида аммония. Константа диссоциации Kb (NH4OH) = 1.8 ∙ 10–5. Рассчитайте рН полученного раствора.
5. Жёсткость некоторого образца воды обусловлена только гидрокарбонатом кальция. При кипячении 10 л такой воды в осадок выпало 3 г СаСО3. Вычислите жёсткость данного образца воды.
Вариант 22
1. Какие из веществ: NaCl, NiSO4, Be(OH)2, KHCO3, взаимодействуют с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
2. Почему изменение температуры раствора влияет на степень гидролиза соли? Составьте уравнения гидролиза по первой ступени для следующих солей: 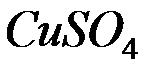 и
и 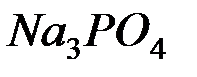 , укажите рН.
, укажите рН.
3. Вычислить с учётом кажущейся степени диссоциации рН раствора, еслик 3 л воды прибавили 2 мл 96% -й серной кислоты, плотность которой 1,84 г/см3. Ответ: 1,67.
4. Рассчитайте рН буферного раствора, в 1 л которого содержатся 0.2 моль гидроксида аммония и 0.02 моль хлорида аммония. Рассчитайте значение рН после добавления к 200 мл буферного раствора 1.22 г хлорида аммония. Константа диссоциации Kb(NH4OH) = 1.8 . 10–5. Ответ: 10,26 и 9,43.
5. Сколько г Са(ОН)2 необходимо прибавить к 1000 л воды, чтобы устранить временную жёсткость, равную 2,86 ммоль/л? Напишите уравнение протекающей реакции в молекулярной и ионно – молекулярной формах.
Вариант 23
1. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Be(OH)2 + 2OH– = BeO22– + 2H2O; б) СН3СОО– + Н+ = СН3СООН; в) Ba2+ + SO42– = BaSO4.
2.Рассчитайте значения константы гидролиза, степени гидролиза и рН 0.1 М раствора нитрата аммония при 22 °С. Ионное произведение воды равно 1 ∙ 10–14, константа диссоциации Kb (NH4OH) = 1.8 ∙ 10–5. Ответ: 5,6 ∙ 10–10; 7,5 ∙ 10–3 %; 4,76.
3. Вычислить рН формиатного буферного раствора, в 1 л которого содержится по 0,1 М НСООН (КДИС= 1,8 ∙ 10–4). Ответ: 3,74.
4. Произведение растворимости PbSO4 равно 2,3 ∙ 10−8. Сколько литров воды потребуется для растворения 1 г PbSO4. Ответ: 22 л.
5. В 1 л воды содержится 38 мг ионов магния и 108 мг ионов кальция. Вычислите общую жёсткость воды.
Вариант 24
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Be(OH)2 и NaOH; б) Cu(OH)2 и HNO3; в) Zn(OH)NO3 и HNO3.
2. Степень гидролиза цианида натрия в 0.01 М растворе при температуре 22 °С равна 3.7 ∙ 10–2. Рассчитайте константу диссоциации циановодорода HCN при указанной температуре. Ионное произведение воды равно 1 ∙ 10–14. Ответ: 7,1 ∙ 10–10
3. Вычислить рН и рОН 1 М раствора NaOH, если α = 72,6 %. Ответ: 13,86.
4. Произведение растворимости СаСО3 равно 4,8 ∙ 10−9. Выпадает ли осадок, если смешать равные объёмы 0,001 М растворов СаCI2 и NaCO3?
5. Вода, содержащая только гидрокарбонат, имеет жёсткость 9 ммоль/л. Какая масса гидрокарбоната кальция содержится в 500 л её?
Вариант 25
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH.
2. Рассчитайте степень гидролиза и рН водного раствора формиата натрия HCOONa концентрацией 0.1 моль / л. Ионное произведение воды равно 1 ∙ 10–14, константа диссоциации Ka (HCOOH) = 2.0 ∙ 10–4. Ответ:2,24 ∙ 10–5, 8,35
3. Вычислить рН 0,15 н раствора НNO2, если КК= 4 ∙ 10–4. Ответ: 2,11.
4. Растворимость PbBr2 при 180С равна 2,7 ∙ 10−2 моль/л. Вычислить произведение растворимости PbBr2 Ответ: 7,9 ∙ 10−5.
5. В 1 л воды содержится 56,4 мг ионов магния и 25,1 мг ионов кальция. Чему равна жёсткость этой воды?
Вариант 26
1. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe(OH)3 + 2H+ = Fe3+ + 3H2O; б) Cd2+ + 2OH– = Cd(OH)2; в) H+ + NO2– = HNO2.
2. Рассчитайте степень гидролиза и рН водного раствора ацетата натрия концентрацией 0.1 моль / л. Ионное произведение воды равно 1 ∙ 10–14, константа диссоциации Ka(СH3COOH) = 1.8 ∙ 10–5. Ответ: 7,4 ∙ 10–5; 8, 87
3. Вычислить рН ацетатной буферной смеси, содержащей в 1 л 0,15 М СН3СООН и 0,2 М СН3СООNa (КДИС= 1,8 ∙ 10–5). Ответ: 4,62.
4. Произведение растворимости AgCI равно 1,6 ∙ 10−10. Вычислить концентрацию насыщенного раствора AgCI в моль/л и г/л. Ответ: 1,26 ∙ 10−5 моль/л; 1,8 ∙ 10−3 г/л.
5. Какая масса сульфата кальция содержится в 200 л воды, если жёсткость её, обуславливаемая этой солью равна 8 ммоль/л?
Вариант 27
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdS и HCl; б) Сr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2.
2. Рассчитайте значения константы гидролиза, степени гидролиза и рН разбавленного раствора нитрита аммония NH4NO2 при температуре 22 °С. Ионное произведение воды равно 1 ∙ 10–14, константы диссоциации Ka(HNO2) = 4.0 ∙ 10–4, Kb(NH4OH) = 1.8 ∙ 10–5.
Ответ: 1,4 ∙ 10–6; 1,2 ∙ 10–3; 6,33.
3. К 200 мл водного раствора муравьиной кислоты концентрацией 0.3 моль / л прибавили 400 мл водного раствора формиата натрия концентрацией 0.03 моль / л. Степень диссоциации соли в растворе равна 100 %. Константа диссоциации Ka(HCООН)= 1.8 . 10–4. Рассчитайте значение рН раствора. Ответ: 3,07.
4. Произведение растворимости CuS равно 4 ∙ 10−38. Сколько литров воды понадобилось бы для растворения 1 г сульфида меди?Ответ: 5 ∙ 1016л.
5. Образец воды объёмом 1 л содержит 48, 6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество ионов кальция и магния содержится в 1 л воды? Чему равна общая жёсткость воды.
Вариант 28
1. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Zn2+ + H2S = ZnS + 2H+; б) НСО3– + Н+ = Н2О + СО2; в) Ag+ + Cl– = AgCl.
2. Какую реакцию имеют растворы следующих солей: 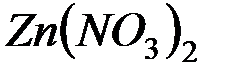 ;
; 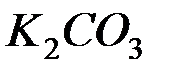 ;
; 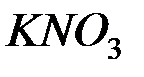 ;
; 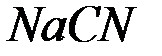 ? Ответы подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
? Ответы подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
3. Вычислить каким объёмом воды следует разбавить 1 л 0,6 %-го раствора СН3СООН для получения раствора с рН, равным 3,0 (КДИС= 1,8 ∙ 10–5). Ответ: 0,8 л.
4. Сколько граммов СаСО3 может раствориться в 1 л воды при 180С, если ПРСаСО3 при той же температуре равно 4,8 ∙ 10−9. Ответ: 6,9 ∙ 10−3 г.
5. Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить её карбонатную жёсткость, равную 5,5 ммоль/л.
Вариант 29
1. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba (OH)2; б) FeCl3 и NH4OH; в) СН3СООNa и HCl.
2. В какую сторону сместится равновесие гидролиза 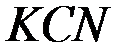 , если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнения гидролиза в молекулярном и ионном виде.
, если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнения гидролиза в молекулярном и ионном виде.
3. Вычислить рН 0,4 % -го раствора НСI (ρ = 1,02), учитывая кажущуюся степень диссоциации. Ответ: 1,07.
4. Произведение растворимости СаSO4 равно 6 ∙ 10−5. Выпадает ли осадок СаSО4, если смешать равные объёмы 0,2 н растворов СаC2 и Nа2SО4
5. В 1 м3 жёсткой воды прибавили 132,5 г карбоната натрия. На сколько понизилась её жёсткость?
Вариант 30
1. При смешении растворов 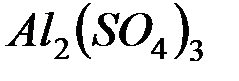 и
и 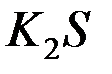 в осадок выпадает гидроксид и выделяется газ. Укажите причину этого процесса и составьте соответствующие молекулярные и ионные уравнения.
в осадок выпадает гидроксид и выделяется газ. Укажите причину этого процесса и составьте соответствующие молекулярные и ионные уравнения.
2. В какую сторону сместится равновесие гидролиза 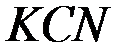 , если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнения гидролиза в молекулярном и ионном виде.
, если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнения гидролиза в молекулярном и ионном виде.
3. Сколько воды потребуется для растворения при комнатной температуре 1 г СаС2О4, если ПРСаС2О4= 2,6 ∙ 10−9? Ответ: 154 л.
4. Рассчитайте значение рН водного раствора азотистой кислоты концентрацией 0.1 моль / л. Рассчитайте, каким станет значение рН при добавлении к 1 л этого раствора 0.2 моль нитрита натрия. Степень диссоциации соли в растворе равна 100 %. Константа диссоциации Ka(HNO2) = 5.1 ∙ 10–4. Ответ: 3,59.
5. Вода, содержащая сульфат кальция имеет жёсткость 4,5 ммоль/л. Какая масса сульфата кальция содержится в 500 л этой воды?






