1.От природы растворителя и растворенного вещества. На растворимость оказывает влияние природа растворителя и растворенного вещества. Наибольшая растворимость достигается тогда, когда «подобное растворяется в подобном» − постулат (закон) установлен еще алхимиками.
Полярные и ионные соединения, как правило, хорошо растворяются в полярных растворителях, а неполярные – в неполярных. Например, хлороводород, молекулы которого полярны, хорошо растворяется в воде, но плохо в бензоле. Бензол хорошо растворяется в эфире, но не смешивается с водой. С научной точки зрения это объясняется теорией химической связи.
Вещества с одинаковым типом межмолекулярных сил притяжения имеют тенденцию к взаимной растворимости. Это обобщение и формулируется в более простой форме: «подобное растворяется в подобном». Неполярные вещества растворимы в неполярных растворителях, тогда как ионные и полярные вещества растворимы в полярных растворителях.Ковалентные (каркасные) твердые вещества типа алмаза или кварца не растворяются ни в полярных, ни в неполярных растворителях, т.к. в этих веществах очень велики межмолекулярные силы.2. От влияния температуры. С повышением температуры растворимость почти всех твердых веществ в жидкостях увеличивается. Зависимость между растворимостью и температурой изображается в виде кривых растворимости.
Растворение жидкостей в жидкостях (смешивающиеся) с повышением температуры растет.
Сложный характер носит температурная зависимость растворимости ограниченно смешивающихся жидкостей. Для них с изменением температуры, ограниченная растворимость, может перейти в неограниченную и наоборот Ткр (критическая температура)для системы вода/фенол равна 66,40С
Растворимость газов в жидкостях с повышением температуры уменьшается, т.к. процесс растворения почти всегда сопровождается выделением теплоты - процесс экзотермический (ΔHраств.<0), Эту закономерность часто используют для удаления растворенных газов из воды (например С02 ) простым кипячением.
Снижение температуры благоприятствует растворению газов.
Например, уменьшение растворимости кислорода в воде с повышением температуры – один из нежелательных эффектов, называемых «тепловым загрязнением» озер и ручьев.В органических жидкостях нередко растворения газа сопровождается эндотермическим процессом (ΔHраств. > 0). Поэтому растворимость увеличивается с повышением температуры. Например, растворение благородных газов в органических растворителях сопровождается поглощением теплоты (гелия и неона в ацетоне, бензоле, этаноле, циклогексане).
3. От влияния давления. На растворимость твердых веществ и жидкостей в жидкостях, давление существенное влияние не оказывает, т.к. процесс растворения не сопровождается значительным изменением объема и концентрации (незначительно меняется при давлении больше 1000 атмосфер).
При растворении газа в жидкости происходит значительное уменьшение объема системы. Поэтому повышение давления согласно принципу Ле Шателье - Брауна должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малорастворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803г.):
Закон Генри – при постоянной температуре растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
С = Кг • р
Где С – концентрация газа в насыщенном растворе, моль/л;
Кг – постоянная Генри для газа, моль/л·Па Константа Генри зависит от природы газа, растворителя и температуры.;
р – давление газа над жидкостью (парциальное давление), Па
Газ не растворяется в жидкости беспредельно. При некоторой концентрации газа См устанавливается равновесие:
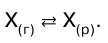
Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и отсутствии химического взаимодействия между молекулами растворяемого газа и растворителем.
В случае растворения смеси газов в жидкости в математическое выражение закона Генри вместо давления над раствором подставляют парциальное давление Рi данного компонента.
Под парциальным давлением компонента понимают долю давления компонента от общего давления газовой смеси: Рi/ Робщ
1. Парциальное давление компонента рассчитывают по формуле Рi = Робщ х(Xi)
2. где pi – парциальное давление компонента Хi;
3. Робщ – общее давление газовой смеси;
4. х(Хi) – молярная доля i-ого компонента.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач-физиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.






