Важной характеристикой любого раствора является его состав.
Существуют различные способы численного выражения состава раствора: массовая доля, молярная концентрация, нормальная концентрация, моляльная концентрация.
Концентрацией раствора называется содержание растворённого вещества в определённой массе или известном объёме раствора или растворителя.
Массовая доля растворённого вещества равна отношению массы растворённого вещества к общей массе раствора (ω). Массовая доля величина безразмерная.
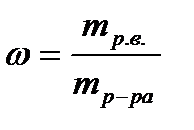
где mр.в.- масса растворённого вещества, г;
mр-ра- общая масса раствора, г; mр-ра=mр.в. +mр-ля
mр-ля- масса растворителя, г.
Массовую долю можно перевести в проценты (процентную концентрацию), умножив на 100%. Процентная концентрация показывает сколько граммов растворённого вещества в 100 г раствора.
Например,20% раствор Na2SO4 содержит 20 г Na2SO4 и 80 г H2O.
Этот способ широко распространен в технике и в быту ввиду удобства приготовления, разбавления растворов, а также практических расчетов и пересчетов в другие способы выражения концентрации. Недостатком метода является необходимость пересчета в мольные способы выражения концентрации при аналитических и стехиометрических расчетах по химическим формулам веществ и схемам химических реакций.
Молярная концентрация (молярность) равна отношению количества молей растворённого вещества к объёму раствора, выраженного в литрах.
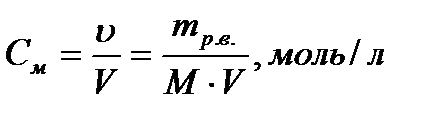
Раствор, в 1 л которого содержится 1 моль растворённого вещества, называется молярным.
Пример:1М раствор H2SO4 содержит в каждом литре 1 моль Н2SO4 или 98г.
Это наиболее распространенный способ выражения концентрации жидких растворов в аналитической и препаративной химии, так как он предполагает быстрое приготовление растворов в мерных колбах путем добавления растворителя к определенному количеству известного раствора (так называемой аликвоте) до некоторого фиксированного объема. К недостаткам метода следует отнести низкую точность приготовления растворов (измерение объемов обычно производится с точностью в несколько процентов, в то время как взвешивание имеет точность не хуже сотых долей процентов), а также изменение молярности приготовленных растворов с изменением температуры ввиду их термического расширения.
Нормальная концентрация (нормальность) равна отношению количества эквивалентов растворенного вещества к объёму раствора в литрах.
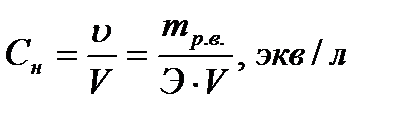
Пример:1Н раствор H2SO4 содержит в каждом литре 1 эквивалент или 49 г Н2SO4.
По сравнению с молярностью нормальность раствора имеет то важное преимущество, что при одинаковых нормальностях реагирующих растворов объемы реагирующих растворов всегда равны, так как содержат одинаковое количество эквивалентов, а вещества реагируют в эквивалентных отношениях. Вместе с тем, нормальности растворов годятся только для однотипных реакций, так как каждое вещество имеет различные эквиваленты в различных реакциях.
Моляльная концентрация (моляльность) равна отношению количества молей растворённого вещества, содержащихся в 1000 г растворителя.
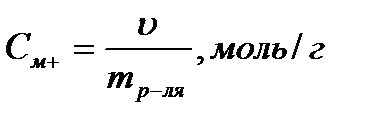
Пример:1m водный раствор H2SO4 содержит в каждом килограмме воды 1моль Н2SO4 (или 98 г Н2SO4).
Этот способ выражения концентрации широко применяется в теории растворов, особенно растворов электролитов, ввиду его независимости от температуры и возможности приготовления растворов с высокой точностью выражения концентрации. По этим причинам все современные справочники по растворам электролитов обычно используют моляльный способ выражения концентрации. Вся стандартизация электродных потенциалов, рН, активностей, растворимостей и других термодинамических свойств растворов приведена к единице моляльности. К недостаткам способа относится необходимость пересчета количества вещества, приходящегося на 1 кг растворителя, на массу или объем всего раствора.
Мольная доля – отношение числа молей растворенного вещества nв к общему количеству молей раствора nS:
Np= 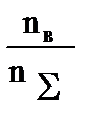 , где nS=nв+nа, где nа – число молей растворителя.
, где nS=nв+nа, где nа – число молей растворителя.
Пример:водный раствор H2SO4 с молярной долей 0,2 содержит 1 моль Н2SO4 и 4 моль H2O.
Этот способ выражения концентрации широко распространен в физической химии, так как прямо указывает на концентрацию частиц компонента в смеси частиц, независимо от природы и массы самих частиц. К недостаткам метода следует отнести крайне низкие численные значения ввиду обычно наблюдающегося огромного избытка легких молекул растворителя в практической области концентраций, а также неудобство при практическом применении, связанное с необходимостью пересчета в единицы массы через соответствующие молекулярные массы.
Титром раствора называют число граммов растворённого вещества в 1 см3 (мл) раствора 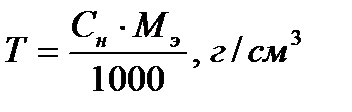
По концентрации растворенного вещества (условно) все растворы можно подразделить на концентрированные (с большой концентрацией растворенного вещества) и разбавленные (с малой концентрацией растворенного вещества).
Важное значение при описании свойств растворов имеет закон Генри: «Масса газа, растворяющегося при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа». Математически это можно записать так: С=k·р, где k – константа Генри, С – массовая концентрация газа в насыщенном растворе. Важнейшим следствием этого закона является то, что объём газа, растворяющегося при постоянной температуре в данном объёме жидкости, не зависит от его парциального давления.






