Задача 2. Расчет массовой доли, молярной концентрации и молярной концентрации эквивалента раствора.
Определите массовую долю, молярную концентрацию и молярную концентрацию эквивалента раствора, полученного при смешении 200 мл 2М раствора серной кислоты (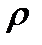 =1,18 г/мл) и 200 мл 8% раствора серной кислоты (
=1,18 г/мл) и 200 мл 8% раствора серной кислоты (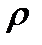 =1,05 г/мл).
=1,05 г/мл).
Решение: Рассчитаем массу первого раствора и массу серной кислоты в нем:
m(р-ра)1= 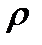 (р-ра)1 . V(р-ра)1=1,18 . 200=236 (г);
(р-ра)1 . V(р-ра)1=1,18 . 200=236 (г);
m(H2SO4)1 = 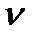 (H2SO4) . M(H2SO4)=c(H2SO4) . V(р-ра)1 . М(H2SO4)=
(H2SO4) . M(H2SO4)=c(H2SO4) . V(р-ра)1 . М(H2SO4)=
=2 . 0,2 . 98=39,2(г);
Масса второго раствора и масса серной кислоты в нем равны
m(р-ра)2 = 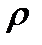 (р-ра)2 . V(р-ра)2 = 1,05 . 200=210 (г);
(р-ра)2 . V(р-ра)2 = 1,05 . 200=210 (г);
m(H2SO4)2 = m(р-ра)2 . 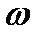 (H2SO4)=210 .0,08 =16,8 (г).
(H2SO4)=210 .0,08 =16,8 (г).
Массовую долю полученного раствора рассчитываем по формуле:
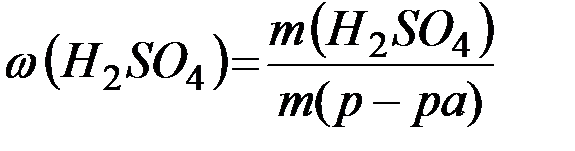 =
= 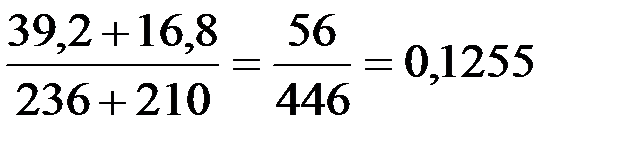 (12,6%)
(12,6%)
Молярная концентрация раствора
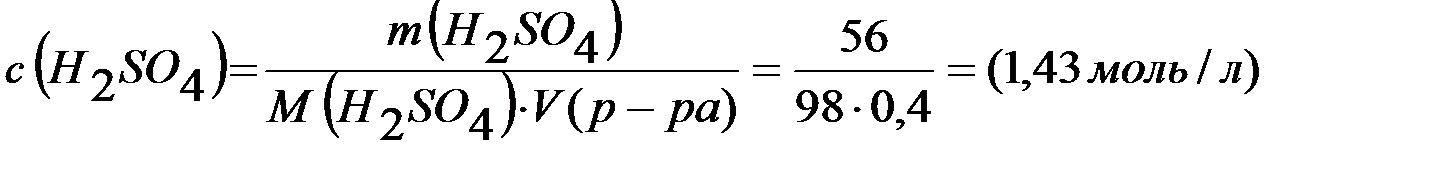 ;
;
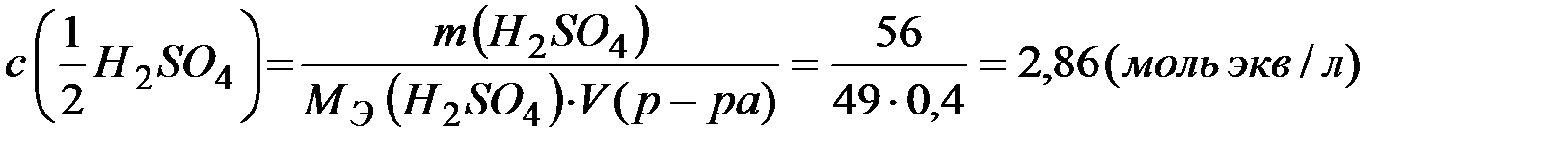
Ответ: 12,6%; 1,43моль/л; 2,86 моль экв/л
Задача 3. Расчет массовой доли, молярной концентрации, нормальной концентрации по пропорции.
Сколькограммоврастворенноговеществаискольководысодержитсяв30г10%-горастворасахара?
Массоваядоля(процентнаяконцентрация) показывает,сколькограммвеществасодержитсяв100граммахраствора.
Еслиговорят,чторастворхлориданатрия30%-й–этозначит,чтовкаждых100граммахсодержится30гNaCl.
Решение: Составляемпропорцию:
В100грастворасодержится10гсахара,аВ30грастворасодержится mгсахара
m = 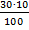 = 3г Знаямассурастворенноговещества,находятмассу m
= 3г Знаямассурастворенноговещества,находятмассу m  растворителя:
растворителя:
30-3=27гводы.
Ответ: 3г; 27 г.
Задача 4. Вкакомколичестве12%-горастворасодержится75грастворенноговещества?
Решение: Составляемпропорцию:
100грастворасодержит12грастворенноговеществаm грастворасодержит75грастворенноговеществаm =  = 625г
= 625г
Ответ: 625 г.
Задача 5. СколькограммовBaCl2нужнорастворитьв400лводы,чтобыполучить20%-йраствор?
Решение: 100грастворасодержит20гBaCl2и,следовательно,80гводы.100грастворасодержит80гводыmграстворасодержит400гводы
m = 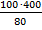 = 500гm (BaCl2) = 500 - 400 = 100 г. Ответ:100 г
= 500гm (BaCl2) = 500 - 400 = 100 г. Ответ:100 г
Задача 6. 1,5литрахводырастворили101,5гсолиMgCl2·6H2O. Вычислитьмассовуюдолюрастворапобезводнойсоли.
Решение: МолярнаямассаMgCl2·6H2Oравна203г/моль,МолярнаямассаMgCl2равна95г/моль.ОпределимколичествобезводнойсолиMgCl2в101,5гMgCl2·6H2Oпопропорции:
203г (MgCl2·6H2O)содержат95г (MgCl2)101,5г (MgCl2·6H2O)содержат mг(MgCl2):
m(MgCl2)= 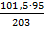 = 47,5г
= 47,5г
Найтипроцентнуюконцентрациюраствора–этозначит,чтонужнонайтиколичестворастворенноговещества,содержащеесяв100граствора.
Следовательно,составимследующуюпропорцию:1601,5грастворасодержит47,5гMgCl2,а100грастворасодержит m гMgCl2
m(MgCl2)= 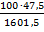 = 2,96г Ответ: 2,96 г.
= 2,96г Ответ: 2,96 г.
Задача 7. Растворение веществ, взаимодействующих с водой, инахождение концентрации полученного раствора.
Найдите массовую долю вещества в растворе, полученном при взаимодействии 4,6 г металлического натрия с 75,6 мл воды.
Решение: Запишем уравнение реакции взаимодействия натрия с водой:
0,2моль 0,2моль 0,1моль
2Na + 2H2O = 2NaOH + H2
2моль 2моль 1моль
Рассчитаем количество вещества и массу NaOH:
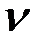 (NaOH)=
(NaOH)= 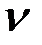 (Na) =
(Na) = 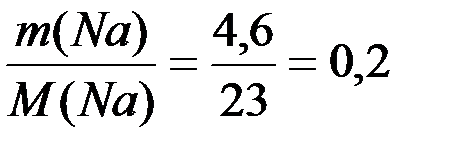 (моль);
(моль);
m (NaOH) = М(NaOH) .  (NaOH)=40 . 0,2=8(г).
(NaOH)=40 . 0,2=8(г).
Масса полученного раствора и массовая доля гидроксида натрия равны:
m(р-ра)= m(H2O) + m(Na) – m(H2) =76,5 + 4,6 - 2 . 0,1=80 (г)
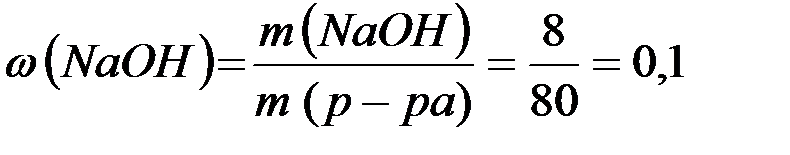 (10%).
(10%).
Ответ: 0,1(10%).






