Рассмотрим более подробно, как зависит степень диссоциации от различных факторов.
Природа электролита – главный фактор, определяющий степень диссоциации. Чем более полярной является химическая связь между атомами или группами атомов в молекуле, тем сильнее растворитель с высоким значением диэлектрической проницаемости препятствует электростатическому взаимодействию ионов противоположного знака в растворе, тем больше степень диссоциации. В том случае, если вещество содержит только ковалентные связи между атомами или группами атомов, то оно не диссоциирует в растворе. Но не всегда вещества с большей ионностью связи сильнее диссоциируют в растворах. Так, для галогеноводородов ионность связи уменьшается от HF к HI, тем не менее степень диссоциации иодоводородной кислоты значительно больше степени диссоциации фтористоводородной кислоты (см. табл. 11). Это можно объяснить тем, что в водном растворе вследствие процесса гидратации меняется характер химической связи между частицами вещества. Протон в воде сильно гидратируется и образует достаточно объёмные ионы гидроксония Н3О+, которые оказывают гораздо меньшее поляризующее действие на ион галогена, чем не гидратированный. В ряду F‾ – Cl‾ – Br‾ – I‾ радиус иона увеличивается, а это приводит к тому, что связь в молекуле HI становится более ионной, чем в HF.
Таблица 11.
Характеристики галогеноводородов и степень диссоциации их в растворах
| Свойство | HF | HCl | HBr | HI |
| Дипольный момент связи (полярность), D | 1.91 | 1.30 | 0.79 | 0.42 |
| ∆Hобр, кДж/моль | –268.61 | –92.30 | –35.98 | +25.94. |
| α (степень диссоциации) | 0.10 | 0.92 | 0.95 | 0.98 |
Увеличение константы диссоциации в ряду уксусной кислоты и ее хлорзамещенных СН3СООН – СН2ClСООН – СНCl2СООН – СCl3СООН обусловлено оттягиванием электронов от группы ОН электроотрицательным атомом хлора.
Сила бескислородных кислот Hn+Э-n зависит от радиуса иона элемента и его степени окисления, она увеличивается с ростом ионного радиуса и с уменьшением условного заряда иона n.
Сила кислородсодержащих кислот, формула которых имеет общий вид Э+(2m+n)Om(ОН)n, зависит как от природы элемента Э, так и от значений m и n. Ввиду большой электроотрицательности атома кислорода он оттягивает электроны от связей O–Н, и поэтому сила кислот увеличивается с ростом числа атомов кислорода m и уменьшением n – числа связей O–Н. Кроме того, она растет с увеличением степени окисления элемента.
О закономерностях изменения силы кислородсодержащих кислот можно судить по значениям первой константы диссоциации этих кислот в водных растворах: Сl(ОН), т. е. НОСl, В(ОН)3, Si(OH)4, Те(ОН)б (m = 0) являются слабыми кислотами (для них K1 < 10-8); NO(OH), т.е. HNO2, SO(OH)2, т.е. Н2SO3, IO(ОН)5, т.е. H5IO6 (m = 1) - значительно сильнее (для них K1 = 10-5 ÷ 10-2); NO2(OH), т.е. НNО3, SO2(OH)2, т.е. H2SO4 (m = 2) – сильные кислоты.
Природа растворителя. Природа растворителя оказывает существенное влияние на степень диссоциации растворённого вещества. Степень диссоциации в значительной мере зависит от диэлектрической проницаемости растворителя. Чем больше диэлектрическая проницаемость среды, тем больше степень электролитической диссоциации. Это хорошо видно на примере иодида тетраметиламмония, степень диссоциации которого растёт с увеличением диэлектрической проницаемости растворителя (табл. 12).
Замена воды, имеющей диэлектрическую проницаемость 81, на растворитель с меньшей диэлектрической проницаемостью, например, на этиловый спирт (ξ=25), сильно понижает степень диcсоциации. Сильные электролиты в спирте становятся электролитами средней силы, а слабые – практически не диссоциируют. Вследствие высокой диэлектрической проницаемости воды в ней даже при больших концентрациях растворённого вещества маловероятно образование ионных пар. В средах с малой диэлектрической проницаемостью ионные пары образуются легко.
Таблица 12.
Значения степени диссоциации 0,01 М раствора N+(CH3)4I‾
в различных растворителях
| Растворитель | ξ | α |
| Ацетон | 20.75 | 0.50 |
| Нитробензол | 34.7 | 0.71 |
| Вода | 0.91 |
Влияние температуры. Константа диссоциации является характерной величиной для данного электролита и растворителя и зависит лишь от температуры. Для многих электролитов существует достаточно широкий температурный интервал, в котором наблюдается простая зависимость между тепловым эффектом, степенью диссоциации и температурой. Если процесс диссоциации экзотермичен, то с повышением температуры степень диссоциации падает. При эндотермическом процессе – повышение температуры ведёт к увеличению степени диссоциации. Но в общем случае степень электролитической диссоциации сложным образом зависит от температуры (см. рис. 18).
Для многих электролитов константа диссоциации проходит через максимум. Так, степень диссоциации уксусной кислоты максимальна при 25 °С (Кд = 1,75·10–5). Выше и ниже этой температуры степень диссоциации уксусной кислоты меньше (при 0 °С Кд = 1,65·10–5, при 50 °С Кд = 1,62·10–5). В соответствии с принципом Ле Шателье это объясняется переменой знака энтальпии процесса диссоциации, что связано с различным влиянием температуры на гидратацию ионов и нейтральных молекул.

Рис. 18. Зависимость константы
диссоциации некоторых слабых
электролитов в водных растворах
от температуры
С увеличением концентрации растворов степень электролитической диссоциации уменьшается, так как ионы чаще сталкиваются друг с другом с образованием молекул или ионных пар.
Например,рассмотрим влияние концентрации растворенного вещества на степень диссоциации CH3COOH при 18 °С. (табл. 13)
Таблица 13.
Зависимость степени электролитической диссоциации и
константы диссоциации уксусной кислоты от ее концентрации
| С, моль/л | α | Кд·10–5 |
| 2,8·10-5 | 0,539 | 1,75 |
| 1,11·10-4 | 0,328 | 1,75 |
| 1,03·10-3 | 0,124 | 1,76 |
| 5·10-2 | 0,019 | 1,75 |
| 0,1 | 0,0135 | 1,69 |
Степень электролитической диссоциации, константа диссоциации и концентрация раствора связаны между собой законом разбавления Оствальда.
Рассмотрим равновесие в растворе слабого электролита, например, слабой одноосновной кислоты типа НA:
НA «Н+ + A‾ (на самом деле НA + aq «Н+aq+ A‾aq)
Из уравнения видно, что из одной молекулы кислоты в растворе в результате диссоциации появляется один катион (Н+) и один анион (А‾). Зная, какая часть электролита в растворе продиссоциировала, можно рассчитать концентрацию ионов в растворе.
Пусть исходная концентрация кислоты в растворе равна Со, моль/л, степень диссоциации кислоты в этом растворе – α, тогда:
Концентрация кислоты, которая продиссоциировала:
Сдис (НА) = a Со.
При диссоциации [A–] = [H+]. Концентрация ионов в растворе:
С (Н+) = С (А‾) = Сдис (НА) = a Со (моль/л).
Концентрацию кислоты, которая не продиссоциировала и находится в растворе в молекулярной форме найдем по разности:
Смол (НА) = Со (НА) – Сдис (НА) = Со – a Со = (1-a) Со.
Тогда запишем выражение для константы равновесия с учетом сделанных вычислений:
КД = [Н+][A‾] = a Со a Со = a2 Со 2 = a2 Сo
[HA] Смол (1-a)Сo 1-a
Для слабых электролитов a << 1, поэтому уравнение можно упростить:
КД = a2 Со
Это выражение носит название закона разбавления (Оствальд, 1888 г.) и определяет зависимость степени электролитической диссоциации от концентрации слабого электролита в растворе. Почему разбавления? Потому, что константа диссоциации слабого электролита - величина постоянная при данной температуре, следовательно чем больше Со, тем меньше a. Степень диссоциации слабого электролита растет с разбавлением:
 a = √КД / Со
a = √КД / Со
Если Kд ≈ 10–1 – 10–3, то степенью диссоциации в знаменателе мы пренебречь не можем. Тогда получается квадратное уравнение:
a2 Со + α КД – KД = 0
Схематически зависимость степени электролитической диссоциации от исходной концентрации слабого электролита приведена на рис. 19. При очень большом разбавлении α достигает предела, близкого к единице, т. е уменьшается вероятность ассоциации ионов в молекулу из-за уменьшения вероятности их столкновения.
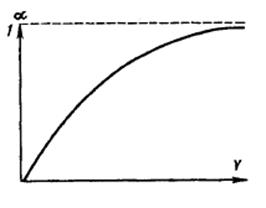
Рис. 19. Зависимость степени
электролитической диссоциации
от разбавления раствора
Для многоосновных кислот по закону разбавления Оствальда степень диссоциации рассчитывается для каждой ступени отдельно.
Ионное равновесие можно сместить также изменением концентрации одного из находящихся в растворе ионов. При прибавлении в раствор слабой кислоты или основания соли, содержащей одноимённый анион или катион для кислоты или основания соответственно, то, согласно принципу Ле-Шателье, следует ожидать смещения равновесия диссоциации влево, т.е. в сторону уменьшения степени диссоциации. Так, в растворе уксусной кислоты устанавливается равновесие:
СН3СООН ↔ СН3СОО‾ + Н+
Если к этому раствору добавить немного ацетата натрия, являющегося сильным электролитом и нацело диссоциирующим на ионы в вводном растворе:
СН3СООNa → СН3СОО‾ + Na+,
то добавленные ацетат-ионы вызывают значительный сдвиг равновесия диссоциации СН3СООН влево и, как следствие, понижение степени электролитической диссоциации уксусной кислоты и кислотности среды. Об этом свидетельствуют данные, приведённые в таблице 14.
Таблица 14.
Влияние ацетата натрия на степень диссоциации уксусной кислоты
| Концентрация СН3СООNa, моль/л | 0,0 | 0,001 | 0,002 | 0,005 | 0,010 | 0,020 |
| α СН3СООН, % | 4,1 | 1,5 | 0,84 | 0,35 | 0,18 | 0,09 |
Подобным же образом уменьшается концентрация ионов ОН‾ при введении в водный раствор аммиака какой-нибудь аммонийной соли:
NН4ОН ↔ NН4+ + ОН‾
NН4Cl → NН4+ + Cl‾
 Таким образом, введение в раствор слабого электролита одноименных ионов уменьшает его диссоциацию.
Таким образом, введение в раствор слабого электролита одноименных ионов уменьшает его диссоциацию.
Подавление диссоциации под влиянием одноимённого иона называется “репрессией ионизации”. С репрессией ионизации связаны многие процессы, имеющие практическое значение. Так, её используют для уменьшения растворимости тех или иных соединений.
Степень диссоциации определяют экспериментально из измерений электропроводности растворов, изучения спектров комбинационного рассеяния или через расчётные методы с использованием изотонического коэффициента. Но и в этом случае применяют экспериментальные данные по температурам кипения или замерзания, осмотическому давлению, упругости пара растворов.






