Объяснение особенностей свойств растворов электролитов было сделано С.А. Аррениусом в его гипотезе электролитической диссоциации. Отмеченные выше отклонения свойств растворов, определенных экспериментально, от вычисленных нельзя объяснить ничем иным, кроме как увеличением числа частиц растворенного вещества, т. е. диссоциацией молекул электролита в растворе на более мелкие частицы. Установив, что значения коэффициента i, полученные по результатам измерения понижения температуры замерзания раствора, совпадают с рассчитанными на основании данных по электропроводности, т. е. выяснив, что растворы электролитов ведут себя аналогично и при пропускании электрического тока, и в его отсутствие, Аррениус пришел к следующему выводу: диссоциация молекул растворенных электролитов происходит не под действием тока (как считали в то время), а уже в процессе растворения, независимо от того, пропускают через раствор электрический ток или нет. Вещества, растворы которых являются электролитами, при растворении распадаются на частицы (ионы*), несущие положительные и отрицательные заряды. Ионы, заряженные положительно, называются катионами, а отрицательно заряженные ионы – анионами. Катионами являются положительно заряженные ионы металлов, ион водорода (точнее, ион гидроксония H3O+), NH4+, анионы – водные и кислотные остатки.
Такой распад молекул электролитов на ионы в среде растворителя получил название электролитической диссоциации (или ионизации). В результате этого процесса в растворе увеличивается число частиц, поэтому коэффициент i принимает значения больше единицы.
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием степени электролитической диссоциации (ионизации). Степень электролитической диссоциации α равна отношению числа молекул, распавшихся на ионы n, к общему числу молекул растворенного вещества N:

Величина α показывает долю молекул электролита, распавшихся на ионы.
Можно предположить, что эквивалентная электропроводность растворов электролитов пропорциональна степени электролитической диссоциации в растворе:
λ = Kα
Из рис. 13 следует, что при очень большом разбавлении электролиты полностью распадаются на ионы, т. е. в этих условиях α = 1. Таким образом, приходим к выводу, что коэффициент пропорциональности К равен эквивалентной электропроводности при очень большом (бесконечном) разбавлении λ∞, т. е. K = λ∞. Подставляя это значение К в предыдущее уравнение, получим
α = λ / λ∞,
т. е. степень электролитической диссоциации равна отношению эквивалентной электропроводности при данном разбавлении раствора к эквивалентной электропроводности при бесконечном разбавлении. Удобно определять α также с помощью изотонического коэффициента i, который сравнительно легко измеряется эбулиоскопическим или криоскопическим методом.
Рассмотрим раствор, содержащий 1 моль электролита, т. е. NA молекул (число Авогадро). Если каждая из них распадается на ν ионов, то при степени диссоциации α в растворе число образующихся ионов и число непродиссоциированных молекул составит соответственно:
NAνα и NA – NAα = NA(1 – α).
Общее число частиц (молекул и ионов) после растворения равно
NAνα + NA(1 – α)
Отношение этого числа к числу молекул растворенного вещества даст изотонический коэффициент:
i = [NAνα + NA(1 – α)]/NА = να + 1 – α = 1 + α (ν – 1)
откуда α = (i – 1)/(ν – 1)
Величина α может изменяться от нуля (диссоциация отсутствует) до единицы (все молекулы в растворе распались на ионы).
Изотонический коэффициент Вант–Гоффа i характеризует во сколько раз увеличилось общее число частиц в растворе в результате диссоциации.
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры.
Теория Аррениуса объяснила многие явления, связанные со свойствами растворов электролитов, но не ответила на вопрос: почему одни вещества являются электролитами, а другие – нет, а также какую роль в образовании ионов играет растворитель.
Механизм диссоциации
Теорию процесса диссоциации разработал И.А.Каблуков (1891).
Как правило в растворах наблюдается взаимодействие растворенных частиц с молекулами растворителя, которое называется сольватацией (для водных растворов - гидратацией). Молекулярные группы, образующиеся в результате сольватации, носят название сольватов.
Способность к электролитической диссоциации обнаруживают вещества, образующие кристаллы или состоящие из молекул с высокополярной ковалентной связью, при растворении их в растворителях с высокой диэлектрической проницаемостью*. При переносе ионного кристалла из воздуха (ε ≈ 1) в растворитель, например, в воду(ε ≈ 81), силы притяжения между ионами уменьшаются в 81 раз и кристаллическая решетка распадается на ионы.
Представим себе, что ионный кристалл, например, кристалл каменной соли NaCl, внесен в воду. Каждый ион, находящийся на поверхности кристалла, образует вокруг себя электрическое поле. Вблизи Na+ создается поле положительного знака, вблизи Cl‾ дается электростатическое поле отрицательного знака. Влияние этих полей распространяется на некоторое расстояние от кристалла. В растворе кристалл со всех сторон окружают беспорядочно движущиеся молекулы воды. Попадая в поле действия электрических заряженных ионов, они изменяют свое движение: в непосредственной близости от кристалла они ориентируются таким образом, что к отрицательно заряженному иону Cl‾ диполи воды оказываются направленными положительно заряженным полюсом, а к положительно заряженному Na+ – отрицательно заряженным полюсом (рис. 14). Такое явление называется ориентацией полярных молекул в электростатическом поле.
Между ионами и диполями воды действуют кулоновские силы притяжения. В результате ион-дипольного взаимодействия выделяется энергия, которая способствует разрыву ионных связей в кристалле и переведению иона из кристалла в раствор. Отделенные друг от друга ионы тотчас же после разрыва связи между ними вплотную окружаются полярными молекулами воды и становятся полностью гидратированными. Теплота, выделяющаяся при гидратации ионов, называется теплотой гидратации и выражается в Дж/моль или кал/моль.
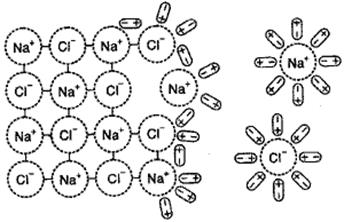 |
Рис. 14. Растворение ионных кристаллов в воде
Таким образом, механизм диссоциации веществ с ионным типом связи состоит из трёх этапов:
1. ориентация полярных молекул воды (диполей) вокруг вокруг всех выступов и граней ионного кристалла;
2. разрушение кристаллической решётки – диссоциация ионного кристалла;
3. гидратация – окружение молекулами воды ионов (образование гидратированных ионов).
Если же растворяемое вещество состоит из молекул с полярной ковалентной связью (например, HCl), то результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и полярная ковалентная связь между атомами переходит в ионную, далее уже легко образуются свободные гидратированные ионы (рис. 15).
Поляризация молекул и распад их на ионы происходит в результате диполь-дипольного взаимодействия с полярными молекулами растворителя, а 
Рис. 15. Диссоциация полярных молекул в воде
иногда и в результате образования между молекулами растворителя и растворенного вещества водородных или донорно-акцепторных связей.
Таким образом, механизм диссоциации веществ с ковалентной полярной связью включает в себя дополнительный этап:
1. ориентация полярных молекул воды вокруг полярной молекулы электролита;
2. изменение вида связи с ковалентной полярной на ионную;
3. диссоциация электролита;
4. гидратация ионов.
Под действием электрического поля иона полярные молекулы растворителя ориентируются соответствующим образом, создавая вокруг каждого иона сольватную оболочку, в которую входит определенное число молекул растворителя, прочно связанных с ионом и участвующих в тепловом движении вместе с ним как единое целое. Энергия ион-дипольных взаимодействий довольно велика (соизмерима с энергией химических связей): она тем больше, чем больше заряд* и меньше радиус иона. Наличие вокруг иона сольватной оболочки и высокая диэлектрическая проницаемость растворителя препятствует рекомбинации (объединению в молекулу) ионов.
В зависимости от способности веществ к диссоциации, их условно делят на сильные электролиты, молекулы которых полностью распадаются на ионы, и слабые электролиты, в которых диссоциирует лишь часть молекул, и неэлектролиты, не диссоциирующие на ионы. Соответственно, у сильных электролитов должно быть α = 1, у слабых 0 < α < 1, у неэлектролитов α = 0.
Практически к сильным электролитам относят электролиты с α > 0,3. В табл. 6 приведены значения α для некоторых электролитов.
Таблица 6.
Степень ионизации электролитов в 0,1 н. растворе при температуре 18°С (для сильных электролитов - кажущаяся)
| Наименование электролита | Катион | Анион | Степень ионизации, % |
| Кислоты: | |||
| Азотная | H+ | NO3‾ | |
| Соляная | H+ | Cl‾ | |
| Серная | 2H+ | SO42- | |
| Фосфорная | H+ | H2PO4‾ | |
| Сернистая | 2H+ | SO32- | |
| Уксусная | H+ | CH3COO‾ | 1.3 |
| Угольная | H+ | HCO3- | 0.17 |
| Сероводородная | 2H+ | S2‾ | 0.07 |
| Борная | H+ | H2BO3‾ | 0.01 |
| Основания: | |||
| Гидроксид натрия | Na+ | OH‾ | |
| Гидроксид калия | K+ | OH‾ | |
| Гидроксид аммония | NH4+ | OH‾ | 1.3 |
| Соли: | |||
| Тип Ме+А-, например, KCl | Me+ | A‾ | |
| Тип Ме2+А2-, например, K2SO4 | 2Me+ | A2- |
Таким образом, электролитами могут быть соединения только с ионной или полярной ковалентной связью. Электролиты могут диссоциировать только в полярных растворителях (бензол ξ = 23, диметиловый эфир ξ = 21, этанол ξ = 27, вода ξ = 81, HCN ξ = 95). В хлороформе (ξ = 5.1) диссоциации не происходит. По своим свойствам ионы отличаются от атомов и молекул.
Закон электронейтральности
При диссоциации молекул, число положительных и отрицательных ионов определяется стехиометрическими индексами в формуле молекулы. Величина заряда иона совпадает с валентностью атома или кислотного остатка, а количество положительных зарядов равно количеству отрицательных.
Электролиты, в которых ионы обладают одинаковым зарядом катиона и аниона, например, 1,1–электролит KCl (z+ = z− = 1; ν+ = ν− = 1) или 2,2–электролит CuSO4 (z+ = z− = 2; ν+ = ν− = 1), распадаются на два иона – называются симметричными. Электролиты, в которых ионы обладают неодинаковым зарядом катиона и аниона, например, 1,2–электролит K2SO4 (z+ =1; z− = 2; ν+ = 2; ν− = 1) или 3,1–электролит Al(NO3)3 (z+ =3; z− = 1; ν+ = 1; ν− = 3), называются несимметричными. Для любого типа электролита в элементарном объеме сумма зарядов анионов и катионов всегда одинакова (закон электронейтральности):

Для водных растворов к сильным электролитам относят почти все неорганические соли, такие кислоты как HCl, HBr, HI, HNO3, HClO3, HClO4, HMnO4, H2SO4, H2SeO4, гидроксиды щелочных и щелочно-земельных металлов, гидроксид таллия (I), все комплексные кислоты и гидроксиды.
Для кислот чем меньше сила притяжения водорода к кислотному остатку, тем сильнее электролит. Например, в ряду HF – HCl – HBr – HI радиус иона галогена увеличивается, сила взаимодействия с ионом водорода уменьшается и диссоциация кислоты возрастает от F− к I–. В ряду HClO – HClO2 – HClO3 – HClO4 увеличивается число атомов кислорода, оттягивающих на себя электронную плотность, что приводит к уменьшению силы взаимодействия водород – кислород, в результате чего диссоциация кислоты возрастает от HClO к HClO4. В ряду H2SO4 – H2SeO4 – H2TeO4 при одинаковом числе атомов кислорода неметаллические свойства центрального атома наиболее ярко выражены у серы и поэтому серная кислота диссоциирует полностью, а теллуровая кислота является слабо диссоциирующей.
К слабым электролитам принадлежат такие кислоты, как H2S, HCN, Н2SiO3, Н3ВО3 и др., большинство органических кислот, гидроксиды многих d-элементов (Сu(ОН)2, Сr(ОН)3 и др.), гидроксид аммония NH4OH а также немногие соли (HgCl2, CdCl2, Fe(SCN)3 и др.).
Амфотерность
Гидроксиды многих металлов в водных растворах могут диссоциировать и по кислотному, и по основному типу, то есть при диссоциации они образуют и ионы водорода, и гидроксид-ионы. Примером амфотерного электролита может служить гидроксид цинка, диссоциацию которого можно условно записать:
+OH‾ +H+
2H++[Zn(OН)4]2- ↔ Zn(OH)2(H2O)2 ↔ [Zn(H2O)4]2++2OH-,
Практически амфотерность соединения можно определить по способности его образовывать соли как с кислотами, так и со щелочами.
В кислой среде равновесие сдвигается влево, в щелочной - вправо. Это находится в соответствии с законом действия масс. Оба процесса приводят к образованию очень слабого электролита Н2O.
К амфотерным электролитам также относятся Аl(ОН)3, Ве(ОН)2, Ga(ОН)3, Сr(ОН)3, Ge(OH)2, Sn(OH)4, Pb(OH)2 и многие др. Амфотерность проявляется и у соединений, содержащих большие атомы неметаллов, например у иодноватистой кислоты НIO.
Вода также относится к слабым электролитам и амфолитам диссоциирует на ион гидроксония (H3O+) и гидроксила (OH–) по реакции:
2H2O ↔ H3O+ + OH–
Уравнение диссоциации воды в дальнейшем мы будем записывать в краткой форме:
H2O ↔ H+ + OH–
и называть концентрацию и активность ионов гидроксония концентрацией и активностью водородных ионов.
К неэлектролитам относится большинство органических соединений.






